柴胡疏肝散对四氯化碳诱导的早期大鼠肝纤维化的治疗作用
杨武斌,唐金凤,米本中
(1重庆市高新区人民医院临床药学办公室,重庆 400039;2重庆市人口和计划生育科学技术研究院,国家卫生健康委出生缺陷与生殖健康重点实验室;3重庆市中药研究院实验动物研究所;*通讯作者,E-mail:919733824@qq.com)
肝纤维化是一种慢性肝损伤疾病,是指在病毒、酒精、药物等刺激因素下所致的肝细胞外基质(extra cellular matrix,ECM)过度沉积,是各种慢性肝病共同的病理学基础[1]。持续的慢性肝损伤,会导致肝星状细胞变得更具增殖性,并转分化为成肌纤维母细胞。在肝纤维化形成的过程中,肝脏转化生长因子β1(transforming growth factor-β1,TGF-β1)是调节ECM生成与沉积最重要的细胞因子之一,其可促使肝星状细胞活化,并能促进Ⅰ型胶原蛋白(collagen type Ⅰ,Col Ⅰ)的表达,具有明显的促肝纤维化作用,被认为是肝纤维化形成的关键因子[2,3]。活化的肝星状细胞的收缩力增加归因于细胞骨架蛋白和α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达,故α-SMA的表达被用作肝星状细胞激活的标志物[4]。早期肝纤维化是一个动态的病变过程,在适当干预条件下是可以逆转的。目前,如何逆转早期肝纤维化的病理过程已成为临床工作和实验研究的热点。根据肝纤维化的临床症状及体征表现,中医将其归属于“胁痛”“积聚”等范畴。柴胡疏肝散(Chaihu Shugan powder,CSGS)是疏肝理气法的代表方,具有疏肝理气之功效,主治肝气郁滞证[5,6]。本研究模拟肝纤维化的中医肝郁血瘀病机,通过CCl4构建大鼠肝纤维化模型,研究柴胡疏肝散对大鼠肝纤维化程度和相关细胞因子变化的影响,初步探讨柴胡疏肝散对四氯化碳诱导的早期肝纤维化模型大鼠的治疗作用。
1 材料与方法
1.1 实验动物
清洁级SD大鼠60只,体质量200~250 g,由重庆市中药研究院实验动物研究所提供,生产许可证号:SCXK(渝)2017-0003。在重庆市中药研究院实验动物研究所常规条件喂养(12 h光-暗循环,室温22 ℃,湿度30%~40%)。
1.2 柴胡疏肝散水煎剂的制备
柴胡疏肝散(CSGS)包含的所有中药材均购自重庆市帛霖药业有限公司,经重庆市中药研究院米本中副研究员鉴定符合2020年版《中华人民共和国药典》质量规定。柴胡10 g,陈皮10 g,白芍6 g,枳壳6 g,川芎10 g,醋香附10 g,炙甘草2 g。称20倍处方量,将中药材充分浸泡30 min后,用10倍体积水煎1 h,取上清液,再用10倍体积水煎浓缩至含生药2 g/ml,约540 ml。
1.3 试剂和仪器
FastKing cDNA第一链合成试剂盒(天根生化科技有限公司);SYBR Green master mix(美国KAPA Biosystems);TRIzol Reagent(美国Life Technologies公司);肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)ELISA试剂盒(南京建成生物工程研究所有限公司)。PCR仪(美国Bio-Rad公司);Vortex混合仪(上海启前电子科技有限公司);超净工作台(北京半导体设备一厂)。
1.4 方法
1.4.1 动物分组及造模 将60只SD大鼠随机分为正常组、模型组、秋水仙碱组(阳性对照,0.2 mg/kg)、柴胡疏肝散低剂量组(CSGS-L组,3.5 g/kg)、柴胡疏肝散中剂量组(CSGS-M组,6.3 g/kg)、柴胡疏肝散高剂量组(CSGS-H组,12.6 g/kg),每组10只。除正常组外,各组大鼠腹腔注射40% CCl4橄榄油溶液(1 ml/kg),2次/周,共10周,建立肝纤维化模型[7];正常组以等容量橄榄油腹腔注射代替。CSGS给药组于造模同时灌胃给药,正常组和模型组给予等量蒸馏水,每天1次。肝纤维化模型复制成功的评判标准:生化指标方面表现为血清中丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、TNF-α、IL-1β和IL-6含量明显升高;肝组织中TGF-β1、Col Ⅰ、α-SMA mRNA表达显著升高;病理学变化表现为肝小叶结构破坏,有炎性细胞浸润,并出现大量纤维增生[8,9]。第10周结束实验,将全部大鼠禁食不禁水16 h,次日腹主动脉采血,取肝组织标本。
1.4.2 大鼠一般情况观察 对实验大鼠的外观体征、行为活动、体质量变化进行观察记录。
1.4.3 大鼠血清AST、ALT、TBIL检测 第10周末,使用戊巴比妥钠麻醉各组大鼠后,采集腹主动脉血液,每只大鼠约4 ml,室温静置1 h,以3 000 r/min离心10 min,分离血清,-20 ℃下保存。全自动生化分析仪检测ALT、AST和TBIL的含量。
1.4.4 大鼠血清TNF-α、IL-1β、IL-6含量测定 取“1.4.3”项下大鼠保存血清样品,严格按照ELISA试剂盒说明书检测TNF-α、IL-1β以及IL-6的含量水平。
1.4.5 HE染色法观察肝组织病理学改变 大鼠的肝组织置于4%多聚甲醛溶液固定,常规脱水。脱水后的肝组织用石蜡包埋机包埋成肝组织蜡块。然后将肝组织蜡块切成4 μm的切片。石蜡切片进行常规脱蜡、水化,蒸馏水洗涤,苏木素染色16 min,自来水洗去浮色,伊红室温染色15 s,梯度酒精脱水,二甲苯透明30 min。中性树胶封片,显微镜下观察显色结果并拍照。
1.4.6 qRT-PCR检测测定TGF-β1、Col Ⅰ、α-SMA mRNA的表达 按TRIzol试剂盒说明书提取大鼠肝组织总RNA,测定RNA的浓度及纯度。按照FastKing cDNA试剂盒说明合成cDNA第一条链。qRT-PCR扩增目的基因,反应条件:95 ℃预变性15 min;94 ℃变性20 s,60 ℃退火/延伸34 s,共40个循环。β-actin作为内参,结果采用2-ΔΔCt法进行相对定量分析。引物序列见表1。

表1 qPCR引物序列
1.5 统计学处理
2 结果
2.1 大鼠一般情况
正常组大鼠状态良好,活动灵敏,皮毛光泽,饮食和排便正常,体质量增长正常。模型组大鼠精神萎靡,活动迟缓,皮毛无光泽,体质量较造模前略增加,死亡1只。与模型组比较,柴胡疏肝散各组和秋水仙碱组状况均有改善。造模第6周开始,模型组大鼠体质量较正常组降低,差异具有统计学意义(P<0.01),柴胡疏肝散低、中、高剂量组和秋水仙碱组大鼠较模型组增加,差异具有统计学意义(P<0.01,见表2)。

表2 各组大鼠不同时点体质量比较 (g)
2.2 柴胡疏肝散对早期肝纤维化大鼠肝功能的影响
模型组大鼠肝细胞产生大量ALT、AST、TBIL,肝细胞严重受损,TBIL显著升高,以上各指标与正常组相比差异有统计学意义(P<0.01,见图1),说明大鼠肝脏摄取和排泄功能出现障碍,提示造模成功。与模型组相比,柴胡疏肝散低、中、高剂量组血清ALT、AST、TBIL均有不同程度的下降(P<0.05或P<0.01),其中柴胡疏肝散高剂量组改善程度最明显。柴胡疏肝散高剂量组与秋水仙碱组血清ALT、AST、TBIL含量相比差异无统计学意义(P>0.05,见图1)。
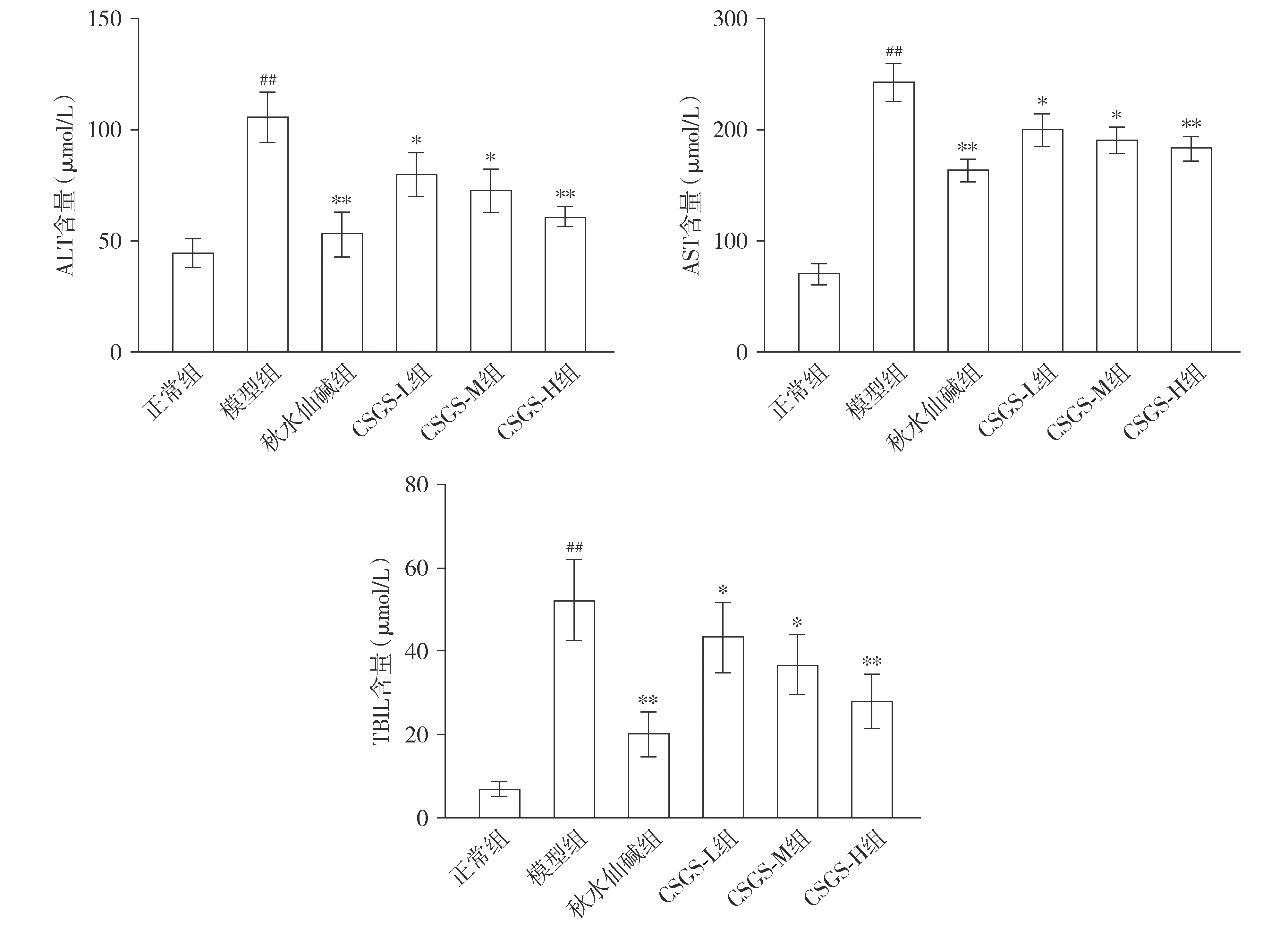
与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01图1 柴胡疏肝散对早期肝纤维化大鼠血清ALT、AST和TBIL含量的影响Figure 1 Effect of Chaihu Shugan powder on serum ALT, AST and TBIL levels in rats with early liver fibrosis
2.3 柴胡疏肝散对大鼠血清中早期肝纤维化炎症因子的影响
与正常组比较,模型组大鼠血清中TNF-α、IL-6、IL-1β含量均显著升高(P<0.01,见表3),提示造模成功。与模型组比较,秋水仙碱组和柴胡疏肝散低、中、高剂量组大鼠血清中TNF-α、IL-6、IL-1β含量均显著降低(P<0.01)。与柴胡疏肝散低剂量组相比,柴胡疏肝散高剂量组大鼠血清中TNF-α、IL-6、IL-1β含量均显著降低(P<0.05),柴胡疏肝散中剂量组大鼠血清中TNF-α、IL-1β含量均显著降低(P<0.05)。与柴胡疏肝散中剂量组相比,柴胡疏肝散高剂量组大鼠血清中TNF-α、IL-1β含量均显著降低(P<0.05)。柴胡疏肝散高剂量组与秋水仙碱组大鼠血清TNF-α、IL-6、IL-1β含量相比差异无统计学意义(P>0.05,见表3)。
2.4 柴胡疏肝散对早期肝纤维化模型大鼠肝组织病理学的影响
HE染色显示,正常组大鼠肝细胞结构正常,肝细胞大小均匀,未见变性坏死。模型组肝小叶被破坏,肝细胞不同程度的水肿、结构紊乱、明显肿胀变形,有点状、片状坏死及炎性细胞浸润,提示造模成功。秋水仙碱组较模型组肝组织结构稍正常,细胞坏死和炎症细胞浸润减轻。与模型组比较,柴胡疏肝散低、中、高剂量组大鼠肝组织病理损伤均得到不同程度的改善,肝索排列较整齐,肝小叶基本恢复正常,炎性因子减少,细胞坏死减轻,其中以柴胡疏肝散高剂量组的大鼠治疗效果最佳。秋水仙碱组与柴胡疏肝散高剂量组相比,肝小叶破坏和炎性因子浸润仍然存在,仅表现为破坏程度和数量减少,二者程度相当(见图2)。

表3 柴胡疏肝散对早期肝纤维化大鼠血清TNF-α、IL-6和IL-1β含量的影响
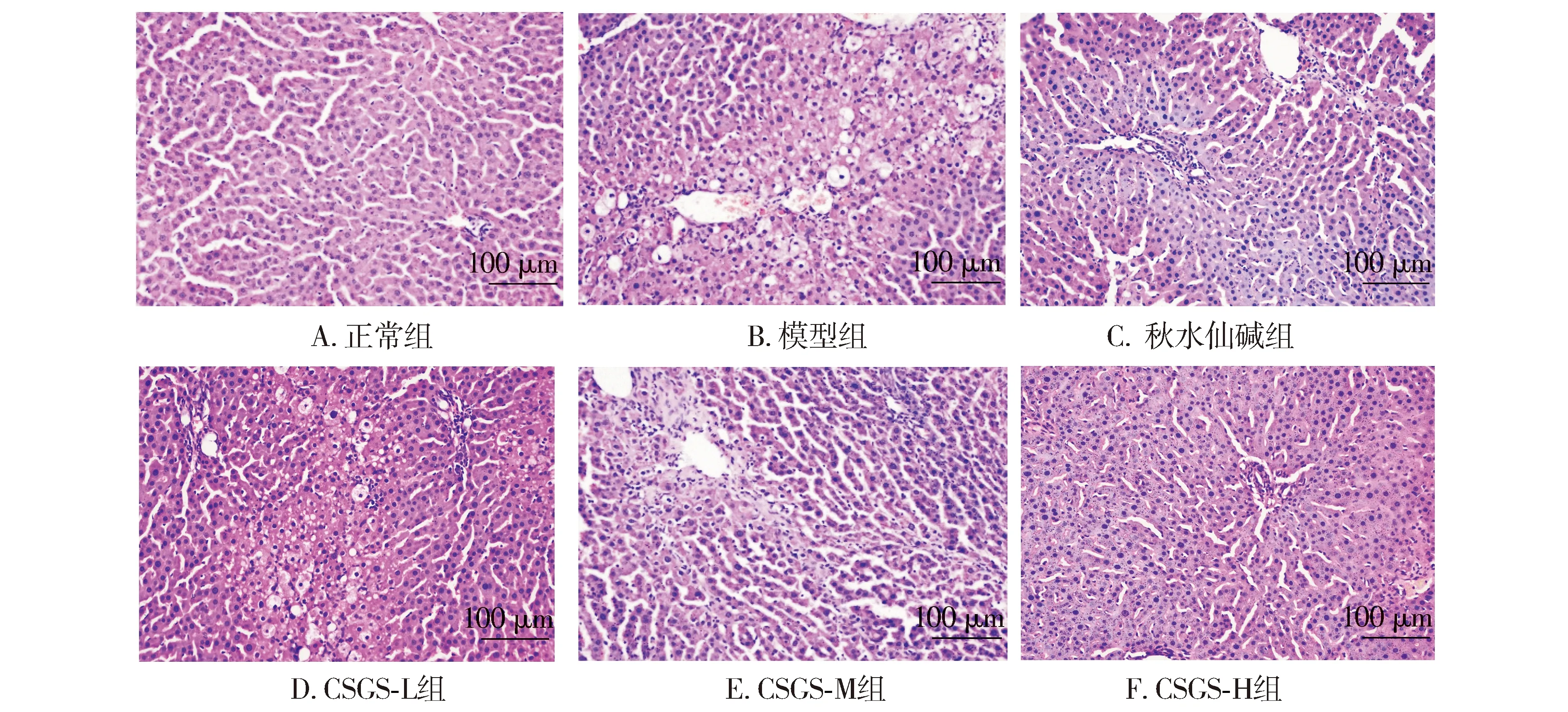
图2 HE染色观察各组大鼠肝组织病理改变Figure 2 Pathological changes of liver tissue in each group by HE staining
2.5 柴胡疏肝散对肝组织TGF-β1、Col Ⅰ、α-SMA mRNA表达的影响
qRT-PCR结果分析显示,与正常组比较,模型组TGF-β1、Col Ⅰ、α-SMA mRNA的表达显著升高,差异具有统计学意义(P<0.01,见图3),提示造模成功。与模型组比较,秋水仙碱组TGF-β1、Col Ⅰ、α-SMA mRNA的表达显著降低(P<0.01)。与模型组比较,柴胡疏肝散各剂量组TGF-β1、Col Ⅰ、α-SMA mRNA的表达均显著降低(P<0.05或P<0.01),其中柴胡疏肝散高剂量组降低程度最为明显。柴胡疏肝散高剂量组与秋水仙碱组肝组织TGF-β1、Col Ⅰ、α-SMA mRNA表达水平相比差异无统计学意义(P>0.05,见图3)。

与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01图3 柴胡疏肝散对肝组织TGF-β1、Col Ⅰ、α-SMA mRNA表达的影响Figure 3 Effect of Chaihu Shugan powder on TGF-β1, Col Ⅰ, α-SMA mRNA expression in liver tissue
3 讨论
肝脏是人体解毒器官,有害物质沉积于肝脏或免疫反应均可造成肝细胞损伤、肝组织变性,引起肝内结缔组织增生等一系列代偿反应而形成肝纤维化。根据其病理学特点,正常的肝细胞之间有一些纤维组织,纤维组织特别少,如果纤维组织增加,则称为肝纤维化,即为肝硬化发生的早期可逆阶段。与早期肝硬化相比,晚期肝纤维化中肝组织假小叶及结节形成,已发展成肝硬化,为非可逆阶段。因此,有效治疗早期肝硬化即肝纤维化是阻止其向肝硬化甚至肝癌发展的重要手段。
目前化学合成药物对于肝纤维化的治疗效果并不理想,反而有引起药源性疾病的风险。越来越多的学者开始对传统中草药进行研究,以期找到更好的治疗肝纤维化药物。临床以秋水仙碱治疗肝纤维化,但其具有较大的细胞毒性,常见的不良反应包括:消化道反应、骨髓毒性反应,严重时可导致骨髓抑制、肾脏衰竭等致命性并发症。近年来,中医药治疗肝病已成为研究热点,柴胡疏肝散作为经典方剂,以其多靶点、多途径、整体调控的作用特点在肝纤维化治疗中具有独特的优势[10]。经查阅文献柴胡疏肝散在临床使用中尚未见不良反应事件的明确报道[11,12],但是因其在临床广泛治疗众多疾病,对于其方证的把握务需准确,才能保证其疗效和安全性,从而逐步扩大本方新的治疗领域和范围[13]。本研究是以秋水仙碱为阳性对照,通过大鼠肝纤维化模型对柴胡疏肝散改善肝损伤和肝纤维化的作用进行了探索。
CCl4是一种选择性肝毒性物质,在肝脏中可引起毒性三氯甲基(CCL3)自由基,引起炎症反应,能激活肝星状细胞产生ECM,导致肝纤维化[14]。本研究模型组大鼠的肝结构被破坏,出现炎性细胞浸润,说明大鼠肝纤维化模型建立成功。AST、ALT和TBIL是临床应用最广泛的检测肝功能的生化指标。当外部刺激因素导致肝细胞变性或者坏死时,肝细胞膜通透性增加甚至破裂,ALT和AST分别从胞浆和线粒体内迅速释放出来,血清中ALT和AST随之显著升高。此外,肝细胞变性或者坏死时会导致胆红素代谢发生紊乱,血清中TBIL也会相应升高。因此,上述这些指标血清水平的高低能直接反应肝损伤程度。本研究模型组与正常组相比,大鼠血清中AST、ALT和TBIL水平均显著升高,表明CCl4诱导的模型大鼠的肝功能明显受损;而柴胡疏肝散干预后,大鼠血清中上述肝损伤指标水平均显著降低,说明柴胡疏肝散可明显改善肝纤维化大鼠肝功能。
炎症途径在肝纤维化的发生及发展中起着至关重要的作用,炎症因子TNF-α、IL-1β、IL-6可以直接促进HSC的激活,参与和促进了肝纤维化的进程[15,16]。本研究显示,与正常组相较,模型组大鼠血清中TNF-α、IL-1β、IL-6含量均显著升高,表明CCl4诱导的模型大鼠出现了明显的肝纤维化,提示模型建立成功;而给予秋水仙碱和柴胡疏肝散干预后,可显著降低大鼠血清中炎症因子含量,提示柴胡疏肝散可显著减少大鼠肝脏炎症浸润,降低肝纤维化程度。
TGF-β1是目前公认的最强促纤维化因子之一,也是肝星状细胞激活过程的最重要因子,在肝纤维化形成中发挥重要的作用[2]。在形成肝纤维化的过程中,α-SMA和Col Ⅰ的表达也逐渐增加。本研究模型组大鼠肝组织中Col Ⅰ、TGF-β1和α-SMA mRNA表达明显增加,肝组织中胶原纤维增生,柴胡疏肝散干预后,Col Ⅰ、TGF-β1和α-SMA表达显著降低,提示柴胡疏肝散可能通过降低TGF-β1和α-SMA的表达减少肝星状细胞的活化,从而减轻肝纤维化。柴胡疏肝散还可能通过减少Col Ⅰ,降低细胞外基质积累,减轻胶原聚集。
综上所述,本研究表明,柴胡疏肝散具有改善CCl4诱导的大鼠早期肝纤维化的作用,其机制可能与抑制Col Ⅰ、TGF-β1和α-SMA的表达、降低炎症因子的释放有关。肝纤维化疾病的病因复杂、致病因素多。柴胡疏肝散抗肝纤维化的作用机制尚不明确,故还需要更深入的研究加以证实。

