基于网络药理学及分子对接技术分析蠲痹汤加减治疗类风湿关节炎的作用机制*
亓伟钰,李 鑫,满荣勇,曹建中
(1.湖南中医药大学中医诊断学湖南省重点实验室,湖南 长沙 410208;2.怀化市第一人民医院,湖南 怀化 418000)
类风湿关节炎(rheumatoid arthritis,RA)是以慢性关节滑膜炎症、进行性骨侵蚀为主要临床特征的自身免疫疾病。流行病学调查显示,中国RA发病率为0.2%~0.4%,5年内致残率高达40%~50%[1]。据中华医学会风湿病学分会最新指南,RA常用药物主要有甲氨喋呤、来氟米特、柳氮磺胺嘧啶等改善病情的抗风湿药物,阿达木单抗、依那西普、托法替布等生物制剂,激素及非甾体类药物四类。甲氨蝶呤、来氟米特等可以部分延缓RA炎症进程,但临床疗效缺乏足够的循证证据,且存在胃肠道不适、骨髓抑制、肝硬化、肾损害等诸多不良反应[2]。而新型生物制剂不仅价格昂贵,且30%患者存在首次治疗失败,二次治疗不敏感等缺点,其安全性亦缺乏足够的循证数据[3]。
蠲痹汤出自清·程国彭《医学心悟》,由羌活、独活、肉桂、秦艽、当归、川芎、甘草、海风藤、桑枝、乳香、木香组成。全方温而不燥,通而不伤正,“通治风、寒、湿三气,合而成痹”。蠲痹汤也是国家中医药管理局颁布的《古代经典名方目录(第一批)》入选方剂。临床研究显示,蠲痹汤单独使用或联合西药治疗RA具有一定疗效,但多为单中心、小样本的临床研究(randomized controlled trial,RCT),其RCT方案设计和研究质量良莠不齐,尚缺乏其临床疗效及安全性的循证证据。同时,蠲痹汤治疗RA的生物学机制研究较少,且仅聚焦于炎症细胞因子。蠲痹汤原方中肉桂可通九窍,利关节。但肉桂长于补火助阳,引火归原,而本病多以闭阻经络,不通则痛为主。相与肉桂比较,桂枝药性更加温和,更善温通经脉、通痹止痛,可用于治疗关节痹痛。且营卫不和为痹证发病的重要原因。故本研究使用桂枝代替原方桂心进行研究。
基于此,本研究拟运用网络药理学与分子对接研究策略,探讨蠲痹汤加减治疗RA的潜在机制,以期为后续开展实验研究提供参考。
1 方法
1.1 网络药理学预测
1.1.1 中药活性成分及靶基因筛选 通过中药系统药理学与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP),分别以羌活、独活、桂枝、秦艽、当归、川芎、甘草、海风藤、桑枝、乳香、木香为关键词,检索蠲痹汤加减所有成分。以口服生物利用度(Oral Bioavailability,OB)≥30%、类药性(Drug-likeness,DL)≥0.18为筛选标准,获得符合标准的药物成分及靶基因。
1.1.2 RA相关靶基因筛选 基于GeneCards数据库(https://www.genecards.org)、OMIM(http://www.omim.org)、TTD(http://db.idrblab.net/ttd/)和Drugbank(https://www.drugbank.ca)进行检索。为明确蠲痹汤加减药物相关靶点与RA靶点间的相互作用,利用微生信在线作图平台(http://www.bioinformatics.com.cn/)绘制交集靶点的韦恩图。
1.1.3 建立“中药-有效成分-靶点”网络 将药物及其有效成分、靶点基因整理至Excel表格,利用Cytoscape 3.7.1软件建立“中药-有效成分-靶点”网络图,明确其有效成分。
1.1.4 RA与蠲痹汤加减共同靶点筛选及PPI建立 通过Excel将交集靶基因导入在线String数据库(https://string-db.org),建立疾病靶基因蛋白互作网络(PPI)模型,生物种类选择“Homo sapiens”,设置置信度为≥0.9,隐藏游离靶点,得到PPI图。通过Cytoscape 3.7.1中CytoNCA插件对网络互作关系进行拓扑分析,筛选介数中心性(betweenness centrality,BC)、接近中心性(closeness centrality,CC)、度中心性(degree centrality,DC)、特征向量中心性(Eigenvector centrality,EC)、局部连通性(local average connectivity-based method,LAC)、网络中心性(network centrality,NC)均大于中位数的节点作为核心基因靶点。
1.1.5 交集靶点的GO与KEGG富集分析 通过GO数据库及KEGG数据库对蠲痹汤加减与RA共同靶点进行GO和KEGG通路富集分析,设定阈值≤0.5,GO分析选择生物过程(BP)、分子功能(MF)和细胞组成(CC)3个部分进行,通路分析选择KEGG,并绘制条形图和气泡图。
1.2 分子对接
1.2.1 蛋白靶点及小分子结构准备 将degree值排名靠前的核心靶标和活性成分进行分子对接。从RCSB PDB数据库(https://www.rcsb.org/structure)下载核心靶点蛋白晶体结构,采用Pymol 2.1软件删除蛋白分子中的无关小分子;从PBD数据库下载化合物结构,通过Chem3D对所下载的化合物进行优化,并转化为“mol 2”格式。将处理好的蛋白分子和小分子化合物导入AutoDock Tools1.5.6软件进行常规预处理,并保存为“pdbqt”文件。
1.2.2 对接过程 将处理后的化合物作为小分子配体,蛋白靶点作为受体,根据小分子与靶点相互作用确定Grid Box的中心位置及长宽高。最后通过AutoDock进行批量分子对接,采用Pymol 2.1软件进行可视化。使用Lamarckian遗传算法进行分子对接计算,并根据结合自由能评估最终对接结构,分析化合物与靶蛋白的相互作用模式及与活性位点残基作用情况。
2 结果
2.1 网络药理学结果
2.1.1 蠲痹汤加减活性成分及靶基因筛选 通过TCMSP数据库对蠲痹汤加减进行检索,筛选符合标准的有效成分共172个,其中羌活15个、独活9个、桂枝7个、秦艽2个、当归2个、川芎7个、甘草92个、海风藤21个、桑枝3个、乳香8个、木香6个,具体有效成分见表1。得到靶基因共11 213个,其中羌活1 243个、独活650个、桂枝2 402个、秦艽157个、当归864个、川芎1 356个、甘草2 506个、海风藤372个、桑枝204个、乳香659个、木香800个,获得有效靶基因2 175个,删除重复靶标,最终获得223个靶标。

表1 蠲痹汤加减药物组成的部分有效成分
2.1.2 RA相关靶基因的筛选 通过GeneCards、OMIM、TTD和Drugbank数据库筛选RA相关靶标,得到靶基因4 958个,取相关度≥1的靶基因。GeneCards数据库共获得2 810个基因靶点;OMIM数据库共获得27个基因靶点;TTD数据库共获得141个基因靶点;Drugbank数据库共获得571个基因靶点;将其合并去除重复值,最终获得RA相关靶点2 933个。基于RA相关靶点与蠲痹汤加减作用靶点之间的相互作用,将筛选出的疾病药物靶点输入微生信在线平台获取韦恩图,结果显示共有交集靶点157个。(见图1)
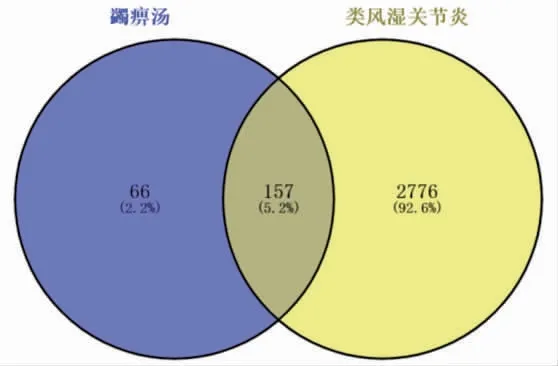
图1 蠲痹汤加减与类风湿关节炎共有靶点韦恩图
2.1.3 中药有效成分-靶点网络建立 将收集到的有效成分及靶点的关系导入Cytoscape 3.7.1软件,建立“中药-有效成分-靶点”网络图,得到304个节点与1 383条相互作用关系。(见图2)其中紫色代表药物活性成分,蓝色代表靶点基因。通过分析中药-有效成分-靶点网络获得该网络中与靶点联系最为密切的成分为槲皮素、山奈酚、柚皮素。(见表2)
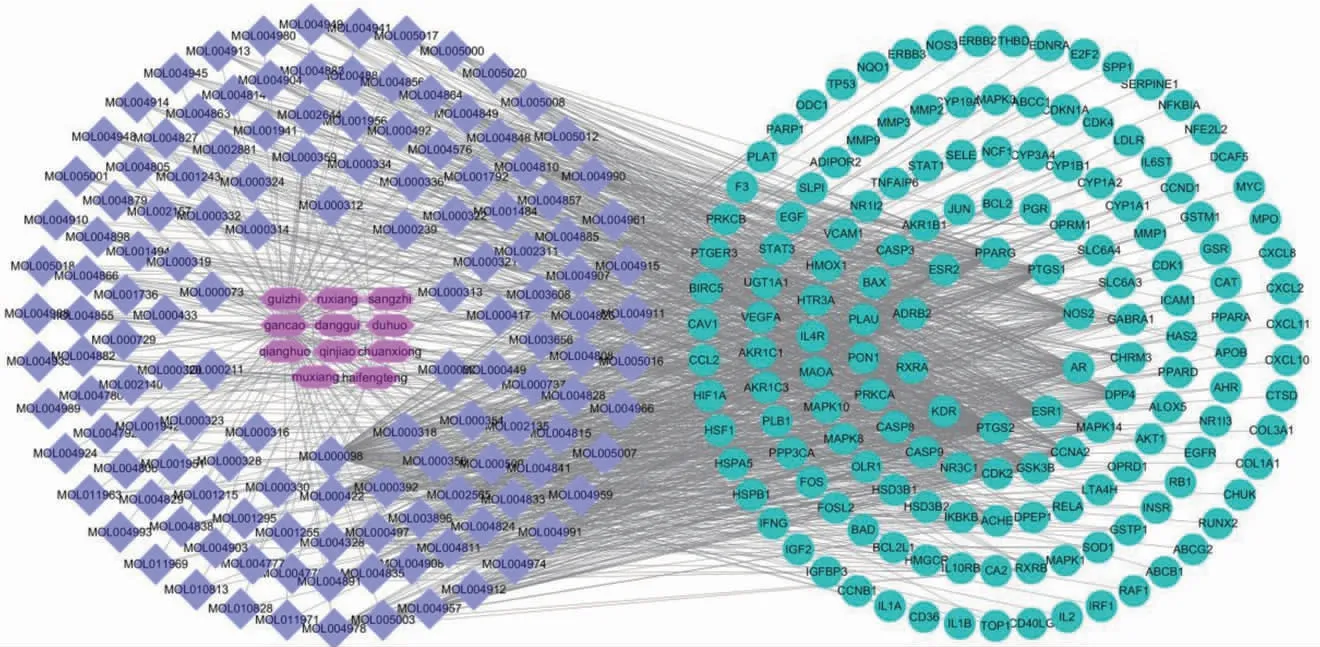
图2 蠲痹汤加减中药-有效分-靶点网络图

表2 与靶点联系最密切的有效成分及相关信息
2.1.4 PPI网络建立与核心靶点的筛选 将已获得的交集基因靶点导入String在线数据库进行分析,设定置信度≥0.9,隐藏游离基因靶点得到PPI网络图,图中“边”代表交集基因间的关联,“边”的粗细代表其结合度的大小,“边”越粗,其结合度越大;节点为作用的交集基因。共得到节点数量157个,626条边,平均节点度为7.97,平均局部聚类系数为0.493。使用Cytoscape3.7.1软件对PPI网络图进行拓扑分析,得到核心靶点,Degree值排在前10位的为TP53、JUN、MAPK3、FOS、STAT3、MYC、MAPK1、ESR1、MAPK14、MAPK8。(见图3)

图3 蛋白互作网络图(A)和PPI 网络核心靶点的筛选(B)
2.1.5 GO富集分析 通过对交集靶点的生物过程(BP)、细胞成分(CC)、分子功能(MF)进行GO富集分析,绘制条形图,条形柱的长度表示基因的数目,柱子越长说明富集在GO上基因的数目越多,柱子的颜色代表富集的显著性(即P值),颜色越红则说明富集到该功能的显著性越高。(见图4)结果显示,交集靶点主要涉及氧化应激应答(response to oxidative stress)、脂多糖应答(response to lipopolysaccharide)、细菌来源分子应答(response to molecule of bacterial origin)、氧化应激(cellular response to oxidative stress)等生物过程;主要参与膜筏(membrane raft)、膜微区(membrane microdomain)、蛋白激酶复合物(protein kinase complex)等细胞成分的组成;主要发挥DNA结合转录因子的结合(DNA-binding transcription factor binding)、RNA聚合酶Ⅱ特异性DNA结合转录因子的结合(RNA polymerase Ⅱ-specific DNA-binding transcription factor binding)、核受体活性配体激活(nuclear receptor activity ligand-activated)、RNA聚合酶Ⅱ特异性DNA结合转录激活因子活性(DNA-binding transcription activator activity,RNA polymerase Ⅱ-specific)等分子功能。

图4 GO 富集分析条形图
2.1.6 交集靶点的KEGG富集分析 通过对交集靶点进行KEGG通路富集分析,绘制气泡图,气泡的大小表示基因的数目,气泡越大说明富集在该通路上基因的数目越多,气泡的颜色代表富集的显著性,颜色越红则说明在该通路上富集越显著。结果显示,蠲痹汤加减可能通过PI3K/Akt、AGE/RAGE、TNF、IL-17、雌激素受体、Th17细胞分化等通路发挥其对RA的治疗作用。(见图5)
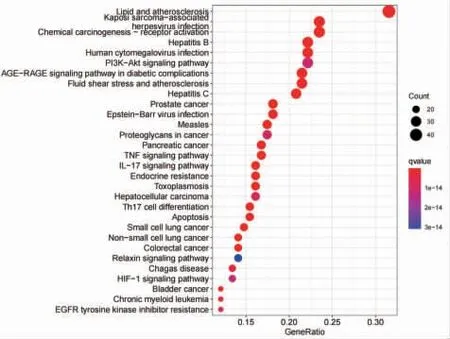
图5 KEGG 富集分析气泡图
2.2 分子对接结果 将槲皮素(Quercetin)、柚皮素(Naringenin)及山奈酚(Kaempferol)化合物结构与JUN、MAPK3、TP53靶点蛋白进行分子对接。结果表明,多数化合物与蛋白的结合能<-6 kcal/mol,存在较强的结合作用。(见表3)将对接后化合物与蛋白形成的复合物利用Pymol 2.1软件进行可视化,得到化合物与蛋白的结合模式,可清晰地显示化合物与蛋白口袋相结合的氨基酸残基。化合物与靶点蛋白结合较好,存在多种相互作用,与靶蛋白活性位点的匹配度较高,是潜在的活性化合物小分子。(见图6)
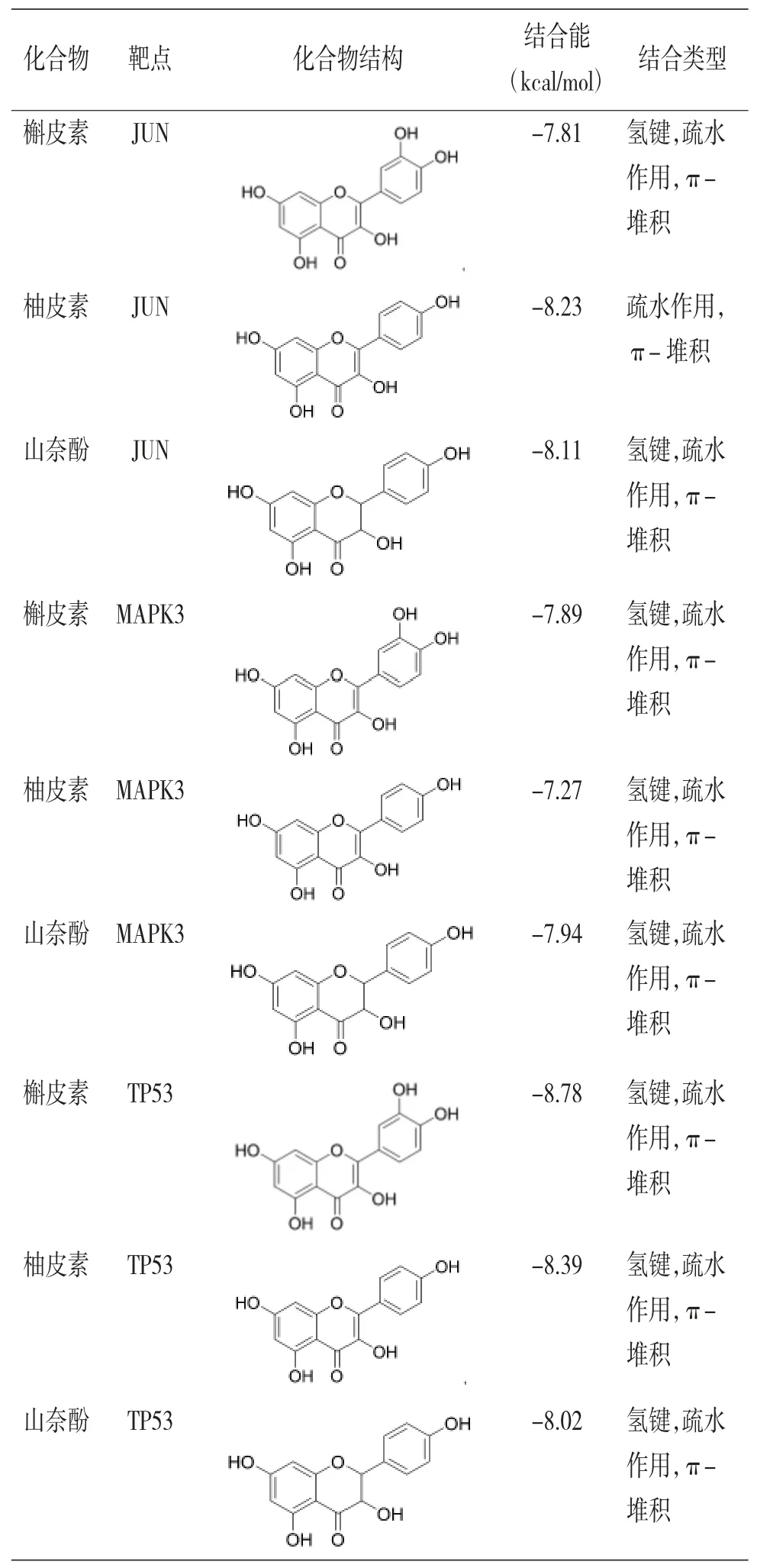
表3 化合物与靶蛋白对接结果
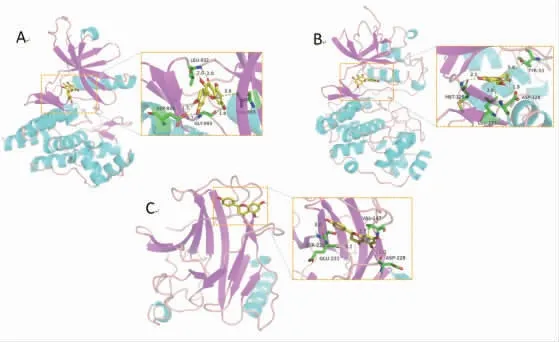
图6 分子对接模拟图
3 讨论
中医学认为RA属于“痹证”范畴。机体正气不足,又合时感风寒湿之邪,三气挟杂入侵机体,痹阻经络、关节、筋骨而发病。蠲痹汤加减以羌活、独活为君药,散一身上下之风湿,通利关节而止痹痛。臣以海风藤祛风通络,止痹痛;桑枝祛风湿,利关节;秦艽祛风湿,清湿热,止痹痛,三药合用,共助君药祛风湿止痛。佐以桂枝通经络、利关节以止痛;当归、川芎活血又补血,以防湿邪壅聚、痹阻脉道成为瘀血;乳香通经络、止痹痛;木香行气通滞。使以甘草温调和缓。全方共奏祛风除湿、活血通络、行气止痛之功。
本研究共筛选出有效成分172个,从活性成分-靶点互作网络构建结果中得知其关键活性成分主要有槲皮素、柚皮素及山奈酚等。从各味药有效成分来看,其中独活、羌活、当归、川芎、桂枝、秦艽中均含有β-谷甾醇,木香含有谷甾醇。研究发现,β-谷甾醇可发挥抗炎作用,β-谷甾醇及其糖苷还可以增加T-淋巴细胞增殖,发挥免疫调节作用[4]。多味药物共同发挥作用,能明显增强其抗炎、免疫调节作用。滑膜炎是RA的主要表现,即滑膜受到外界刺激,出现大量增生,形成炎症;FIRESTEIN G S等[5]认为RA组织滑膜异常增生的原因可能是滑膜细胞凋亡机制障碍。有研究表明羌活醇和异欧前胡素能抑制大鼠成纤维样滑膜细胞的增殖,并具有抗炎的功效[6-7]。本研究显示,羌活、独活均含有异欧前胡素,且羌活最主要的成分即为羌活醇和异欧前胡素。本方以羌活、独活为君药,既散风寒、通利关节,又抑制滑膜增生、抗炎,可对RA起到关键治疗作用。桑枝为臣药,其主要成分为山奈酚、桑色素等,其中桑色素可通过抑制PI3K/AKT/NF-κB信号通路抑制脂多糖诱导的内皮细胞炎症反应,而山奈酚可通过调控bFGF-FGFR3-RSK2信号抑制滑膜细胞TNF-α、IL-17、IL-21表达[8]。当归、海风藤、木香中含有豆甾醇成分,可助君药治疗骨关节炎[9]。此外,木香中的菜蓟苦素可抑制炎症介质和淋巴细胞增殖,可能是木香抑制TNF-α的主要成分[10]。乳香中含有乳香酸成分,在体外实验中被证明有抗炎作用[11]。桂枝的有效成分花旗松素、表儿茶素均具有良好的抗炎作用,可作为治疗类风湿关节炎的新药进行研究[12-13]。使药甘草中含有槲皮素、柚皮素等成分。有研究证实,槲皮素可通过抑制Th17/Treg平衡,抑制IL-17A、IL-21、TNF-α等细胞因子的表达而减轻关节炎大鼠炎症反应[14];柚皮素可通过抑制TNF-α、IL-6等炎症细胞因子表达,抑制脾脏Th1和Th17细胞分化及NF-κB、MAPK等通路而改善关节炎小鼠或大鼠炎症浸润[15]。
GO及KEGG分析显示,蠲痹汤加减治疗RA可能与调控PI3K/AKT、AGE/RAGE、TNF、IL-17、雌激素受体、Th17细胞分化等通路有关。研究显示,PI3K/AKT对RA慢性滑膜增生、血管翳形成及骨破坏3个病理环节均有促进作用[16]。AGE/RAGE信号通路可通过活化HMGB1进而活化NF-κB,介导RA炎症细胞因子风暴,从而导致RA发生发展[17]。Th17细胞主要分泌IL-17、IL-21等炎症细胞因子,具有促进炎症反应、促进关节软骨和骨破坏进程等多重效应[18]。
分子对接结果显示,槲皮素、柚皮素及山奈酚与JUN、MAPK3、TP53等RA核心靶点蛋白具有较好的结合能力。TP53是RA的负向调节因子,TP53缺失可使滑膜细胞过度增殖,Treg分化受损,从而导致RA的发生发展[19]。JUN、MAPK3激酶是MAPK家族成员。MAPK通路是介导RA关节局部炎症和骨质破坏的重要信号通路之一,对机体炎症反应有抑制作用[20]。这些相互作用可以提高化合物的稳定性,可能是治疗RA的潜在靶标。
综上,蠲痹汤加减可能通过方中药物的多种活性小分子,作用于免疫调节、抗炎等多个环节而发挥其整合效应治疗RA。网络药理学多为预测性结果,旨在给予研究者相关的分子研究方向。后期研究应注重对预测关键靶标及通路进行相关药理学研究以确证。

