异钩藤碱对缺血性脑卒中模型大鼠脑损伤及神经元自噬的影响*
成家宏,孟毅,乔明亮
(河南省中医院/河南中医药大学第二附属医院,河南 郑州 450002)
脑卒中是继心脏病和癌症之后的第三大死亡原因[1],其中缺血性脑卒中(ischemic stroke,IS)占所有脑卒中病例的85%以上。目前IS有效疗法为组织纤溶酶原激活剂和血管内血栓切除术[2],但因缺血半暗带(ischemic penumbra,IP)时间窗和继发性缺血再灌注(ischemia/reperfusion,I/R)损伤,患者可接受率较低[3]。在IS引起的缺血、缺氧和营养缺乏等应激条件下,IP神经元的自噬过程被激活。研究认为,自噬对IP神经元存活至关重要[4],提示自噬可能是治疗IS的重要靶点。IS神经元损伤与氧供需失衡有关。缺氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)是IS缺氧的关键反应物之一,mTOR是调节自噬经典信号通路的关键因子。研究发现,缺氧状态下,HIF-1α可负调节哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)并诱导自噬[5]。异钩藤碱(isorhynchophylline,IRN)是一种从钩藤中提取的四环羟吲哚生物碱,具有抗炎、抗凋亡、抗神经毒性、调节自噬等作用[6]。但目前关于IRN对脑损伤尤其是对IS脑损伤的影响及可能作用机制方面的报道较少,故本实验拟利用线栓法致大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)以构建IS模型,并以依达拉奉作为阳性对照,探讨IRN对IS模型大鼠I/R脑损伤和神经元自噬的影响,分析其可能作用机制是否与HIF1α/mTOR通路有关,以期为IRN临床应用及IS临床治疗提供一定的参考价值。
1 材料与方法
1.1 实验动物 8周龄SPF级雄性Wistar大鼠75只,体质量(200±20)g,购自长沙市天勤生物技术有限公司,动物生产许可证号:SCXK(湘)2019-0013。实验前大鼠于24 ℃恒温、50%恒湿环境下,适应性饲养1周,12 h光-暗交替,自由获得饮水、饲料。本研究动物处置符合“3R”原则,经河南省中医院动物伦理委员会批准,伦理批号:HNZY-2020078。
1.2 药品与试剂 IRN(纯度≥98%,批号:6859-01-4)购自成都仪睿生物科技有限公司;依达拉奉(纯度≥99%,批号:89-25-8)购自美国Sigma公司;TTC染色试剂盒(批号:298-96-4)购自北京索莱宝生物科技有限公司;兔抗微管相关蛋白1轻链3B(microtubule associated protein 1 light chain 3B,LC3B)(批号:ab63817)、HIF-1α单克隆抗体(批号:ab179483)、mTOR单克隆抗体(批号:ab134903)、磷酸化哺乳动物雷帕霉素靶蛋白(phosphorylated mammalian target of rapamycin,p-mTOR)单克隆抗体(批号:ab137133)、自噬相关蛋白Beclin1单克隆抗体(批号:ab207612)、自噬降解底物P62蛋白(autophagy degradation substrate p62 protein,p62)单克隆抗体(批号:ab91526)均购自美国Abcam公司。
1.3 主要仪器 Oxylab LDF型激光多普勒血流仪(北京拜安吉科技有限公司);PerkinElmer EnVision型多功能酶标仪(美国PerkinElmer公司)。
1.4 分组与给药 75只大鼠按随机数字表法分为假手术组、模型组、IRN低剂量组、IRN高剂量组、依达拉奉组,每组15只。其中IRN低剂量组、IRN高剂量组大鼠腹腔注射给药剂量分别为20、40 mg/(kg·d)[7];依达拉奉组大鼠腹腔注射给药剂量为3 mg/(kg·d)[8];假手术组及模型组大鼠腹腔注射等体积生理盐水,1次/d,连续7 d。
1.5 IS大鼠模型构建 末次给药后,禁食不禁水12 h,除假手术组外,其他各组利用腔内MCAO诱导制备IS模型大鼠[9],具体操作:腹腔注射水合氯醛(0.4 g/kg)麻醉大鼠,将其放于温控加热垫上操作以保持正常体温。颈部中线切口,分离右侧颈总动脉、颈内动脉和颈外动脉,将一根带硅胶珠尖端的4/0单丝尼龙经颈外动脉插入右侧颈内动脉,阻断右侧大脑中动脉血液供应,激光多普勒血流仪监测右侧大脑中动脉的血流量,见血流量下降并低于基线30%即成功缺血,缺血2 h后撤回单丝进行血液再灌注。假手术组大鼠未中断血液供应,其他手术操作同上。
1.6 观察指标
1.6.1 神经功能缺损评分 血液再灌注24 h后,由实验不知情研究人员评估各组大鼠神经功能缺损评分[10]:正常,对称运动,无任何异常体征计0分;提尾时对侧前肢屈曲计1分;大鼠步态不稳,向脑损伤一侧转圈计2分;无法支撑身体而右侧躺卧计3分;意识水平降低,无自发性活动计4分;死亡计5分。
1.6.2 TTC染色测定脑梗死面积 麻醉大鼠并脱颈处死,取7只大鼠脑组织并称重(湿质量),作2 mm冠状冷冻切片,于37 ℃的2% TTC染液中孵育30 min,4%多聚甲醛4 ℃固定6 h。正常组织区域为红色,缺血梗死区因无线粒体酶活性而呈白色。采用Image J图像分析软件计算脑梗死面积,梗死面积百分比=白色面积/总面积×100%。
1.6.3 脑组织水含量测定 TTC染色后的脑切片于110 ℃干燥48 h,称重(干质量)。脑组织水含量=(湿质量-干质量)/湿质量×100%。
1.6.4 HE染色检测大鼠脑组织病理变化 取剩余8只大鼠部分脑组织,常规石蜡包埋制备5 μm厚度脑切片。二甲苯脱蜡,乙醇脱水,苏木精染色2 min,伊红染色1 min,常规脱水,透明,中性树脂封片。400倍镜下观察并记录各组大鼠脑组织切片病理情况。神经元细胞核呈蓝色,细胞质呈不同程度的红色。
1.6.5 TUNEL染色检测脑组织细胞凋亡 按照TUNEL细胞凋亡检测试剂盒说明书,取上述石蜡切片,加入生物素标记液37 ℃反应1 h,磷酸盐缓冲液(phosphate buffered solution,PBS)洗3次,加入Streptavidin-HRP工作液室温孵育30 min,PBS洗3次,DAB显色,脱水透明,封片观察。400倍镜下,随机选取5个视野,计数TUNEL阳性细胞,阳性凋亡细胞核或细胞质在显微镜下呈褐色。凋亡指数(%)=凋亡阳性细胞数/细胞总数×100%。
1.6.6 Western blotting法检测HIF-1α/mTOR通路相关因子蛋白表达 分离的缺血侧脑组织加入适量裂解液,匀浆裂解,后经4 ℃12 000 r/min离心10 min,取上清,测定蛋白浓度后加热变性,保存于-80 ℃备用。各组蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离(压缩胶60 V 25 min,分离胶120V 70min),后转移至PVDF膜上(转膜条件200mA 120min),PVDF膜于5%脱脂牛奶中室温封闭1 h,后于一抗内(HIF-1α、Beclin1均以1∶1 000稀释;mTOR、p62均以1:8 000稀释;p-mTOR以1∶5 000稀释;LC3B以1∶2 000稀释)4 ℃孵育过夜。次日洗膜,后于辣根过氧化物酶标记的抗兔二抗(以1∶8 000稀释)内室温孵育1 h,TBST洗膜3~6次后,ECL显影,化学发光凝胶成像系统曝光并拍照记录。利用Image J软件分析条带灰度值,以目的蛋白HIF-1α、mTOR、p-mTOR、LC3 Ⅱ、LC3 Ⅰ、Beclin1、p62与内参GAPDH灰度值比值表示蛋白的相对表达量。
1.7 统计学方法 使用SPSS 26.0软件分析数据,计量资料以“均数±标准差”()表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠神经功能缺损评分比较 与模型组比较,IRN低剂量组、IRN高剂量组及依达拉奉组大鼠神经功能缺损评分均明显降低(P<0.05);与IRN低剂量组比较,IRN高剂量组及依达拉奉组大鼠神经功能缺损评分均明显降低(P<0.05);与IRN高剂量组比较,依达拉奉组大鼠神经功能缺损评分明显降低(P<0.05)。(见表1)
表1 各组大鼠神经功能缺损评分比较()
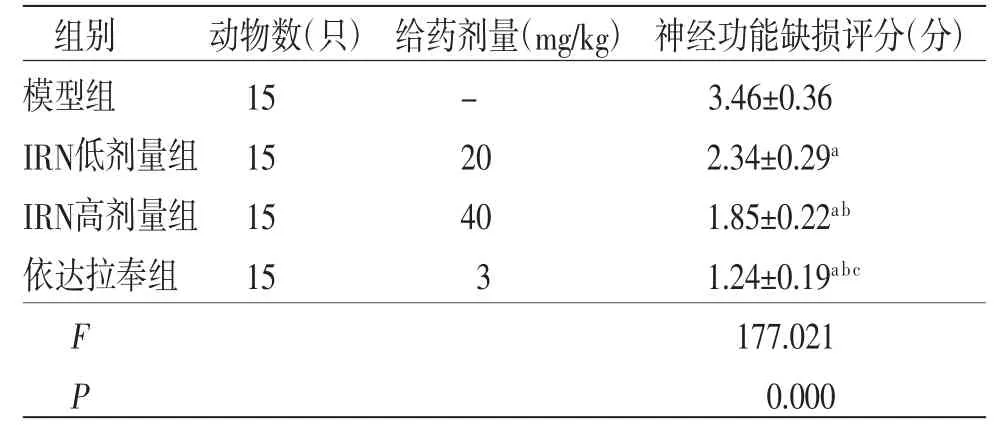
表1 各组大鼠神经功能缺损评分比较()
注:与模型组比较,aP<0.05;与IRN低剂量组比较,bP<0.05;与IRN高剂量组比较,cP<0.05
2.2 各组大鼠脑梗死情况比较 假手术组大鼠脑组织呈红色均染,未见梗死;模型组、IRN低剂量组、IRN高剂量组及依达拉奉组大鼠脑组织可见明显梗死灶。与模型组比较,IRN低剂量组、IRN高剂量组及依达拉奉组大鼠脑梗死面积百分比均明显减小(P<0.05);与IRN低剂量组比较,IRN高剂量组及依达拉奉组大鼠脑梗死面积百分比均明显减小(P<0.05);与IRN高剂量组比较,依达拉奉组大鼠脑梗死面积百分比明显减小(P<0.05)。(见图1、表2)
表2 各组大鼠脑梗死情况比较()

表2 各组大鼠脑梗死情况比较()
注:与模型组比较,aP<0.05;与IRN低剂量组比较,bP<0.05;与IRN高剂量组比较,cP<0.05
2.3 各组大鼠脑组织水含量比较 与假手术组比较,模型组大鼠脑组织水含量明显增多(P<0.05);与模型组比较,IRN低、高剂量组及依达拉奉组大鼠脑组织水含量均明显减少(P<0.05);与IRN低剂量组比较,IRN高剂量组及依达拉奉组大鼠脑组织水含量均明显减少(P<0.05);与IRN高剂量组比较,依达拉奉组大鼠脑组织水含量明显减少(P<0.05)。(见表3)
表3 各组大鼠脑组织水含量比较()
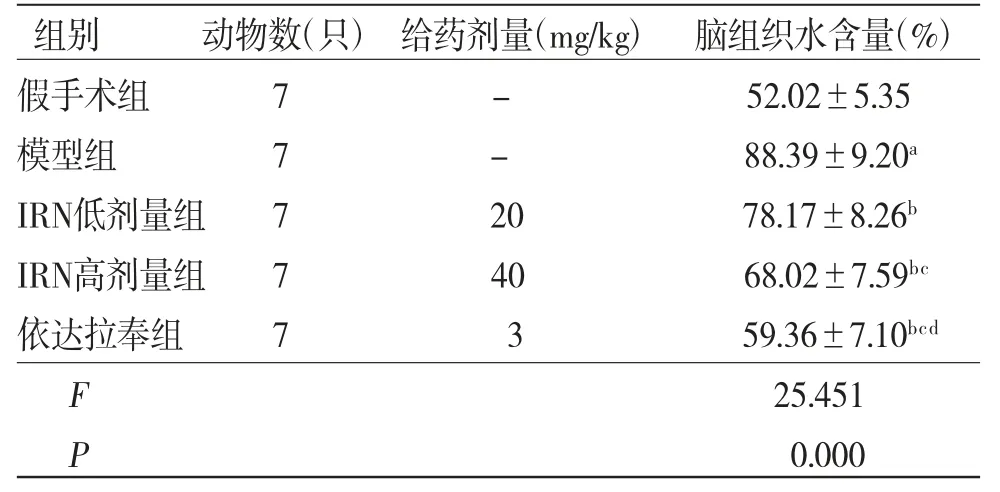
表3 各组大鼠脑组织水含量比较()
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与IRN低剂量组比较,cP<0.05;与IRN高剂量组比较,dP<0.05
2.4 各组大鼠脑组织病理形态学观察 假手术组大鼠缺血侧脑皮质神经元排列紧密,结构完整,形状规则,核仁清晰,未见水肿及炎症细胞浸润;模型组大鼠神经元出现明显核仁固缩,排列散乱且有空泡,形状不规则;与模型组比较,IRN低剂量组、IRN高剂量组及依达拉奉组大鼠脑组织神经元固缩逐渐减轻,形态逐渐规则,排列逐渐紧密。(见图2)
2.5 各组大鼠脑组织细胞凋亡情况 假手术组大鼠脑组织神经元呈淡蓝色,排列有序,结构完整;模型组大鼠可见大量棕色凋亡细胞,细胞固缩,排列无序;与模型组比较,IRN低剂量组、IRN高剂量组及依达拉奉组大鼠脑组织阳性凋亡细胞逐渐减少,形态逐渐改善。与模型组比较,IRN低剂量组、IRN高剂量组及依达拉奉组凋亡指数均明显降低(P<0.05);与IRN低剂量组比较,IRN高剂量组、依达拉奉组凋亡指数均明显降低(P<0.05);与IRN高剂量组比较,依达拉奉组凋亡指数均明显降低(P<0.05)。(见图3、表4)
表4 各组大鼠缺血侧脑皮质细胞凋亡指数比较()

表4 各组大鼠缺血侧脑皮质细胞凋亡指数比较()
注:与模型组比较,aP<0.05;与IRN低剂量组比较,bP<0.05;与IRN高剂量组比较,cP<0.05
2.6 各组大鼠脑组织HIF1α/mTOR通路相关因子蛋白表达情况 与假手术组比较,模型组大鼠脑组织HIF-1α、LC3Ⅱ/LC3Ⅰ、Beclin1蛋白相对表达量均明显升高(P<0.05),p-mTOR、p62蛋白相对表达量均明显降低(P<0.05);与模型组比较,IRN低剂量组、IRN高剂量组及依达拉奉组大鼠脑组织中HIF-1α、LC3Ⅱ/LC3Ⅰ、Beclin1蛋白相对表达量均明显降低(P<0.05),p-mTOR、p62蛋白相对表达量均明显升高(P<0.05);与IRN低剂量组比较,IRN高剂量组及依达拉奉组大鼠脑组织HIF-1α、LC3Ⅱ/LC3Ⅰ、Beclin1蛋白相对表达量均明显降低(P<0.05),p-mTOR、p62蛋白相对表达量均明显升高(P<0.05);与IRN高剂量组比较,依达拉奉组大鼠脑组织HIF-1α、LC3Ⅱ/LC3Ⅰ、Beclin1蛋白相对表达量均明显降低(P<0.05),p-mTOR、p62蛋白相对表达量均明显升高(P<0.05)。5组大鼠脑组织mTOR蛋白相对表达量比较,差异无统计学意义(P>0.05)。(见表5、图4)
表5 各组大鼠脑组织HIF-1α、mTOR、p-mTOR、LC3、Beclin1、p62 蛋白相对表达量比较()

表5 各组大鼠脑组织HIF-1α、mTOR、p-mTOR、LC3、Beclin1、p62 蛋白相对表达量比较()
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与IRN低剂量组比较,cP<0.05;与IRN高剂量组比较,dP<0.05
3 讨 论
IS发病机制复杂,大脑某一区域血液循环发生障碍时,可导致脑组织缺氧及葡萄糖供应不足,引起谷氨酸相关的兴奋性毒性、炎症、氧化应激和细胞凋亡等一系列病理反应,进而启动细胞死亡途径,影响神经行为功能[11]。
脑缺血的主要临床表现为局灶性脑缺血,如短暂或永久性MCAO,因与IS非常相似而常用于探讨IS实验模型动物研究[12]。本研究结果显示,经短暂闭塞大脑中动脉后再灌注,模型组大鼠神经功能缺损评分明显升高,脑梗死面积百分比明显增大,脑组织水含量明显增多,神经元出现明显核仁固缩,排列散乱且有空泡,凋亡细胞指数明显升高,提示MCAO可致严重I/R损伤,成功构建IS模型大鼠。神经元形态异常及高死亡率为I/R损伤标志,脑组织水含量可评估脑水肿程度。脑水肿可导致颅内压升高,是IS治疗关键[13]。依达拉奉是一种抗氧化剂和氧自由基清除剂,具有抗炎、增加血流量、减少神经损伤及改善神经功能等作用,常用作治疗脑卒中[14]。有研究表明,IRN可减轻I/R损伤大鼠脑梗死程度,降低脑缺血侧神经元死亡率及脑含水量[15]。本研究结果显示,经低、高剂量IRN及依达拉奉治疗后,IS模型大鼠脑组织病理损伤情况明显改善,神经功能缺损评分及脑梗死程度均明显降低,脑组织水含量明显减少,凋亡细胞指数明显降低,提示IRN具有改善IS模型大鼠脑损伤的作用。
自噬在IS神经元死亡调控中起双重作用[16]。适度自噬可通过消除受损的组织及蛋白质来拯救受损细胞,而过度自噬可促进细胞内容物降解,导致细胞死亡,最终损伤组织器官。LC3为自噬体的特异性标志物;p62可以作为自噬通量的衡量标准,被认为与自噬降解呈负相关。自噬形成时,胞浆型LC3(LC3-Ⅰ)会酶解掉一小段多肽,转变为自噬体膜型(LC3-Ⅱ)。当LC3Ⅱ/LC3Ⅰ的表达水平降低时,p62在细胞中积聚,自噬受阻,可导致自噬活性降低[17]。Beclin1是自噬的关键参与者,被认为参与调节自噬体合成与成熟[18]。研究发现,脑卒中恢复期神经元自噬水平较高[19]。本研究结果显示,模型组大鼠脑组织中LC3Ⅱ/LC3Ⅰ、Beclin1蛋白相对表达量明显升高,p62蛋白相对表达量明显降低,提示自噬发生和自噬活性较强;而经低、高剂量IRN及依达拉奉治疗后,LC3Ⅱ/LC3Ⅰ、Beclin1及p62表达情况发生逆转,提示IRN可抑制IS大鼠神经元自噬体形成,降低自噬活性。
IS缺血状态可诱导HIF-1转录,HIF-1是由HIF-1α和HIF-1β亚基组成的异源二聚体,其活性由HIF-1α决定。常氧条件下,HIF-1α被蛋白酶体降解;缺氧条件下,蛋白酶体可抑制HIF-1α降解,稳定HIF-1α与分子伴侣的结合进而增加HIF-1活性。研究发现,HIF-1α信号通路可以促进缺氧诱导的自噬[20],自噬受mTOR信号通路负性调控,能量缺乏可导致mTOR活性失活从而导致自噬增加[21]。mTOR可通过调节HIF-1α影响凋亡与自噬,缺氧状态下HIF-1α可反向调节mTOR,HIF-1α过表达通常伴随mTOR途径的抑制[22]。本研究结果显示,模型组大鼠HIF-1α蛋白相对表达量明显升高,mTOR磷酸化水平明显降低,提示IS大鼠在脑卒中氧糖剥夺情况下,可出现HIF-1α响应及mTOR失活而促进自噬发生。经IRN低剂量组、IRN高剂量及依达拉奉治疗后,HIF-1α及mTOR磷酸化水平被逆转,提示HIF-1α降解和mTOR激活可促进IS模型大鼠脑组织损伤的恢复。
综上所述,IRN可通过减轻IS模型大鼠神经功能缺损及脑水肿,减少脑梗死并降低神经元凋亡水平,改善脑组织病理损伤,其作用机制可能与抑制HIF1α表达、激活mTOR信号进而抑制IS模型大鼠神经元过度自噬有关。

