超微血管成像技术在前列腺良恶性结节鉴别诊断中的应用
何 竹,陈 珑,江 泉,张 渊,单 君,施秀荣,傅 宇
1.苏州大学附属第一医院介入放射科,江苏 苏州 215006;
2.上海市浦东新区人民医院超声科,上海 201200
前列腺癌是老年男性常见的恶性肿瘤之一,全球范围内,其发病率在男性恶性肿瘤中居第2位,死亡率居第5位[1]。中国前列腺癌发病率低于欧美国家,但近年来呈较快上升趋势,2015年中国前列腺癌的发病率和死亡率在男性恶性肿瘤中排名第6位和第10位[2]。由于前列腺癌起病隐匿,临床发现时多为晚期[3],故早期诊断是提高前列腺癌患者生存率的关键。常规经直肠超声检查(transrectal ultrasonography,TRUS)是目前首选的前列腺癌检查方法,但早期检出率较低。经直肠超声造影(contrast-enhance ultrasound,CEUS)检查可较好地反映前列腺病灶组织的微血管分布,在早期诊断中有较高的应用价值[4],但若有多个结节且不在同一层面则需反复多次注射造影剂进行分次观察,且少数患者可能有造影剂过敏的问题。近几年出现的超微血管成像(superb microvascular imaging,SMI)技术能动态显示流量低、速度慢的微血流信号,已应用于肝脏肿块、甲状腺、乳腺结节、颈动脉斑块等检查[5-8],但在前列腺结节中的研究较少。本研究分别应用SMI及CEUS技术检测可疑前列腺结节,比较SMI技术与经典的CEUS技术检测前列腺结节内微小血管的一致性,并以病理学检查结果为金标准探讨SMI技术对前列腺可疑结节的诊断效能。
1 资料和方法
1.1 一般资料
回顾并分析2019年6月—2021年6月苏州大学附属第一医院临床诊断为可疑前列腺癌,经TRUS发现有可疑结节,并接受了经直肠SMI及CEUS检查,且最后完成了前列腺穿刺活检的52例患者共65个可疑结节的临床资料。52例患者年龄为55~88岁,平均年龄(71.4±8.2)岁,血清前列腺特异性抗原(prostate-specific antigen,PSA)为(20.45±23.15)ng/mL(2.59~91.96 ng/mL)。排除标准:① 数据不全的患者;② 无病理学检查结果的患者。
1.2 仪器和方法
采用日本Toshiba公司的Aplio 500彩色多普勒超声诊断仪,配有SMI及实时CEUS成像软件,端扫式直肠探头,频率为4~8 MHz。患者取左侧卧位,双手抱膝呈胸膝位,轻柔置入探头后常规全面扫查前列腺,观察前列腺形态、大小,包膜及内部回声,病灶大小、位置及血流情况。对探查到的可疑结节分别行SMI及CEUS检查。
由3名高年资主治医师分别对可疑结节的SMI及CEUS检查的血流分级进行判定,意见不一致时,经协商后按少数服从多数原则达成一致。
1.2.1 SMI检查及分级判定
以TRUS发现病灶的横切面为观察平面,启用SMI技术,血流速度设置为0.8~2.0 cm/s,采集图像。对可疑结节的血流分级按Adler血流分级法进行判定:0级,结节内无血流信号;1级,结节内出现1~2个点状血流信号;2级,结节内出现3个以上点状和/或1~2条短线状血流信号;3级,结节内出现2个以上线状血流信号,且贯穿或大部分贯穿病灶,或可见病灶内弥漫分布的线状或网格状血流信号。0~2级为良性,3级为恶性。如存在多个病灶,同样方法启用SMI检测,对每个病灶分别进行分级判定。
1.2.2 CEUS检查及分级判定
以TRUS发现病灶的横切面为观察平面,建立静脉通道,造影剂为意大利Bracco公司的声诺维(SonoVue),使用前注入5 mL生理盐水,充分振荡混匀后抽取混悬液2.4 mL,经肘静脉快速推注,跟注5 mL生理盐水,同时开始计时和动态储存图像,连续实时观察2 min以上,记录造影剂灌注的整个过程,观察病灶的造影增强模式并定性判定:0级,无增强;1级,低增强;2级,等增强;3级,高增强,与SMI的分级判定结果相对应。0~2级为良性,3级为恶性。如存在多个病灶且不在同一断面,则需重复注射造影剂对每个病灶分别进行判定。
1.2.3 TRUS引导经会阴前列腺穿刺活检术
在当日检查后行TRUS引导经会阴前列腺穿刺活检术。使用美国Bard公司的18 G全自动活检枪,带20 mm针槽。患者取膀胱截石位,充分暴露会阴部,于肛门12点位上方10 mm左右两侧注射5 mL浓度10%利多卡因局麻,采用“10+X”(即分别于前列腺两侧外周带前外侧、外侧、中部、尿道后方旁及两侧移行区各1针,靶结节1、2针)进行穿刺,如靶针与系统针重合则不再重复穿刺,所有穿刺组织条分别放入写好标签的装有10%甲醛的标本瓶中,送病理科检查,病理学检查报告对每个标本瓶组织条分别进行描述。
前列腺穿刺病理学检查的临床显著癌诊断采用Epstein标准,即穿刺Gleason评分>6分或Gleason评分为6分但肿瘤组织所占穿刺标本百分比>50%或穿刺标本中发现前列腺癌的标本>2根。
1.3 统计学处理
采用SPSS 24软件,一般计量资料以±s表示,组间比较采用t检验;计数资料用百分比表示,组间比较采用χ2检验;SMI和CEUS对结节内微小血流分级评定的一致性检验采用Kappa检验,P<0.05为差异有统计学意义。
2 结 果
52例前列腺患者共穿刺571针,阳性103针。65个结节中,病理学诊断恶性27个,均为腺癌,Gleason评分6~9分。27个恶性结节中临床显著前列腺癌26个,非显著前列腺癌1个;良性38个,单纯前列腺增生31个,前列腺增生合并炎症7个。SMI与CEUS对前列腺结节内微小血流的显像分级评定的一致性比较,Kappa值为0.76,P=0.00<0.01(SMI分级评定:0级4个,1级20个,2级11个,3级30个;CEUS分级评定:0级1个,1级12个,2级22个,3级30个)(图1、2),SMI对前列腺良恶性结节的诊断灵敏度为74.1%(20/27),特异度为73.7%(28/38),准确度为73.8%(48/65)。
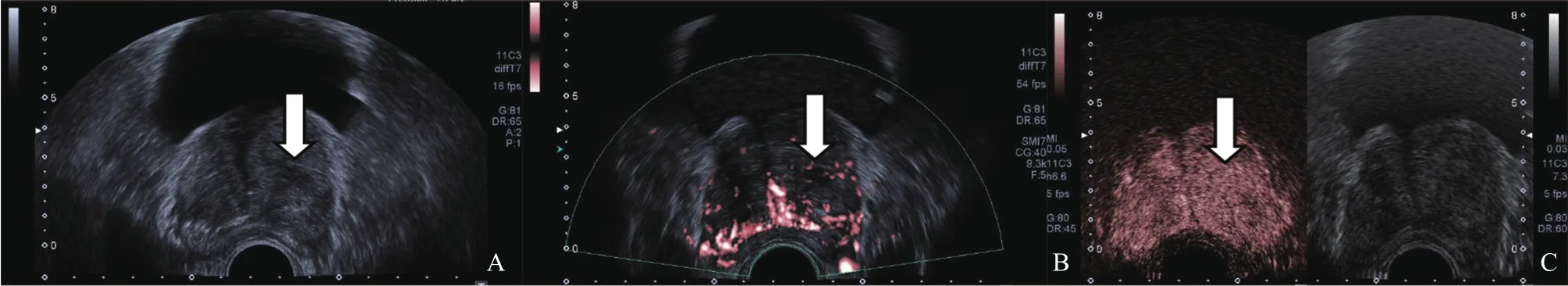
图1 病理学检查证实为前列腺增生的患者超声声像图
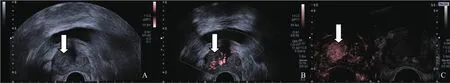
图2 病理学检查证实前列腺腺癌患者超声声像图
CEUS对前列腺结节的诊断灵敏度为85.2%(23/27),特异度为81.6%(31/38),准确度为83.1%(54/65),两种检测方法的诊断灵敏度、特异度和准确度比较差异均无统计学意义(表1)。27个恶性结节中,SMI及CEUS均诊断正确的结节19个,均为假阴性诊断的3个,余下5个结节中CEUS诊断正确4个,SMI诊断正确1个(图3);38个良性结节中,SMI及CEUS均诊断正确26个,均为假阳性诊断的5个,余下7个结节中CEUS诊断正确5个(图4),SMI诊断正确2个。
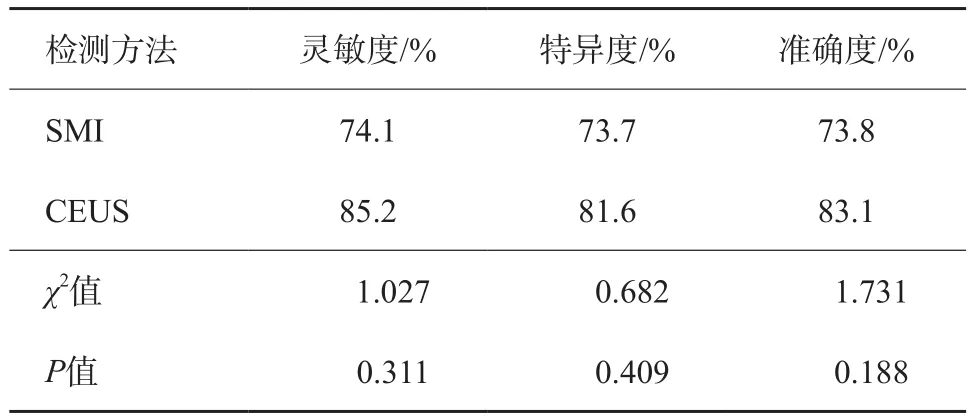
表1 SMI和CEUS对前列腺结节的诊断价值比较
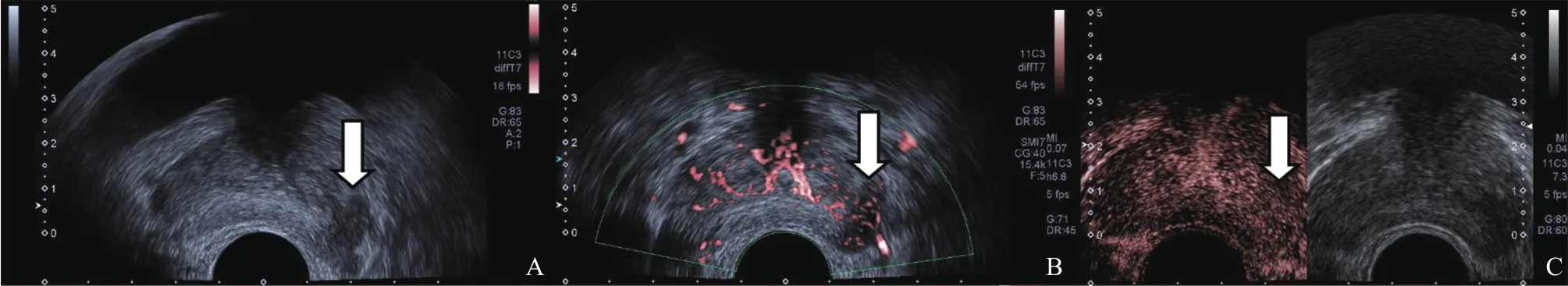
图3 CEUS诊断前列腺腺癌假阴性的患者超声声像图

图4 SMI诊断前列腺癌假阳性患者声像图
3 讨 论
前列腺癌与良性组织内的血流构成不同,与正常前列腺组织和良性结节相比,癌组织中存在大量的新生血管,其内微血管密度明显增高。CEUS可显示病灶内微血管灌注情况,而恶性组织与良性组织的灌注模式不同,由此可对良恶性结节进行鉴别诊断[9]。相较于传统的彩色多普勒血流成像(color Doppler flow imaging,CDFI),SMI是一种新型血管成像技术,目前有cSMI与灰阶模式SMI(monochrome SMI,mSMI)两种显示模式,其采用智能滤波技术,仅滤除杂波,可有效分离血流信号和重叠的组织运动伪像,识别并保留微小血管,能检测出管径大于0.1 mm而CDFI不能显示的微细血管,且几乎不受角度影响,在低速度和高增益情况下,仍能保持血流外溢少的特点[10-11],实时检测流量低、速度低的微血流信号,与CEUS检测效果相似。本研究结果显示SMI对前列腺结节内微血管检测和级别评定与CEUS具有良好的一致性,与詹嘉等[12]研究结果相近,且两种方法对前列腺结节的诊断灵敏度、特异度和准确度比较差异均无统计学意义。
本研究中SMI及CEUS对前列腺结节的诊断均存在假阳性和假阴性。SMI与CEUS均为假阴性诊断的有2例患者共3个结节,其中1例患者的2个结节可能是病变处于较早期乏血供的阶段,与结节内新生微血管数量少有关,另1例患者因前列腺体积显著增大且病灶位于移行区近腹侧,可能是SMI及CEUS对远距离病灶内血流显示较差导致;SMI诊断假阴性的2例患者共4个结节,可能为其内未形成弥漫分布的微血管及贯穿病灶的血管,使SMI检测出的血流分级评分低导致;CEUS诊断假阴性的1个结节,Gleason评分7分,可能为病灶早期未形成明显瘤体、呈浸润性生长,与周边组织的微血管密度相近所致[13](图3)。SMI与CEUS均为假阳性诊断的5个结节,均为前列腺增生伴慢性炎症,可能与前列腺炎血管丰富有关[14];CEUS诊断假阳性的有2个结节,可能与造影剂局部高灌注使血流分级评分高而SMI技术能真实地对结节内的微血管显像所致;SMI诊断假阳性的4例患者共5个结节,可能与病灶较大(直径均为2 cm左右)且其内形成了弥漫性分布或贯穿病灶的血管,使SMI对其显像的血流分级评分高有关(图4)。在今后的研究中,还需纳入更多的样本量继续在病灶内血流分布、走行特点等方面深入研究前列腺可疑结节的SMI影像学特征,从而进一步提升SMI对前列腺可疑结节的诊断效能。
综上所述,SMI在检出前列腺结节内的微小血流方面与CEUS具有良好的一致性,能够显示出病灶的微血管分布,进而通过对肿瘤内新生血管的评估,以协助定性诊断病变组织的良恶性。其在前列腺可疑结节的定性诊断中,与CEUS的诊断效能无差异。同时,由于其操作便捷、无创安全,且不受CEUS固定观察切面的限制,不会增加病患造影剂检查费用负担及过敏风险,今后还有望被用于引导前列腺可疑结节的定向穿刺活检中,以进一步提高前列腺癌的检出率。

