C-TIRADS联合人工智能辅诊系统对甲状腺结节良恶性的诊断价值
郑梅娟,薛恩生,俞 悦,陈 舜,陈 聪,方贞燕
福建医科大学附属协和医院超声科,福建省超声医学研究所,福建 福州 350000
甲状腺癌是近年来全球发病率增长最快的恶性肿瘤[1],中国甲状腺癌发病率每年以20.1%的速度增长[2]。甲状腺癌的诊疗问题也越来越受人们关注。应用超声对甲状腺结节进行恶性风险分级评估,在甲状腺疾病的规范化诊疗方面有着不可替代的作用。甲状腺结节超声恶性危险分层中国甲状腺影像报告和数据系统(Chinese-Thyroid Imaging Reporting and Data System,C-TIRADS)[3]得到国内甲状腺专家的广泛认可,它也强调了超声图像质量和医师经验对于甲状腺结节危险分层的重要性。深度学习技术越来越多地应用于医学影像学领域,利用计算机自动客观地提取、分析影像学特征,可以减少医师扫查手法、诊断经验等主观因素对诊断结果的影响,辅助医师提高诊断的效率及准确度[4]。本研究旨在研究C-TIRADS联合基于深度学习技术的甲状腺结节人工智能(artificial intelligence,AI)辅诊系统对甲状腺结节良恶性的诊断价值,并探讨桥本甲状腺炎(Hashimoto thyroiditis,HT)背景对AI辅诊系统、不同年资医师诊断结果的影响。
1 资料和方法
1.1 研究对象
收集2021年1—7月于福建医科大学附属协和医院行甲状腺外科手术的患者共870例。纳入标准:① 术后病理学诊断明确;② 术前1个月内的超声检查资料完善。排除标准:① 目标结节超出切面的观察范围;② 检查时已接受化学药物治疗;③ 检查前2周内接受穿刺活检。最终入选患者486例,其中男性108例,年龄18~73岁,平均(43.64±12.63)岁;女性378例,年龄20~77岁,平均(43.24±11.35)岁。
对于一侧腺叶内并发多种性质结节的患者,则每种病理学类型选择最大结节作为研究对象,共有817个结节纳入本研究,左侧叶结节331枚,右侧叶结节448枚,峡部结节38枚。
1.2 仪器与方法
1.2.1 超声检查仪器和方法
采用韩国SAMSUNG公司的RS80A、法国SuperSonic公司的Aixplorer、荷兰Philips公司的EPI Q7、美国GE公司的Logiq E9等彩色多普勒超声诊断仪,线阵探头频率为10~15 MHz。调节超声成像频率、成像深度、总增益、深度增益补偿曲线、焦点数目、焦点位置等,使甲状腺灰阶图像达到最佳成像效果。
术前超声检查由数名甲状腺超声检查经验较丰富(工作经验在5年以上)的超声科医师完成。记录患者年龄、性别、甲状腺疾病相关病史等一般资料,同时留存各结节的最大横切面、最大纵切面及能体现相关特征的图像资料。
纳入研究的结节图像资料由2名超声科医师(1名为通过超声专业住院医师规范化培训结业考试入职1年的初级职称医师,1名为具有15年以上甲状腺超声诊断经验的高级职称医师)依据C-TIRADS对结节进行声像特征评估、分类。采用单盲法控制其主观因素的影响,即2名医师在分析图像时均不知情患者的其他临床资料。
C-TIRADS是基于计数法的分类:阳性指标(+1分)包括实性、微钙化、极低回声、垂直位以及边缘模糊/边缘不规则或甲状腺外侵犯5个甲状腺结节声像特征;点状强回声(彗星尾伪像)为阴性指标(-1分)。分类标准:2类(-1分)、3类(0分)、4a类(1分)、4b类(2分)、4c类(3~4分)和5类(5分)。
1.2.2 AI辅诊系统检测结节
采用浙江德尚韵兴医疗科技有限公司的智能辅助诊断系统AI-SONIC Throid(以下简称AI辅诊系统)进行检测。操作时将无任何标记的甲状腺结节灰阶图导入AI辅诊系统,记录风险概率值。风险概率值范围为0.00~1.00,其中0.00~0.40为偏良性;0.41~0.60为可疑恶性;0.61~1.00为偏恶性。
1.3 统计学处理
采用SPSS 22.0软件进行统计学分析,所有假设检验均为双侧检验,P<0.05为差异有统计学意义。计量资料以±s表示。计数资料以频数(例数或结节数)表示。正态分布数据采用独立样本t检验,非正态分布数据采用Mann-WhitneyU检验。以组织病理学结果为金标准,采用灵敏度、特异度、准确度、Kappa系数等指标评价各个方案的诊断效能,率的比较采用Pearsonχ2检验(n>40且所有T≥5)或Fisher精确概率检验法检验(T<1)。
2 结 果
2.1 病理学检查结果
486例患者817个结节中,良性355个,其中结节性甲状腺肿265个,腺瘤样结节45个,滤泡性腺瘤22个,桥本结节19个,亚急性甲状腺炎3个,纤维性结节1个;恶性462个,其中乳头状癌450个,滤泡癌10个,髓样癌1个,低分化癌1个。
2.2 C-TIRADS不同年资医师、AI辅诊系统各分类的恶性率
良性组病灶超声测量最大径(1.10±1.15)cm,恶性组病灶最大径(0.98±0.82)cm,差异有统计学意义(两组数据不服从正态分布,采用两独立样本的Mann-WhitneyU检验,结果Z=-2.24,P=0.025)。
2名医师依据C-TIRAD对817个结节进行分类,高年资医师诊断结果中,2、3、4a、4b,4c及5类结节各23、278、76、98、324及18个,恶性率分别为0.00%、4.32%、42.11%、84.69%、97.84%和100.00%;低年资医师诊断结果中,2、3、4a、4b、4c及5类结节各22、190、133、117、349及6个,恶性率分别为0.00%、5.26%、12.03%、76.07%、97.71%和100.00%。AI辅诊系统诊断结果中,偏良性结节344个,可疑恶性12个,偏恶性461个,恶性率分别为7.56%、83.33%、92.41%。
2.3 C-TIRADS不同年资医师、AI辅诊系统以及两者联合应用的诊断效能对比
以AI评估风险概率值0.41、C-TIRADS 4a类作为良恶性的诊断界值,以病理学检查结果为金标准,分别计算AI辅诊系统及不同年资医师应用C-TIRADS对817个结节分类诊断的灵敏度、特异度、准确度、Kappa系数(表1)。与高年资医师单独应用C-TIRADS的诊断结果相比,AI辅诊系统诊断的灵敏度略低,特异度较高(P=0.003),准确度两者相当,其差异无统计学意义(P=0.151);与低年资医师单独应用C-TIRADS的诊断结果相比,AI辅诊系统诊断的灵敏度略低(P=0.020),特异度和特异度较高(P=0.002,P<0.001)。
联合应用的总体原则是根据AI判定结果调整C-TIRADS 3和4类结节,若结节的AI诊断恶性风险概率值≥0.41,则升一级,若恶性风险概率值<0.41,则降一级(图1)。联合AI辅诊系统调整分类后诊断的灵敏度、特异度、准确度、Kappa系数详见表1。低年资医师联合AI辅诊系统诊断后的特异度(P<0.001)及准确度(P<0.001)均明显提高,灵敏度差异无统计学意义(P=0.526);高年资医师联合AI辅诊系统诊断后的特异度提高(P=0.006),而准确度、灵敏度差异无统计学意义(P=0.057)。
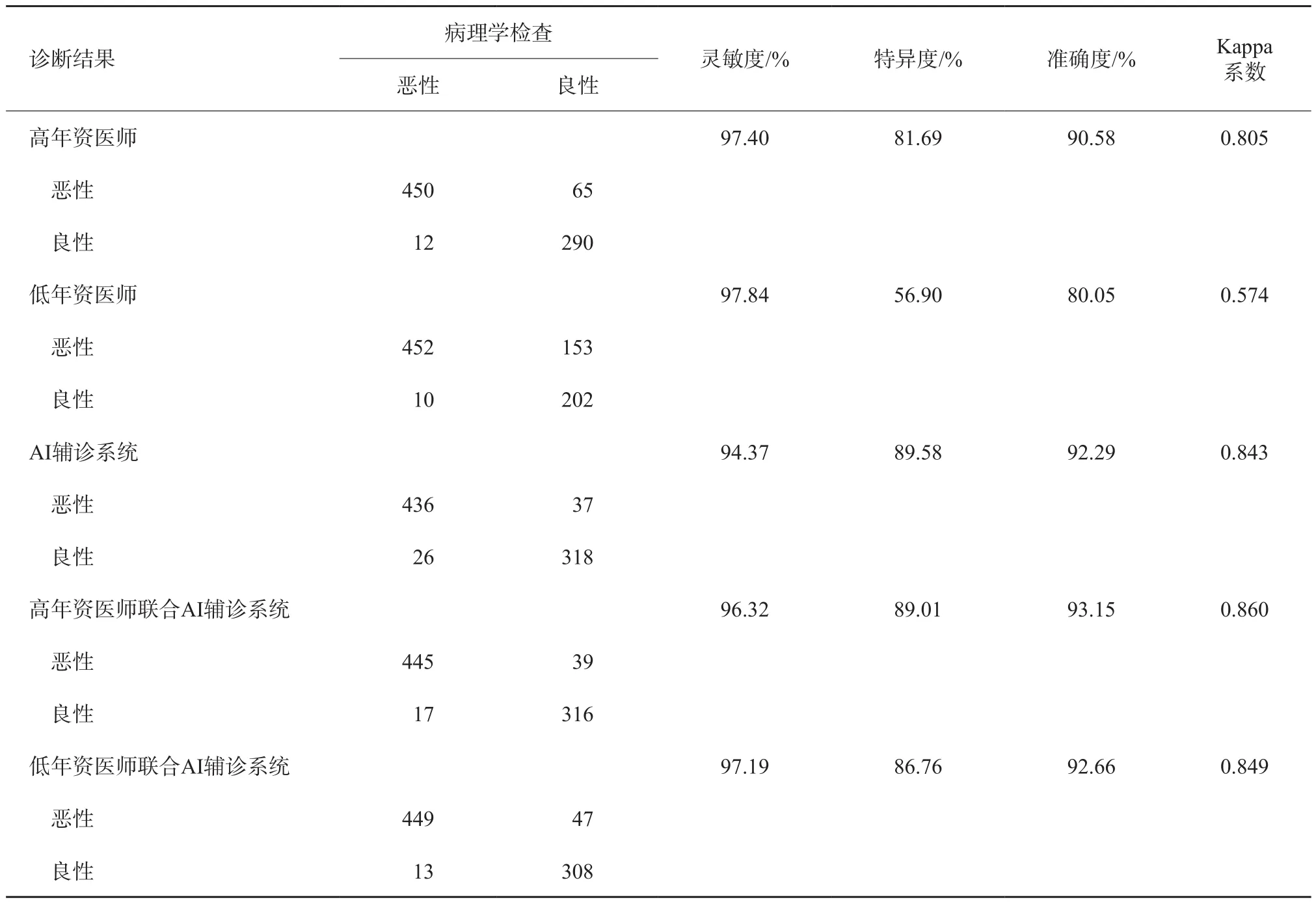
表1 C-TIRADS不同年资医师、AI辅诊系统及联合应用的诊断效能
2.4 HT背景对AI辅诊系统、不同年资医师诊断甲状腺结节效能的影响
本研究486例甲状腺结节患者中,经病理学检查证实合并HT,同时术前超声甲状腺表现为弥漫性病变的有83例归为HT组,该组共135个结节,其中恶性结节79个,良性结节56个。另403例患者的682个结节归为非HT组,其中恶性结节383个,良性结节299个。AI辅诊系统、不同年资医师对HT组及非HT组的诊断灵敏度、特异度、准确度详见表2。比较AI辅诊系统对两组结节诊断的灵敏度、特异度及准确度差异均无统计学意义;而不同年资医师非HT组的诊断特异度均高于HT组。
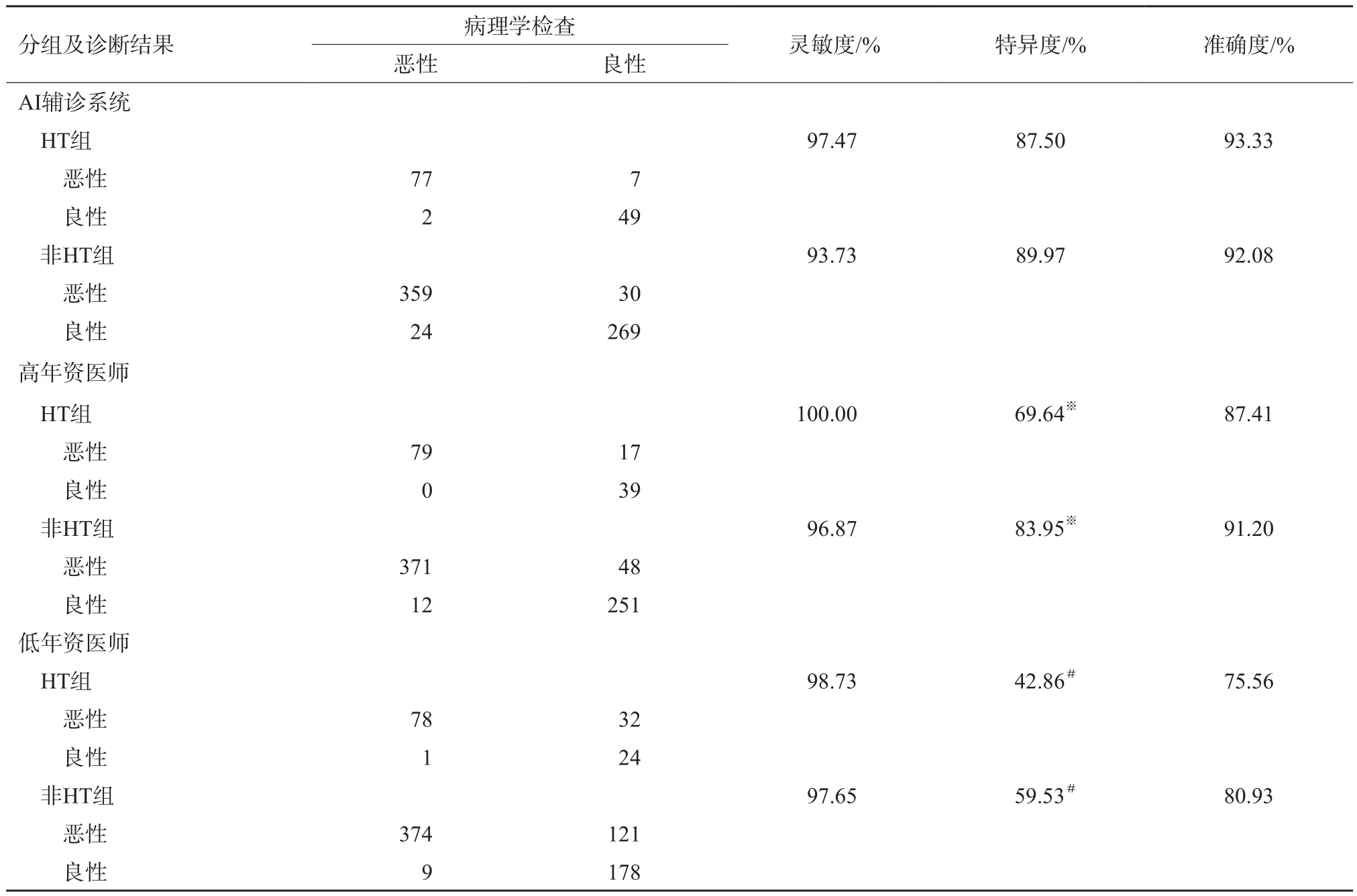
表2 不同年资医师与AI辅诊系统对HT组、非HT组的的诊断结果
3 讨 论
在临床实践中,超声检查在甲状腺结节随访监测、术前评估、治疗后评估等各个环节均起到不可替代的作用。由于甲状腺结节声像表现的复杂性和多样性,不同国家的研究团队或协会提出了多个版本的TI-RADS分类[5-8],旨在规范化和标准化甲状腺结节的描述和诊断。C-TIRADS是国内第一个由行业协会提出的分类方法,也被证实可以很好地对甲状腺结节进行评估和危险分层[9]。本研究纳入的817个结节均可应用C-TIRADS进行分类,分析高年资医师和低年资医师的诊断结果,不同年资医师诊断的灵敏度均较高(均大于97%),低年资医师诊断的特异度(56.90%)及准确度(80.05%)显著低于高年资医师(特异度81.69%、准确度90.58%)。李潜等[10]的研究中,医师应用C-TIRADS的诊断灵敏度、特异度及准确度分别为97.37%、47.62%及75.53%,与本研究中低年资医师的诊断结果吻合,即灵敏度高,特异度、准确度较低。另外,本研究中低年资医师诊断结果与病理学检查结果一致性较差,Kappa系数0.57,高年资医师诊断结果与病理学检查结果一致性较佳,Kappa系数0.81。低年资医师的诊断结果判为4a类的结节133个,其中良性结节117个,对其诊断记录进行分析,结果显示112个结节因呈实性判为4a类,4个结节因边缘模糊判为4a类,1个结节因微钙化判为4a类。虽然C-TIRADS中实性是一个阳性指标,但同时提出可依据医师经验修正分类,低年资医师由于缺乏经验,机械应用C-TIRADS,导致较多呈实性的良性结节被误诊为恶性;而高年资医师依据其丰富的经验分辨出更多的良性结节,因此诊断特异度及准确度高于低年资医师。
在AI研发应用已经上升为国家战略的时代背景下,AI相关技术在医学影像学领域的研究也开展得广泛而深入,在肺部、乳腺等脏器已经进入临床应用阶段[11-12]。本研究显示,AI辅诊系统诊断甲状腺结节良恶性的灵敏度(94.37%)低于高、低年资医师,特异度(89.58%)高于高、低年资医师,准确度(92.29%)优于低年资医师、与高年资医师相当,与病理学检查结果的一致性较佳,Kappa系数0.84。当高、低年资医师分别结合AI诊断结果重新对817个结节进行TI-RADS分类,结果显示,高年资医师的诊断特异度及准确度略提高,低年资医师的诊断特异度及准确度明显提高,接近于高年资医师。换言之,低年资医师在AI辅诊系统的辅助下,诊断效能可提高至接近高年资医师的水平,而对高年资医师辅助价值有限。该系统利用智能算法对目标区域进行降噪、增强、细化图像特征等预处理,对甲状腺结节良恶性的诊断准确度较好,弥补了低年资医师因缺乏经验引起的过度诊断,提高了诊断准确度。但是,AI辅诊系统的不足之处在于仅对图像进行分析,而在实际的应用中,医师诊断除了分析图像,尚需结合患者病史、实验室检查等资料进行综合判断。
HT是一种常见的自身免疫性疾病,其病理学改变包括弥漫性淋巴细胞和浆细胞浸润,间质纤维化和腺体萎缩,并伴腺泡嗜酸性退行性变等,导致甲状腺声像表现呈弥漫不均匀或结节样改变[13]。在HT背景下结节的良恶性鉴别工作是甲状腺超声检查的难点。本研究中,高、低年资医师对HT组结节的诊断特异度均明显低于非HT组,即HT组中有更大比例的良性结节被误诊为恶性。多项研究[14-15]表明,合并HT背景时良性结节呈现边缘不规则或模糊的比例较正常甲状腺背景高,而结节边缘不规则或者模糊是C-TIRADS的恶性指标之一,这使得HT组良性结节声像表现趋向恶性而导致医师诊断假阳性率较高。而本研究中AI辅诊系统对HT组、非HT组的诊断结果对比差异无统计学意义,这得益于该系统所应用的深度学习理论和变分能量泛函结合的图像分析方法,可以较好地处理伴有复杂背景、弱边界的医学图像分割问题,从而保证了AI辅诊系统的稳定性[16]。许敏等[17]对另一种需要医师手动勾勒甲状腺边缘轮廓的计算机辅诊系统的研究中,结果也显示,在HT背景和非HT背景下,该系统诊断结果的差异无统计学意义,具有较好的诊断稳定性。
对AI辅诊系统误判结节进行分析,我们注意到AI辅诊系统误判为偏良性的结节26个,其中9个为滤泡癌,而本研究入组的结节中共有10个滤泡癌结节,误诊率高达90%(图1F),而高、低年资医师对滤泡癌的误诊率均为40%。滤泡癌声像表现上缺乏恶性征象[18]可能是误诊的首要原因,而AI辅诊系统误诊率尤其高可能还与该系统训练时此类病理学类型少见的甲状腺结节数据输入较少有关。
本研究存在一定局限性:① 患者图像的采集由多名医师共同完成,可能存在一定的操作者间差异;② 本研究样本量不够大,尤其是HT组样本量较小,后续将进一步扩大HT组样本量,深入分析AI辅诊系统对伴HT背景的甲状腺结节良恶性的诊断效能。
综上所述,C-TIRADS对甲状腺结节性质的鉴别具有较高的灵敏度,但对于缺乏经验的低年资医师需加强培训以免出现过度诊断的问题;甲状腺结节AI辅诊系统对甲状腺结节的诊断准确度接近高年资医师,优于低年资医师,且诊断结果不受HT背景的影响,但是单独应用AI辅诊系统作诊断,须警惕AI辅诊系统漏诊恶性结节,尤其是滤泡癌;联合AI辅诊系统对高年资医师应用C-TIRADS的总体诊断准确度影响不显著,但是可提高低年资医师的诊断准确度。

