诊断性131I扫描在不明原因高甲状腺球蛋白血症PTC患者处置中的价值
何紫燕,萨 日,邱 娴,汪君瑶,陈立波
上海交通大学医学院附属第六人民医院核医学科,上海 200233
甲状腺癌是内分泌系统最常见的恶性肿瘤,其发病率在过去的30年里呈现出持续快速上升的态势。2018年,全球甲状腺癌新发病例数已达567 000[1]。中国癌症中心发布的2016年中国恶性肿瘤流行病学数据提示,甲状腺癌的发病例数位列全瘤种第7位[2]。在病理学分型上,甲状腺乳头状癌(papillary carcinoma of the thyroid,PTC)的构成比不断上升,已达全部甲状腺恶性肿瘤的95%左右。
历经80余年,131I治疗逐步成为PTC患者全切术后的标准处置方式[3]。根据目的不同,广义的131I治疗可分为3种具体临床情形:为实现疗效归类和动态复发危险度分层而开展的131I残甲消融;为降低疾病复发风险和提升无进展生存、疾病特异性生存而开展的隐匿性病灶131I辅助治疗;为改善无进展生存、疾病特异性生存和总生存而开展的已知残留/复发/转移性病灶的131I融瘤治疗[4]。
甲状腺全切术后的血清促甲状腺激素(thyroid stimulating hormone,TSH)刺激性或抑制性甲状腺球蛋白(thyroglobulin,Tg)水平对于疾病的监测和患者管理具有重要指导价值[5-8]。虽然美国甲状腺协会(American Thyroid Association,ATA)指南提示甲状腺全切术后血清刺激性或抑制性Tg分别大于10 ng/mL和1 ng/mL的患者需要更为积极的疾病监测和额外治疗措施[4],但由于临床研究的缺乏,目前业界对此类患者的临床管理措施尚不完善。近期,Piccado教授课题组[9]和作者团队课题组[10]通过前瞻性研究证实不明原因高Tg血症(全甲切除后抑制性和刺激性Tg分别大于1 ng/mL和10 ng/mL且没有影像学疾病证据)可作为131I辅助治疗的适应证。但上述研究均因未对患者进行诊断性131I扫描(diagnostic131I scan,Dx)造成了在131I治疗之前难以充分明确治疗目的,一定程度上影响了患者临床处置的精准性。为此,我们设计了本前瞻性研究,评价Dx在不明原因高Tg血症患者中的潜在临床价值,为建立更精准的PTC患者管理模式奠定基础。
1 资料和方法
1.1 患者
连续纳入2019年3月—2022年2月收治的全甲切除术后4周以上,不明原因TSH抑制性血清Tg(Tgon)水平>1 ng/mL且无残甲和残留/复发/转移病灶影像学证据的PTC患者。排除标准:抗Tg抗体(Tg antiboty,TgAb)阳性(>100 U/mL);甲状腺激素未撤退时TSH≥2 mU/L。
血清TSH、Tg、TgAb水平检测采用电化学发光免疫分析法(罗氏公司Cobas生化仪)。TSH的检测上限为100 mU/L,高于该上限的计为100 mU/L;Tg检测上限为50 000 ng/mL(稀释法),高于该上限的计为50 000 ng/mL;Tg和TgAb检测下限分别为0.04 ng/mL和10 U/mL,低于该下限分别计为0.04 ng/mL和10 U/mL。
1.2 131I扫描
患者口服74 MBq131I后24 h行Dx。其中,局部平面显像范围为颅底至横膈,采集的时间为10 min。当局部平面显像所示摄碘灶定位/定性诊断不明确或恶性病灶不能排除时立即加行单光子发射计算机体层摄影(single photon emission computed tomography,SPECT)/计算机体层成像(computed tomography,CT)。当日通过Dx明确131I治疗目的并给予治疗剂量131I口服,3 d后行治疗后全身扫描(post-therapeutic whole-body scan,Rx),扫描速度为10 cm/min。当全身平面显像摄碘灶定位/定性诊断不明确或恶性病灶不能排除时立即加行SPECT/CT。
Dx阳性及Rx阳性定义为131I扫描发现具有摄碘能力的残留/复发/转移病灶。Dx阴性及Rx阴性定义为131I扫描结果为残甲(包括甲状舌管)或未发现残甲/摄碘病灶。
1.3 131I治疗
Dx阴性患者行131I辅助治疗/残甲消融,口服131I活度均为5.55 GBq;Dx阳性患者行已知病灶的融瘤治疗,其中提示淋巴结转移的患者服用活度为5.55 GBq的131I溶液,提示远处转移的患者服用活度为7.4 GBq的131I溶液。131I治疗后第1、4、10个月对患者进行随访和疗效评价。后续Rx阳性的患者随访时间间隔为6个月,Rx阴性的患者随访时间间隔为1年。
1.4 疗效评价
碘治疗前1个月及随访终点进行血清Tgon测定,通过比较随访终点Tgon和治疗前基线Tgon评价生化疗效(TSH<2 mU/L且TgAb阴性)。Tgon水平变化率ΔTgon%定义为[(治疗前Tgon水平-治疗后Tgon水平)/治疗前Tgon水平]×100%。生化疗效评价标准如下:ΔTgon%≥25.0%表示生化缓解,-25.0%≤ΔTgon%<25.0%表示生化稳定,ΔTgon%<-25.0%表示生化进展。
1.5 不明原因高Tg血症的归因分析
Dx后首先将不明原因高Tg血症患者归为结构学/功能学疾病(Dx发现残留/复发/转移性摄碘灶)及非结构学/功能学疾病(包括生化疾病及残甲)。后者在后续随访过程进一步归类为残甲(首次131I治疗6个月后Tgon<0.2 ng/mL且无结构学/功能学病灶)、生化疾病(首次131I治疗6个月后Tgon≥0.2 ng/mL且无结构学/功能学病灶)和结构学/功能疾病(无论首次131I治疗6个月后Tgon水平如何,检出结构学/功能学病灶)。
1.6 统计学处理
采用SPSS 24.0软件进行统计学分析,非正态分布的计量资料采用中位数及四分位间距表示,两组有序变量及两组非正态分布计量资料的比较均用Mann-WhitneyU秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 患者特征
本研究共纳入了79例Tgon>1 ng/mL的全甲切除术后PTC患者。排除2例TgAb阳性和10例甲状腺素未撤退时TSH≥2 mU/L患者,最终67例患者符合本研究分析条件。
67例PTC患者的基线特征汇总于表1。诊断时患者中位年龄为34岁,男女性比例为1.0∶1.5,83.6%(56/67)的患者为pT1期,94.0%(63/67)的患者TNM分期为Ⅰ期。中位TSH水平为0.1 mU/L,中位Tgon水平为1.9 ng/mL。甲状腺激素撤退4周后中位TSH水平为100 mU/L,中位Tgoff水平为27.3 ng/mL。9.0%(6/67)患者甲状腺激素撤退4周后Tgoff≤10 ng/mL。所有患者中位随访时间为23个月(总随访时间为6~41个月)。

表1 不明原因高Tg血症患者的基线特征 n(%)
2.2 Dx和Rx一致性
67例患者中Dx阳性和Dx阴性的患者分别占11.9%(8/67)和88.1%(59/67)。8例Dx阳性患者中,6例病灶定位于颈淋巴结,2例病灶定位于纵隔淋巴结(图1)。59例Dx阴性患者中,57例患者为残甲(图2),2例患者未发现残甲/摄碘病灶。
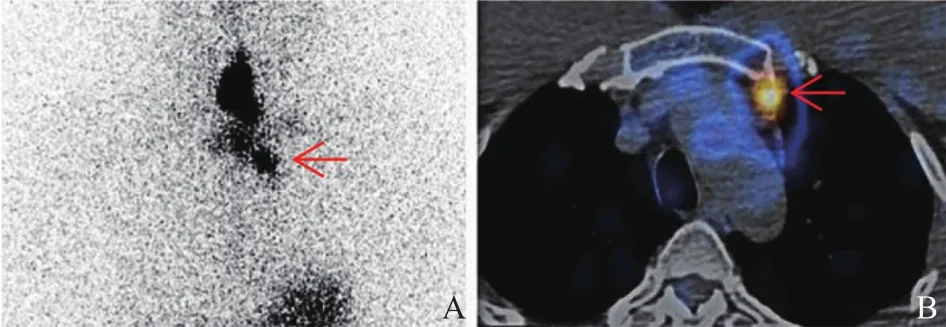
图1 纵隔淋巴结转移性PTC诊断性131I扫描
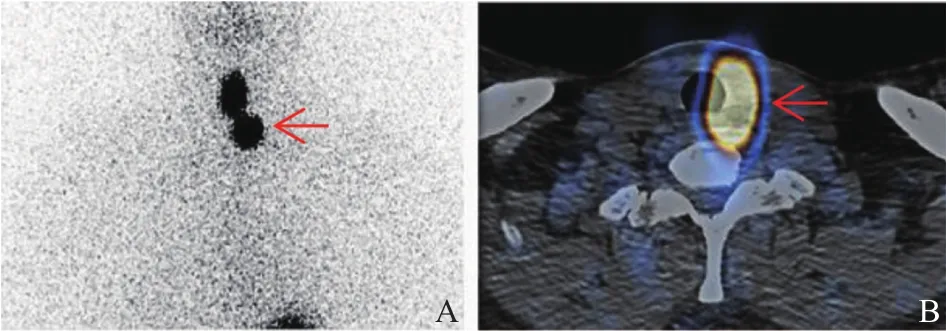
图2 残甲诊断性131I扫描
Rx阳性和Rx阴性的患者分别为10例和57例。Dx阳性且Rx阳性患者为8例,Dx阴性而Rx阳性患者为2例,Dx阴性且Rx阴性患者为57例,无Dx阳性而Rx阴性患者。Dx和Rx结果一致患者总数为65例,二者匹配度为97.0%(65/67)。Dx检出的所有摄碘残甲和病灶在Rx时全部重现,而Rx并未新发现颈胸部以外的摄碘转移灶。
2.3 SPECT/CT断层融合的增益价值
67例患者中50例(74.6%)经平面显像明确诊断为残甲或未发现摄碘病灶。其余17例(25.4%)加做SPECT/CT断层融合检查患者中,8例明确诊断为淋巴结转移瘤,9例患者明确诊断为残留甲状腺。
2.4 不明原因高Tg血症患者归因分析
Dx率先将8例不明原因高Tg血症患者归因为结构学/解剖学疾病。其余59例Dx阴性患者通过随访归因为结构学/解剖学疾病(3例)、生化疾病(47例)和残甲(9例)。所有67例不明原因高Tg血症的患者随访终点归因为结构学疾病11例(16.4%)、生化疾病47例(70.1%)、残甲9例(13.4%)。Dx阴性预测值为94.9%(56/59)。Dx阴性而随后发现结构学/功能学疾病的3例患者中,2例为Rx阳性,1例Rx阴性。后者因131I治疗后Tgon持续上升,颈部超声发现颈部肿块进而行正电子发射体层成像(positron emission tomography,PET)/CT发现颈部及纵隔淋巴结多发转移瘤,诊断为进展性放射性碘难治性PTC而转行靶向治疗。
2.5 131I治疗效果评价
除去上述1例靶向治疗的患者,本研究对剩余66例患者进行了131I治疗效果分析。在随访终点时生化缓解、稳定及进展的患者比例分别占80.3%(53/66)、12.1%(8/66)及7.6%(5/66)。8例Dx阳性患者在随访终点时生化缓解、稳定及进展的患者比例分别为87.5%(7/8)、12.5%(1/8)及0.0%(0/8)。58例Dx阴性患者观察终点时生化缓解、生化稳定及生化进展比例分别占79.3%(46/58)、12.1%(7/58)及8.6%(5/58)。Dx阳性和Dx阴性两组患者的生化疗效差异无统计学意义(P=0.542)。Dx阳性和Dx阴性患者中位ΔTgon分别为1.24 ng/mL(四分位间距为1.0~1.6 ng/mL)和0.92 ng/mL(四分位间距为0.4~1.7 ng/mL),两组差异无统计学意义(P=0.363)。Dx阳性组的8例患者中,3例接受1次131I治疗(1例患者在随访终点暂未到达下次131I治疗时间),5例接受2次131I治疗。
3 讨 论
本前瞻性研究系统报道了67例不明原因高Tg血症PTC患者Dx的结果及131I治疗效果。Dx与Rx的结果匹配度达97.0%,Dx的阴性预测值为94.9%。随访终点时,Dx阳性患者与Dx阴性患者生化缓解率分别为87.5%和79.3%,两组患者生化疗效相当。上述结果表明Dx通过检出或排除结构学/功能学疾病,有助于明确131I治疗目的并为患者的临床获益提供保证。
虽然Park[11]的研究表明,Dx时小剂量的放射性碘导致的辐射损伤会引起残甲/病灶短时间内摄碘能力的降低继而影响后续131I治疗效果,即“顿抑效应”,但不同的研究[12]表明顿抑效应受到诊断性碘扫描时使用的放射性碘的活度及131I诊断-治疗间隔时间的影响。2015年ATA甲状腺癌管理指南推荐诊断性碘扫描使用123I(1.5~3 mCi,55.5~111 MBq)或131I(1~3 mCi,37~111 MBq),131I治疗最佳时间为Dx后的3 d内[4]。本研究中,Dx采用活度为74 MBq的131I,在当日明确诊断的基础上给予治疗剂量131I,3 d后进行Rx,结果证实本Dx方案完全避免“顿抑效应”的发生。
鉴于PTC最易转移的部位为颈部淋巴结及肺部,颈胸部局部扫描的空间分辨率较全身扫描更高、更易发现摄碘病灶且患者通量更大[13],因此,本研究并未采用曾经被报道活度为37 MBq的全身平面显像方案[14-15]。本研究结果表明,3 d后全身Rx并未额外发现不明原因高Tg血症患者颈胸部外的摄碘转移灶。另外,在平面显像诊断不明确或恶性病灶不能排除时立即加行SPECT/CT可帮助25.3%的患者明确诊断进而确定后续处置方案。由此可见,即使采用诊断剂量131I,SPECT/CT断层融合显像对于疾病诊断同样具有良好的增益价值[16]。
Dx阳性的8例患者均为淋巴结转移,这表明Dx对于寻找术后淋巴结病灶具有独特优势[17],尤其是对于超声不易探及的纵隔淋巴结转移灶(图1)。值得注意的是,虽然既往研究[18]中存在CT结果呈现假阴性的肺转移性PTC病灶在Rx时被意外发现,但其发生率极低,可能由于样本量的限制,本研究中Dx和Rx暂未发现肺转移性PTC患者。
至随访终点时,Dx阳性和Dx阴性患者的生化疗效相当,生化缓解的患者占绝大多数,表明给予此类患者5.55 GBq131I之后可取得良好生化反应,这与既往研究[10]一致。这表明我们采用Dx初步确定不明原因高Tg血症患者治疗目的的疾病管理后患者可取得良好的临床获益。
本研究存在一定局限性,首先本研究仅纳入PTC患者,Dx在其他类型分化型甲状腺癌患者中的价值值得进一步探索;此外,本研究结果尚需在更大样本量和多中心研究中予以证实。
综上所述,基于与Rx的良好一致性,服用74 MBq131I后24 h行颈胸部Dx可协助明确不明原因高Tg血症PTC患者的131I治疗目的并保证此类患者获得良好疗效。

