CEUS、SWE对甲状腺微小髓样癌与甲状腺微小乳头状癌的鉴别诊断价值
赵 玲 ,马步云
1.四川大学华西医院超声医学科,四川 成都 610041;
2.中国人民解放军63820部队医院健康管理科,四川 绵阳 621000
美国癌症联合委员会(American Joint Committee on Cancer,AJCC)将甲状腺结节直径<1 cm的甲状腺髓样癌与甲状腺乳头状癌分别定义为甲状腺微小髓样癌(minute-medullary thyroid carcinoma,MMTC)与甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC),两者不易鉴别[1]。目前甲状腺细针穿刺活检是术前诊断的“金标准”,但是由于MMTC与PTMC直径较小,细针穿刺活检不易作出准确判断。此外多个指南[2-3]不推荐对直径<10 mm的甲状腺结节进行常规细针穿刺活检,因此超声检查在制订两者治疗决策中起着至关重要的作用。有多位学者[4-5]报道了MMTC与PTMC常规超声特征,并指出MMTC与PTMC在回声、成分、钙化等超声特征上相似。此外,常规超声诊断具有较强主观性,不同的超声科医师对MMTC与PTMC的判断往往存在差异[6-7]。超声造影(contrastenhanced ultrasound,CEUS)、剪切波弹性成像(shear wave elastography,SWE)能显示不同于常规超声的甲状腺结节特征,而目前关于MMTC与PTMC两者CEUS和SWE特征的报道较少,因此本文旨在比较MMTC、PTMC的CEUS和SWE特征,提高超声科医师认识。
1 资料和方法
1.1 研究对象
本研究采用回顾性的研究方法,选取2016年7月—2021年7月于四川大学华西医院经细针穿刺活检或手术后病理学检查确诊的22例MMTC患者,同时按照MMTC病例年份分布比例,采用分层随机的方式,在对应的年份随机选取经细针穿刺活检或手术后病理学检查确诊的151例PTMC患者,从而保证样本不在年份之间产生偏倚。纳入标准:① 病理学诊断明确;② 临床资料完整;③ 超声资料完整且图像满意,均行CEUS、SWE检查;④ 术前未行抗甲状腺癌治疗;⑤ CEUS及SWE检查甲状腺结节均为实性为主的结节。此次研究通过四川大学华西医院伦理委员会批准(审批号2021-919),所有患者均签署知情同意书。
1.2 仪器
采用荷兰Philips公司的iU22、法国SuperSonic公司的Aixplorer超声检查仪器,使用频率为5~15 MHz小器官线阵探头。SWE检查统一使用Aixplorer超声检查仪器。
1.3 方法
1.3.1 CEUS检查方法
选择甲状腺结节最大径平面后固定探头位置不动,切换至CEUS模式,使用低机械指数(0.05~0.08)连续成像,调整成像参数以保证CEUS图像质量,静脉注射1.2 mL意大利Bracco公司生产的声诺维(SonoVue)后,用5 mL生理盐水冲洗。整个过程直至造影剂消退均应保证超声图像具有较高稳定性。注射造影剂的同时启动超声仪器上的计时器,连续记录2 min以上,并储存记录资料。
1.3.2 SWE检查方法
选择甲状腺结节最大径平面后探头不施加压力,切换至SWE模式,量程为0~180 kPa,取样框略大于结节,嘱患者屏气、静止3 s,冻结稳定的超声图像。然后将2个Q-BOXTM分别置于甲状腺结节实性部分和正常甲状腺实质部分。获得结节杨氏模量最大值(maximum value of Young’s modulus,Emax)、杨氏模量平均值(mean value of Young’s modulus,Emean)、杨氏模量最小值(minimum value of Young’s modulus,Emin)、甲状腺结节与正常组织的杨氏模量比值(ratio value of Young’s modulus,Eratio)。重复3次后记录平均值。
1.4 图像分析
由2名具有10年以上甲状腺超声诊断经验的超声科医师独立进行盲法图像分析,记录甲状腺结节增强程度、增强模式、杨氏模量值。当出现意见不一致时,协商达到一致。当甲状腺存在多个结节时,选取结节最大者进行图像分析。
1.5 分析标准
1.5.1 CEUS增强程度
以正常甲状腺实质增强强度为参照,结节在动脉期(注射后10~30 s)可呈现为无增强、低增强(增强程度低于参照)、等增强(增强程度类似于参照)、高增强(增强强度高于参照)[8]。
1.5.2 CEUS增强模式
结节在造影剂进入结节达峰时可呈现为均匀或不均匀增强[9]。
1.6 统计学处理
采用SPSS 25.0软件进行统计学分析。年龄、SWE参数等计量资料组间比较采用t检验或者Mann-WhitneyU检验。性别、CEUS特征等计数资料,组间比较运用χ2检验或者Fisher精确概率检验。P<0.05(双尾检验)为差异有统计学意义。
2 结 果
2.1 MMTC与PTMC临床资料比较
MMTC患者年龄为17~71岁,中位数为57.50(20.00)岁大于PTMC患者年龄7~73岁,中位数39.00(17.00)岁,差异有统计学意义(Z=3.932,P<0.001)。两组患者性别差异均无统计学意义(χ2=0.654,P=0.419)。
2.2 MMTC与PTMC的CEUS比较
两组增强程度差异有统计学意义(χ2=15.960,P<0.001,图1A,图2A),两组增强模式差异无统计学意义(P>0.05,表1)。
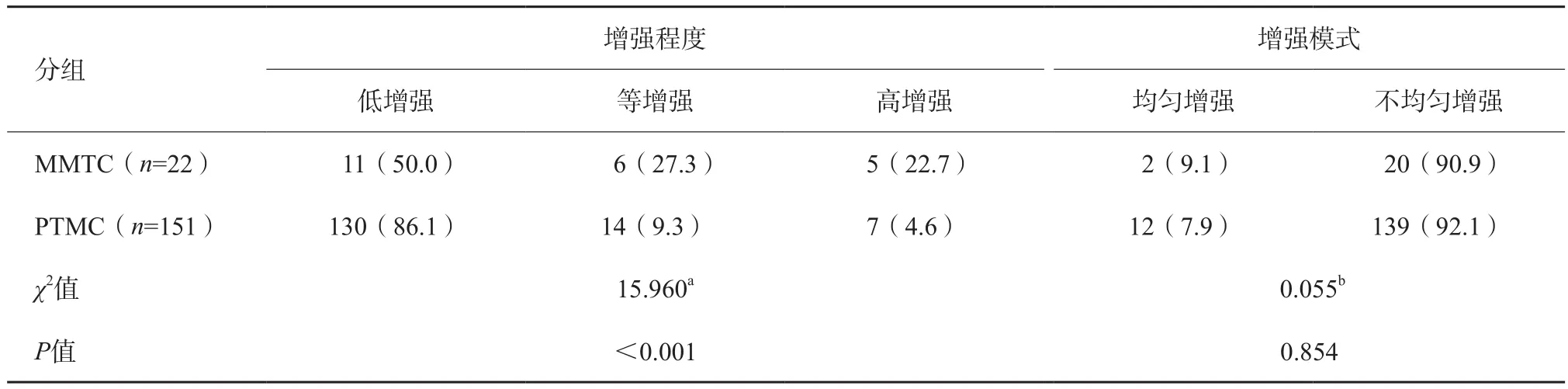
表1 MMTC与PTMC CEUS比较 n(%)
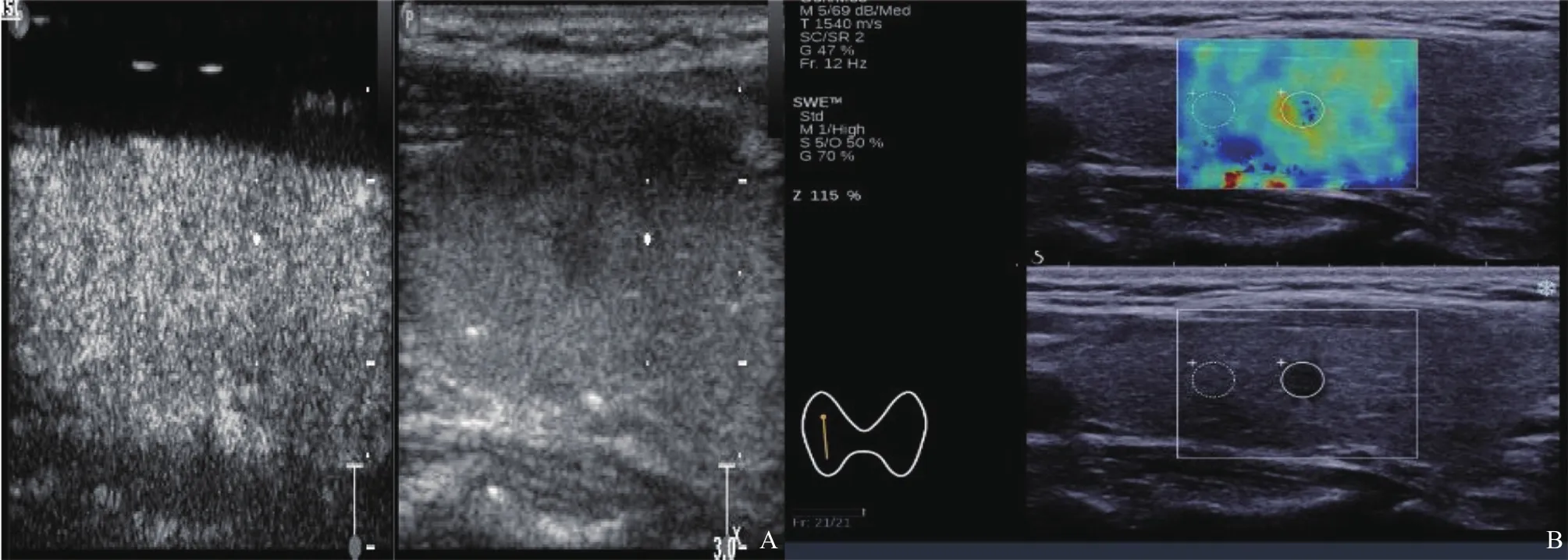
图1 甲状腺微小髓样癌声像图
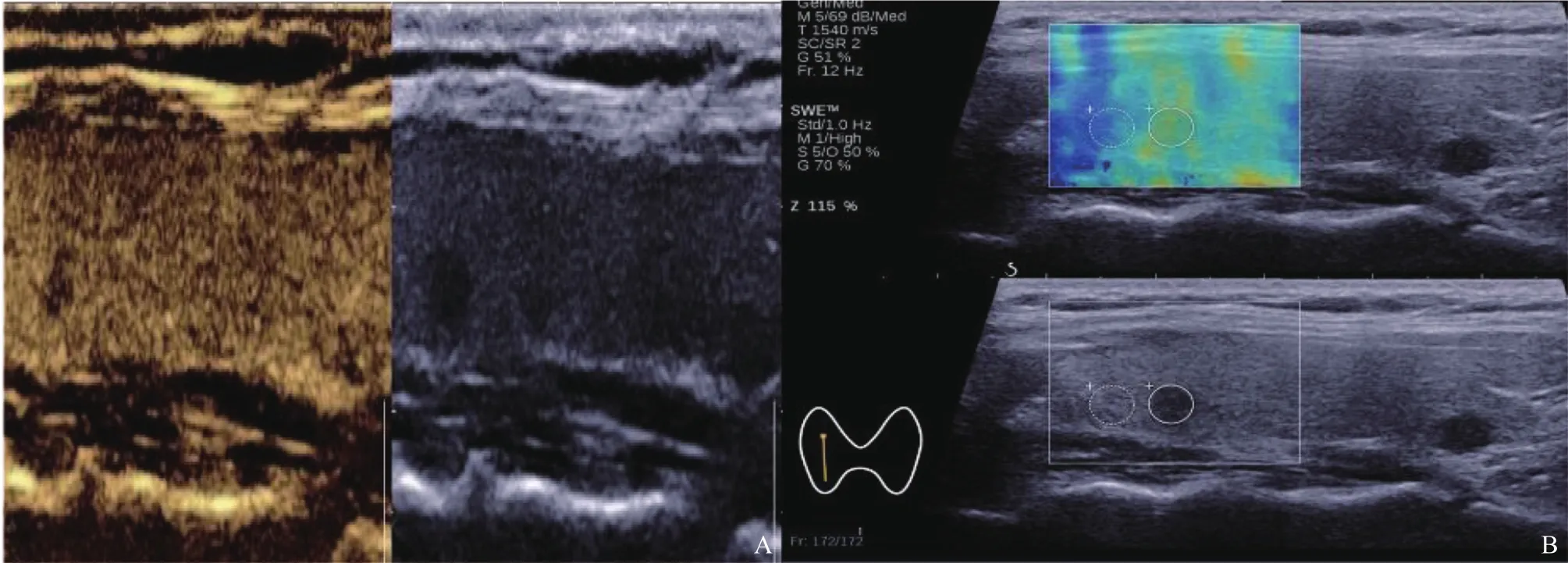
图2 甲状腺微小乳头状癌声像图
2.3 MMTC与PTMC的SWE比较
MMTCEmin、Emean均小于PTMC,其差异均有统计学意义(Z=4.238,P<0.010;Z=3.069,P=0.002,图1B,图2B);MMTC与PTMCEmax、Eratio比较差异均无统计学意义(P>0.05,表2)。

表2 MMTC与PTMC SWE比较 M(IQR)
3 讨 论
本研究MMTC患者年龄大于PTMC患者。有学者[10]报道,MTC分为遗传性与散发性,散发性MTC患者以中老年多见且发病率远高于遗传性MTC,故推测MTC以中老年多见,但目前国内外尚缺乏对MMTC患者年龄的大数据研究,需要扩大数据和进一步研究。PTC是最常见的甲状腺癌,龚志刚等[11]研究报道,甲状腺癌任何年龄均可发病,但以青壮年多见。Kauffmann等[12]研究报道,年龄是PTC的重要预后因素,<45岁的患者无论分期如何,其生存率较高,而≥60岁的PTC患者,在所有疾病阶段均具有较差的疾病特异性生存期和无病生存期。PTMC患者普遍生存率较高,故推测PTMC可能以中青年多见。本研究中MMTC患者与PTMC患者均多为女性,与李婷婷等[13]进行甲状腺癌流行病学调查显示甲状腺癌患者多为女性的结果相似,这可能与雌激素参与了甲状腺癌的形成有关。本研究中MMTC患者与PTMC患者性别差异无统计学意义。
CEUS是评估微血管形成的超声新技术。Zhang等[14]研究报道,CEUS对甲状腺结节的识别具有较高的准确度,可提供更多的结节微血管的灌注信息。吴子超[15]的研究报道,CEUS在诊断甲状腺微小结节良恶性方面的准确度、灵敏度、特异度高于单一运用常规超声。
本研究中PTMC和MMTC增强程度差异有统计学意义,PTMC主要表现为相对较单一的低增强,与陈立斌等[16]研究报道类似,PTMC低增强比例显著高于MMTC,MMTC约一半比例表现为低增强(明显低于PTMC),另一半比例为高增强和等增强,这可能与MMTC血供较PTMC丰富有关[17]。因此我们认为MMTC超声增强程度构成较PTMC更多样化,更易表现为等增强与高增强。此外,低增强常倾向于恶性结节,高增强常倾向于良性结节,结合本研究结果,我们认为MMTC比PTMC表现出更多良性CEUS特征。两者均多为不均匀增强,差异无统计学意义。Zhan等[18]研究报道,CEUS与常规超声结合可明显提高诊断性能。因此CEUS可作为常规超声诊断MTC、PTC的有力补充。
SWE是评估甲状腺结节硬度的一项超声新技术。李拓等[19]研究报道,SWE能提高常规超声对PTMC的检出率。Fukuhara等[20]研究报道,SWE对甲状腺微小结节的筛查及良恶性的鉴别诊断具有一定的价值。以上研究肯定了SWE对于甲状腺结节的诊断价值,但很少有学者进一步进行MMTC或者MMTC与PTMC鉴别诊断的SWE研究。
本研究结果表明MMTCEmin及Emean均小于PTMC,差异均有统计学意义,可能与两者内部组织构成相关。MMTC细胞起源于甲状腺滤泡旁C细胞,具有丰富的间质,癌细胞具有多形性,核仁不清晰,核分裂象少见,被纤维血管和/或淀粉样物分隔[21],而PTMC细胞起源于甲状腺滤泡上皮或滤泡旁上皮细胞[22],与MMTC相比细胞间质存在更多纤维,另外可在其内沉积的砂粒体可能是引起其硬度较MMTC高的原因。Xu等[23]研究报道,与CEUS结合可在一定程度上提高单独SWE的诊断灵敏度。提示我们可以在常规超声的基础上结合CEUS与SWE特征进行综合判断。
本次研究的不足主要有以下两点。首先,由于MMTC发病率低,纳入患者数少;其次,未进行MMTC、PTMC颈部淋巴结的CEUS、SWE淋巴结特征研究,我们期待获得更多数据,弥补以上不足。
综上,MMTC患者年龄大于PTMC患者年龄,两者患者均多为女性;MMTC高增强和等增强比例高于PTMC。MMTCEmax、Emin及Emean均小于PTMC,这些特征有助于两者的鉴别诊断,可结合CEUS进行综合判断。CEUS、SWE能为MMTC和PTMC的鉴别诊断提供更多的参考依据,可作为常规超声的附加诊断方法。

