黑玉米籽粒花色苷降解动力学及稳定性
崔丽霞,张志军,2*,李会珍,2
(1.中北大学 化学工程与技术学院,太原 030051;2.中北大学晋中产业技术创新研究院,山西 晋中 030600)
黑玉米又称紫玉米,是玉米栽培中的一个变种,具有色泽独特、适口性好、营养丰富等特点,被营养学家称为健康食品、功能食品、益寿食品[1]。因黑玉米籽粒角质层中花色苷含量较高,其种皮呈紫色或黑色。花色苷是自然界重要的水溶性多酚类色素,能够赋予植物多种多样的颜色变化。研究表明,花色苷具有很强的抗氧化[2]、抗癌[3]、降血糖[4]、降血脂[5]、抑制炎症[6]、保护心血管[7]等多种生理活性,可以作为安全的着色剂应用在食品、化妆品及医药行业。
黑玉米产品在加工过程中,其稳定性会受到加工工艺、产品成分等多种因素的影响。花色苷的含量会随着温度的升高和处理时间的延长而减少,色泽发生改变,严重影响产品的品质和营养价值。目前关于黑玉米花色苷稳定性的研究多集中在检测不同条件下花色苷含量的变化方面,而关于黑玉米花色苷的降解动力学报道较少,且选择的研究范围较小[8-9],如只研究花色苷在pH为4.0时的降解动力学[10],得到的降解动力学数据有限。因此,降解动力学的研究有利于黑玉米花色苷的开发应用。
本文深入探讨了不同pH、温度、光照、氧化剂(H2O2)和还原剂(Na2SO3)对黑玉米籽粒花色苷稳定性的影响,在此基础上,通过计算建立了降解动力学模型,为黑玉米花色苷的实际加工生产和应用提供了有意义的数据。
1 材料与方法
1.1 材料
成熟的黑玉米籽粒:中北大学生物资源研究所提供;无水乙醇、盐酸、氢氧化钠、氯化钾、乙酸钠、过氧化氢、亚硫酸钠:国药集团化学试剂(上海)有限公司。上述化学试剂均为分析纯。
1.2 主要仪器与设备
SB-5200DTDN超声波清洗机、SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;SHZ-95B旋转蒸发仪 巩义市予华仪器有限责任公司;TDL-60B离心机 上海安亭科学仪器厂;UV-8000S扫描型紫外可见分光光度计 上海元析仪器有限公司;TP310酸度计 北京时代新维测控设备有限公司;AB-8大孔树脂 天津欧瑞生物科技有限公司。
1.3 实验方法
1.3.1 黑玉米花色苷的提取与纯化
花色苷的提取与纯化参考Cui等[11]的方法并略作改动。将黑玉米籽粒用粉碎机粉碎,称取一定量的黑玉米粉末,按照料液比1∶20加入体积分数为60%的乙醇溶液(含0.1% HCl),50 ℃超声辅助提取30 min。提取结束后,以5000 r/min的转速离心10 min,取上清液,50 ℃减压浓缩,除去乙醇,得到紫红色液体。用预处理的AB-8树脂继续纯化此紫红色液体,用60%的酸化乙醇洗脱,将洗脱液于50 ℃减压浓缩除去乙醇,采用冷冻干燥机进行干燥,得到黑玉米籽粒花色苷的固体粉末,呈深黑色,此为下一步的实验材料。
续 表
续 表
1.3.2 花色苷最大吸收波长扫描
将花色苷粉末用蒸馏水(含0.01% HCl)溶解,用盐酸或氢氧化钠溶液分别将其配制成pH为1.0~7.0的花色苷溶液,用紫外可见分光光度计进行光谱扫描,记录数据,绘制曲线,并观察其颜色随时间的变化规律。
1.3.3 不同pH黑玉米花色苷溶液的热处理
配制1 mg/mL的花色苷溶液5份,调节溶液的pH至1.0,2.0,3.0,4.0,5.0。将上述不同pH的色素溶液分装,在恒温水浴锅中于50,60,70,80,90 ℃避光条件下处理5 h,每隔1 h测定溶液中花色苷的含量。
1.3.4 光照对黑玉米花色苷稳定性的影响
配制1 mg/mL的花色苷溶液2份,用2 mol/L的盐酸调节溶液pH至2.0,分装于透光性良好的试管中,在避光和自然光照条件下于23 ℃处理20 d,每隔2 d取样,分别测定溶液中花色苷的含量。
1.3.5 氧化还原剂对黑玉米花色苷稳定性的影响
配制1 mg/mL的花色苷溶液,用2 mol/L的盐酸调节溶液pH至2.0,室温避光条件下研究不同体积分数的H2O2(0.0%、0.5%、1.0%、1.5%、2.0%)对溶液中花色苷含量的影响。
配制1 mg/mL的花色苷溶液,用2 mol/L的盐酸调节溶液pH至2.0,室温避光条件下研究不同质量分数的Na2SO3(0.0%、0.1%、0.2%、0.4%、1.0%)对溶液中花色苷含量的影响。
1.3.6 花色苷含量的测定
采用pH示差法测定溶液中花色苷的含量[12]。用pH为1.0的氯化钾缓冲液和pH为4.5的醋酸钠缓冲液将待测花色苷溶液稀释至一定倍数,室温下放置60 min,分别在510 nm和700 nm波长处测定其吸光值,根据式(1)计算吸光值A,根据式(2)计算花色苷含量C(mg CGE/mL):
A=(A510 nm-A700 nm)pH 1.0-(A510 nm-A700 nm)pH 4.5。
(1)
式中:A510 nm为510 nm波长处的吸光值;A700 nm为700 nm波长处的吸光值。
(2)
式中:DF为稀释倍数;MW为矢车菊素-3-O-葡萄糖苷(C3G)的摩尔质量,449.2 g/mol;ε为摩尔消光系数,26900 L/(mol·cm);L为比色皿光程,cm。
1.3.7 降解动力学参数计算
假定本实验中黑玉米花色苷的降解符合一级动力学模型。根据式(3)计算动力学参数[13]:
ln(C/C0)=-kt。
(3)
式中:C0为溶液的初始花色苷含量,mg/mL;C为溶液加热t时间时的花色苷含量,mg/mL;k为降解速率,h-1;t为加热时间,h。
当C/C0=1/2时,花色苷残留率为50%,降解半衰期为:
(4)
用Arrhenius方程计算花色苷降解反应的活化能Ea:
(5)
式中:Ea为表观活化能,kJ/mol;T为绝对温度,K;R为气体常数,8.314 J/(mol·K);k0为频率常数,h-1。
用Q10表示温度系数:
(6)
式中:k2和k1分别表示温度为T2和T1时的反应速率常数。
Z表示半衰期变化10倍所需的温度变化,℃;花色苷的递减时间D值和Z值分别通过式(7)和式(8)计算[14]:
(7)
T=-Zlgt1/2+b。
(8)
式中:b为线性方程的截距。
通过式(9)、式(10)、式(11)计算焓变△H、吉布斯自由能△G和熵变△S[15]:
△H=Ea-RT。
(9)
(10)
(11)
式中:h为普朗克常数,6.6262×10-34J/s;kB为玻尔兹曼常数,1.3806×10-23J/K。
1.4 数据处理
实验平行测定3次,使用SPSS 22.0进行数据的单因素方差分析及显著性检验,使用Origin 8.0绘制图表并进行线性回归分析。
2 结果与分析
2.1 不同pH下花色苷最大吸收波长
对不同pH的黑玉米花色苷溶液在400~700 nm波长范围内进行扫描。由图1可知,不同pH的花色苷溶液吸收光谱各异,在pH 1.0~7.0范围内,花色苷最大吸收波长依次为507,508,510,512,522,531,546 nm,溶液颜色由深红色变成浅红色。当pH≥6时,最大吸收波长明显发生红移,说明溶液中红色的2-苯基苯并吡喃阳离子结构变为无色的半缩醛,导致吸光度降低,稳定性变差[16]。花色苷在低pH时相对稳定,在高pH时容易降解[17],故热降解实验在pH 1.0~5.0之间进行研究。
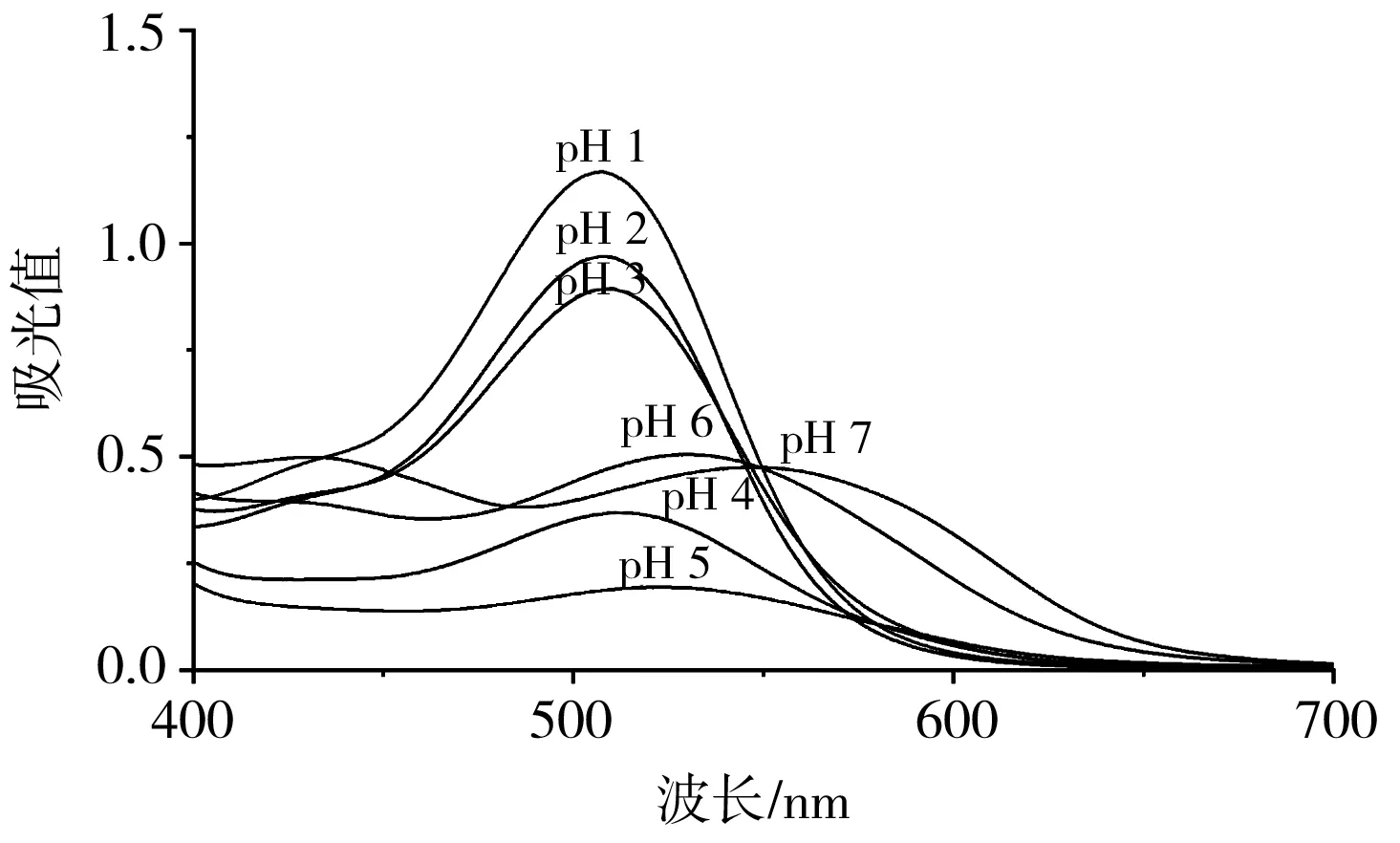
图1 pH为1.0~7.0时黑玉米花色苷吸收波长扫描图谱
2.2 不同pH、温度对黑玉米花色苷残留率的影响
不同pH下黑玉米花色苷的残留率变化见图2。
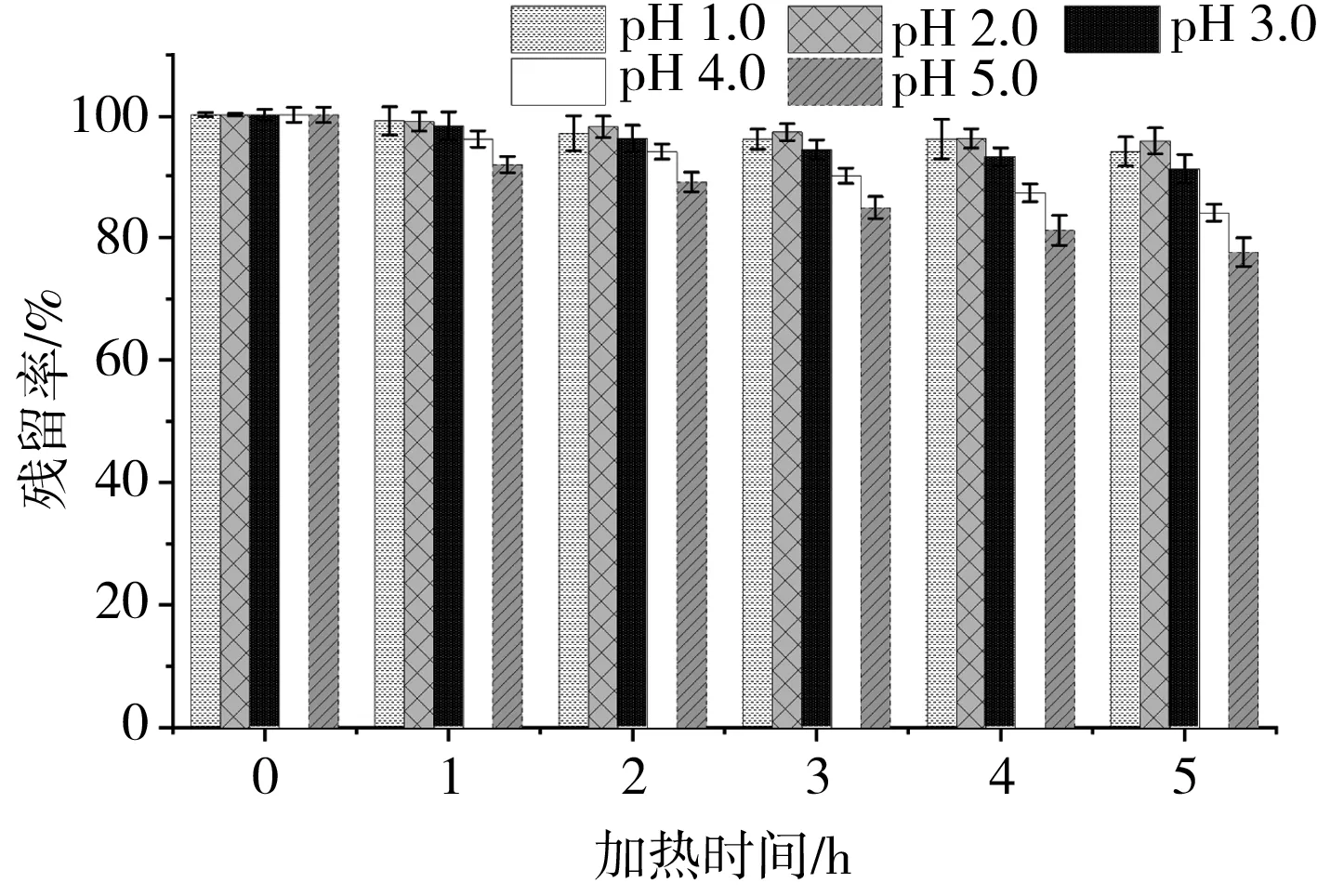
图2 不同pH下黑玉米花色苷的残留率
由图2可知,经过50 ℃热处理5 h,各处理组的降解程度不同。pH 1.0~3.0的溶液较pH 4.0~5.0的溶液残留率更高。其中pH 2.0的溶液在50 ℃加热5 h后花色苷残留率高达95.72%,而pH 5.0的溶液在相同处理条件下残留率仅为77.58%,表明黑玉米花色苷在低pH条件下更稳定,故应在低pH下处理样品。
由图3可知,在相同的pH体系下,黑玉米花色苷经过热处理后发生了不同程度的降解,且加热时间越长、加热温度越高,降解越严重。50 ℃时花色苷降解缓慢,90 ℃时花色苷降解程度明显高于其他温度。50 ℃加热5 h,pH 1.0~5.0的溶液中花色苷的残留率分别为94.29%、95.72%、91.16%、83.99%、77.58%。90 ℃加热5 h,pH 1.0~5.0的溶液中花色苷的残留率仅为49.50%、51.78%、39.80%、32.02%、26.15%,说明温度对花色苷分子的稳定性影响较大,在食品加工时,黑玉米花色苷的处理应尽量在较低温度下进行。
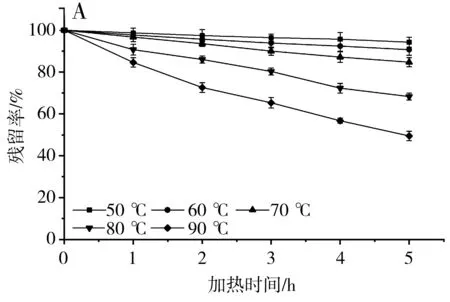
图3 黑玉米花色苷残留率在不同pH和温度下的变化
2.3 不同pH和温度下黑玉米花色苷热降解动力学研究
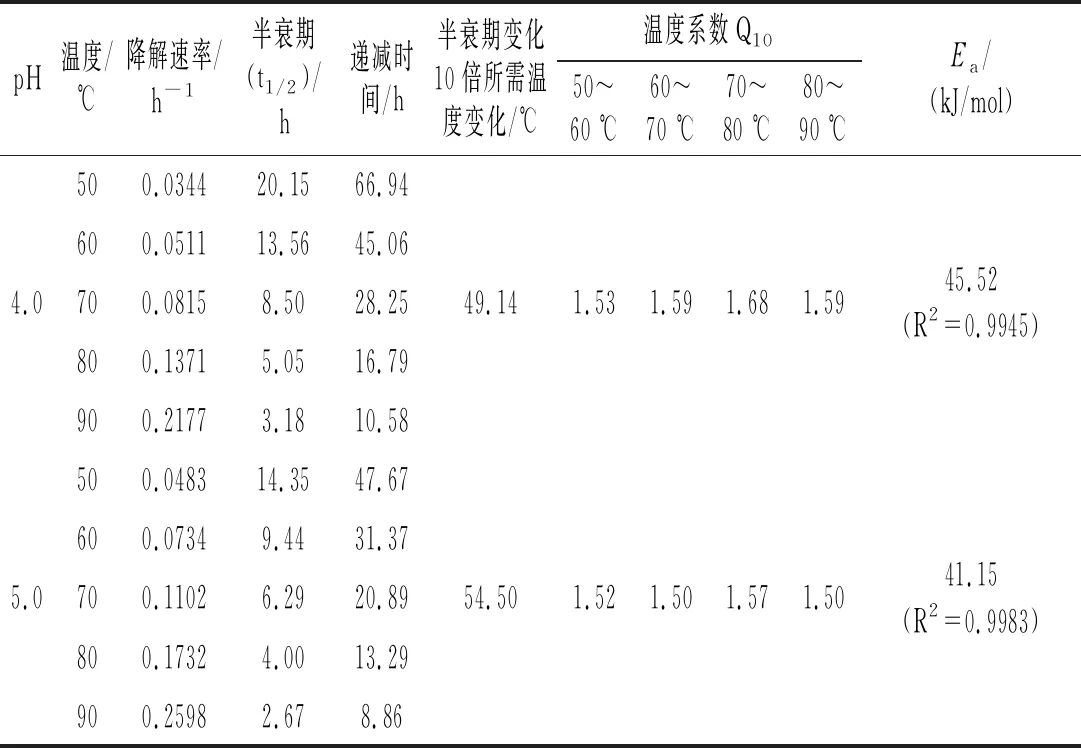
由式(3)计算在不同pH和温度下黑玉米花色苷的降解速率并进行线性回归,结果见表1。结果表明,各温度下黑玉米花色苷的降解符合一级动力学反应模型(R2>0.96),与不同来源的花色苷例如铁皮石斛[18]、蓝莓[19]、黑米[20]等结果相似。
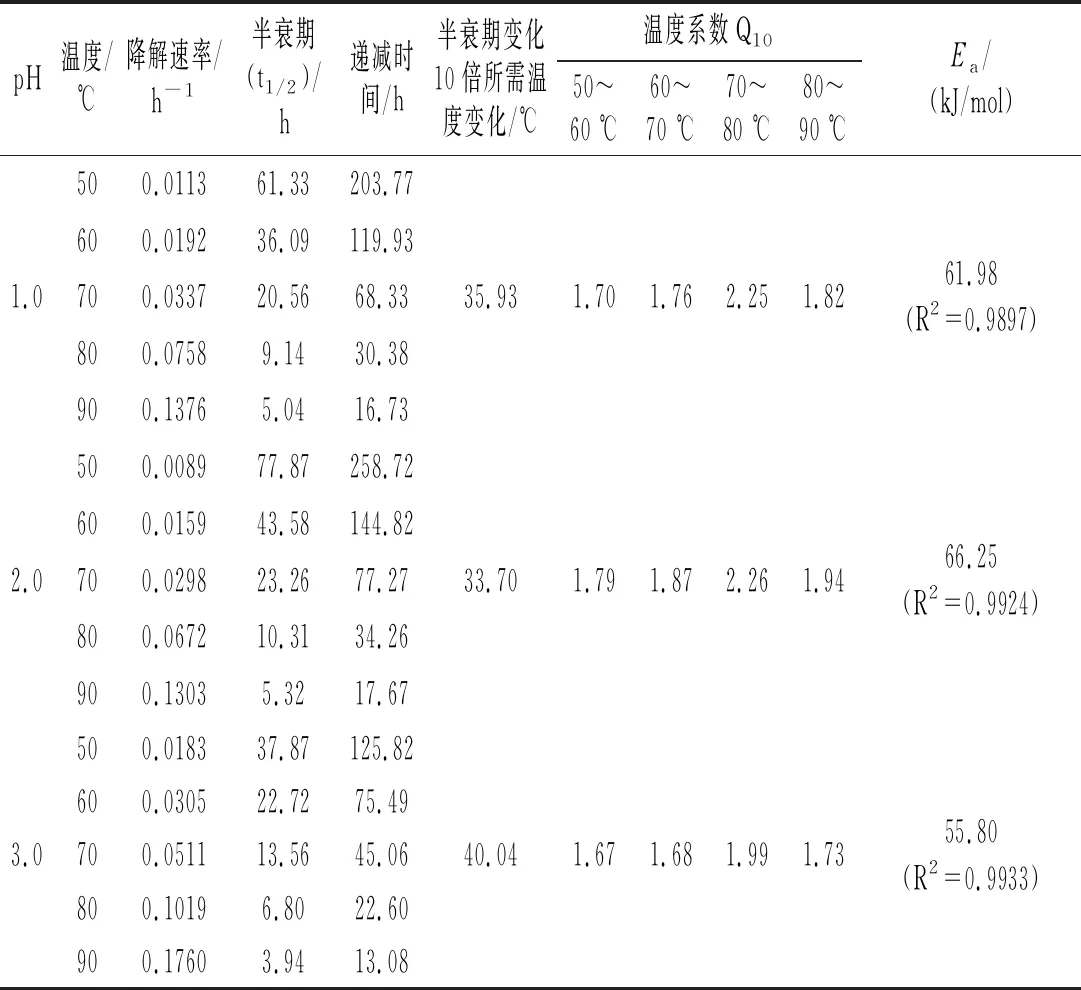
表1 黑玉米花色苷在不同pH和温度下的动力学参数
由表1可知,不同pH条件下,黑玉米花色苷的热稳定性不同。相同的pH体系下,温度越高,热降解速率k越大,半衰期t1/2越小,同时伴随着递减时间D值也变小。温度为50 ℃时,各pH下的半衰期依次为61.33,77.87,37.87,20.15,14.35 h,温度升高至80 ℃时各pH下的半衰期依次为9.14,10.31,6.80,5.05,4.00 h,说明相同pH下高温对花色苷的破坏程度大。在pH 1.0~5.0时,反应活化能区间为66.25~41.15 kJ/mol,pH为2.0时Ea最大,pH为5.0时Ea最小,说明pH为2.0时的热稳定性最好,热降解所需的能量最高。黑玉米花色苷在较高酸度(pH 1.0)或较低酸度(pH 5.0)下皆会加速花色苷热降解,与马奕瑜等和潘颖等[21]的研究结果相似。
温度系数Q10表示温度每升高10 ℃反应速率增大的比例数[22]。从温度系数Q10可以看出,其随着温度的升高而增大,70~80 ℃的Q10值最高,然后Q10值随温度升高反而降低,说明在70~80 ℃温度范围内处理黑玉米花色苷会加快色素的热降解速率。所以在食品加工时,黑玉米花色苷应尽量避开温度敏感区。pH为5.0时,Q10的变化规律与其他pH下的变化规律稍有不同,可能是因为花色苷结构受弱酸条件的影响而发生改变,从而降低了热稳定性。
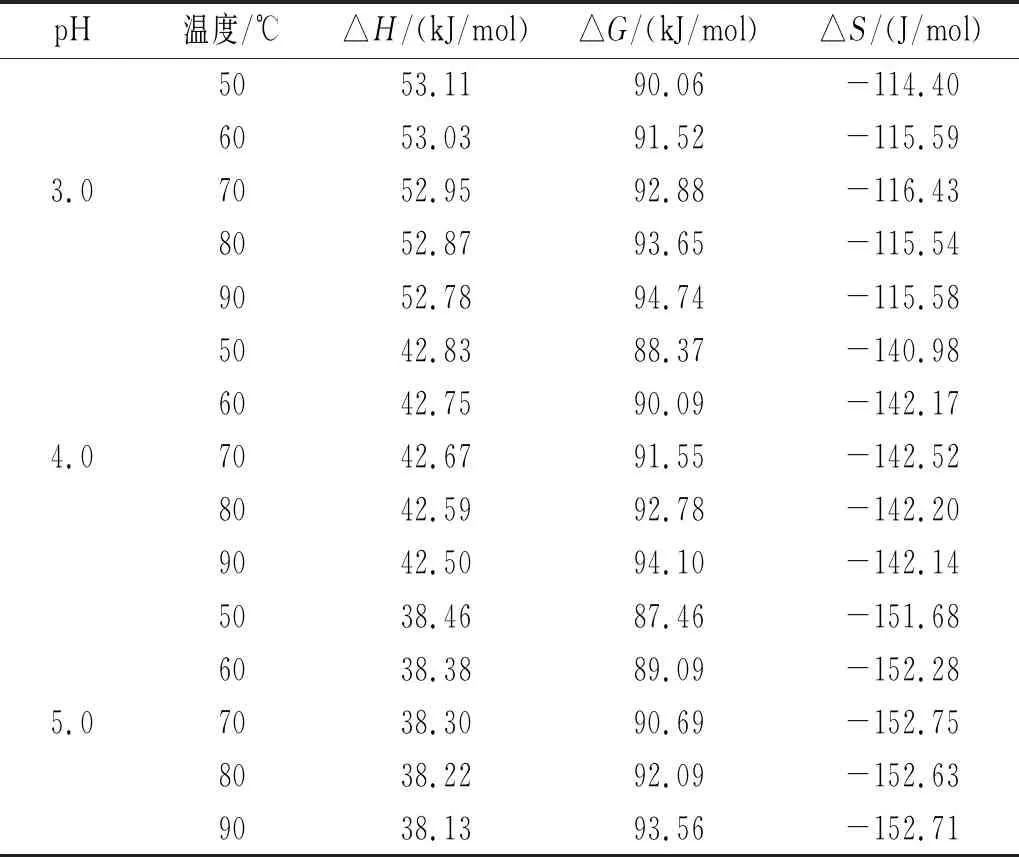
反应物和活化络合物之间的能量差用△H表示。由表2可知,在pH相同的情况下,随着温度的改变,△H的变化幅度不大,表明在一定温度范围内降解的能量势垒大小与温度无关[23]。△H均为正值,说明黑玉米花色苷降解反应为吸热反应。降解花色苷的能量由高温提供,高温还促进了活化络合物的形成。
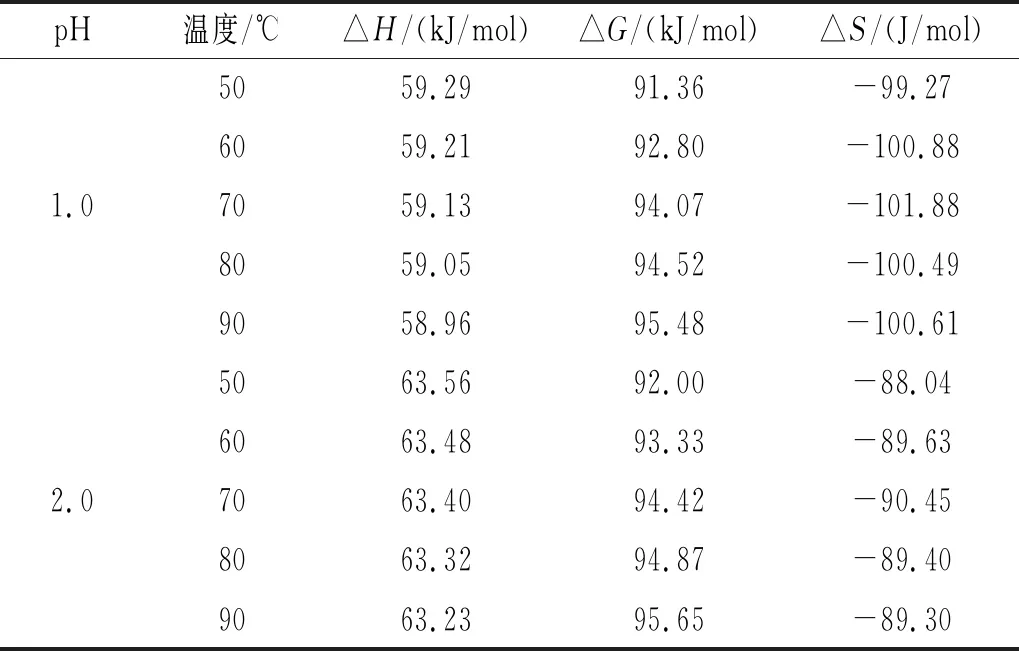
表2 黑玉米花色苷在不同pH和温度下的热力学参数
反应是否能自发进行可以通过吉布斯自由能△G来判断[24]。由表2可知,△G均为正值,变化范围为87.46~95.65 kJ/mol,说明黑玉米花色苷的降解反应属于非自发反应。
△S可以反映体系中分子的无序变化。相同pH条件下,△S受温度影响变化范围较小。pH为2.0时△S绝对值变化范围为88.04~90.45 J/mol,显著低于pH为5.0时的变化范围151.68~152.75 J/mol,说明黑玉米花色苷在pH为2.0时对热处理较不敏感。自身热力学平衡与初始系统之间的距离越短,则发生降解的概率越低[25],因此当溶液pH为2.0时,黑玉米花色苷最不易发生降解。
2.4 光照对黑玉米花色苷稳定性的影响
由图4可知,pH为2.0的黑玉米花色苷在避光和自然光处理条件下均发生了不同程度的降解,且自然光下降解更为严重。在避光和自然光条件下分别处理20 d,花色苷残留率分别为83.31%和61.92%。室温避光和自然光条件下的降解均符合一级反应动力学模型(R2>0.98),降解速率分别为0.0091 d-1和0.0237 d-1,半衰期分别为76.17 d和29.25 d。文献[26]考察了避光和室内自然光条件下0~36 h内玉米籽粒花色苷色素的稳定性,此条件下花色苷比较稳定。本实验经过20 d的观察测定,进一步反映了黑玉米花色苷的降解规律。
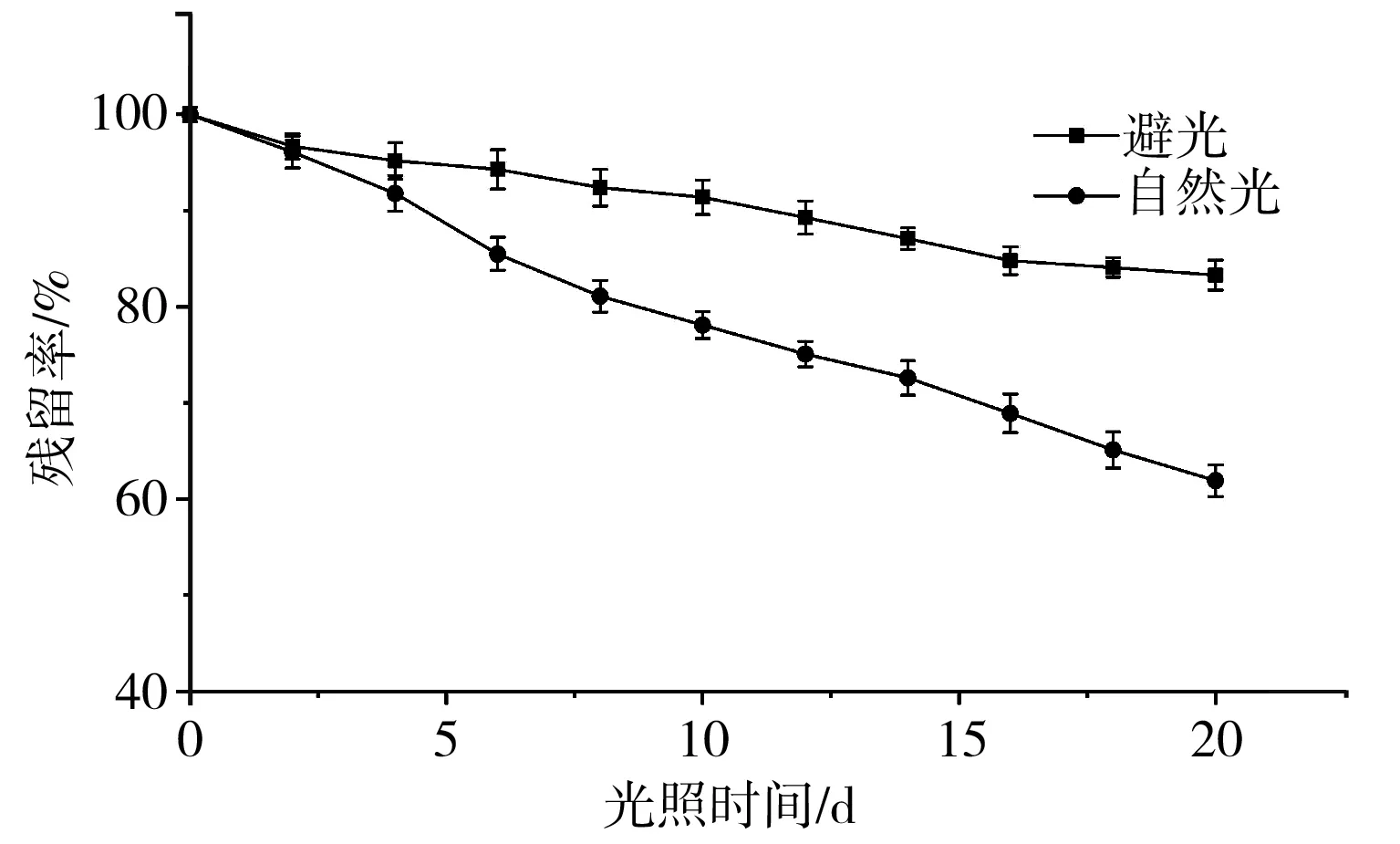
图4 光照对黑玉米花色苷稳定性的影响
2.5 氧化还原剂对黑玉米花色苷稳定性的影响
由图5可知,黑玉米花色苷的残留率受不同体积分数H2O2的影响不同。H2O2体积分数为2.0%时,花色苷的残留率最小,处理50 min后,溶液的颜色变浅,接近无色,花色苷的残留率仅为2.11%。不添加H2O2的对照在室温条件下处理0 min与50 min花色苷残留率没有显著差别(P>0.05)。花色苷的降解符合一级降解动力学模型(R2>0.98),0.5%~2.0%体积分数的H2O2处理条件下花色苷的降解速率分别为0.0219,0.0464,0.0601,0.0743 min-1,对应的半衰期分别为31.65,14.94,11.53,9.33 min,说明氧化剂H2O2使花色苷迅速氧化,降低了其稳定性。
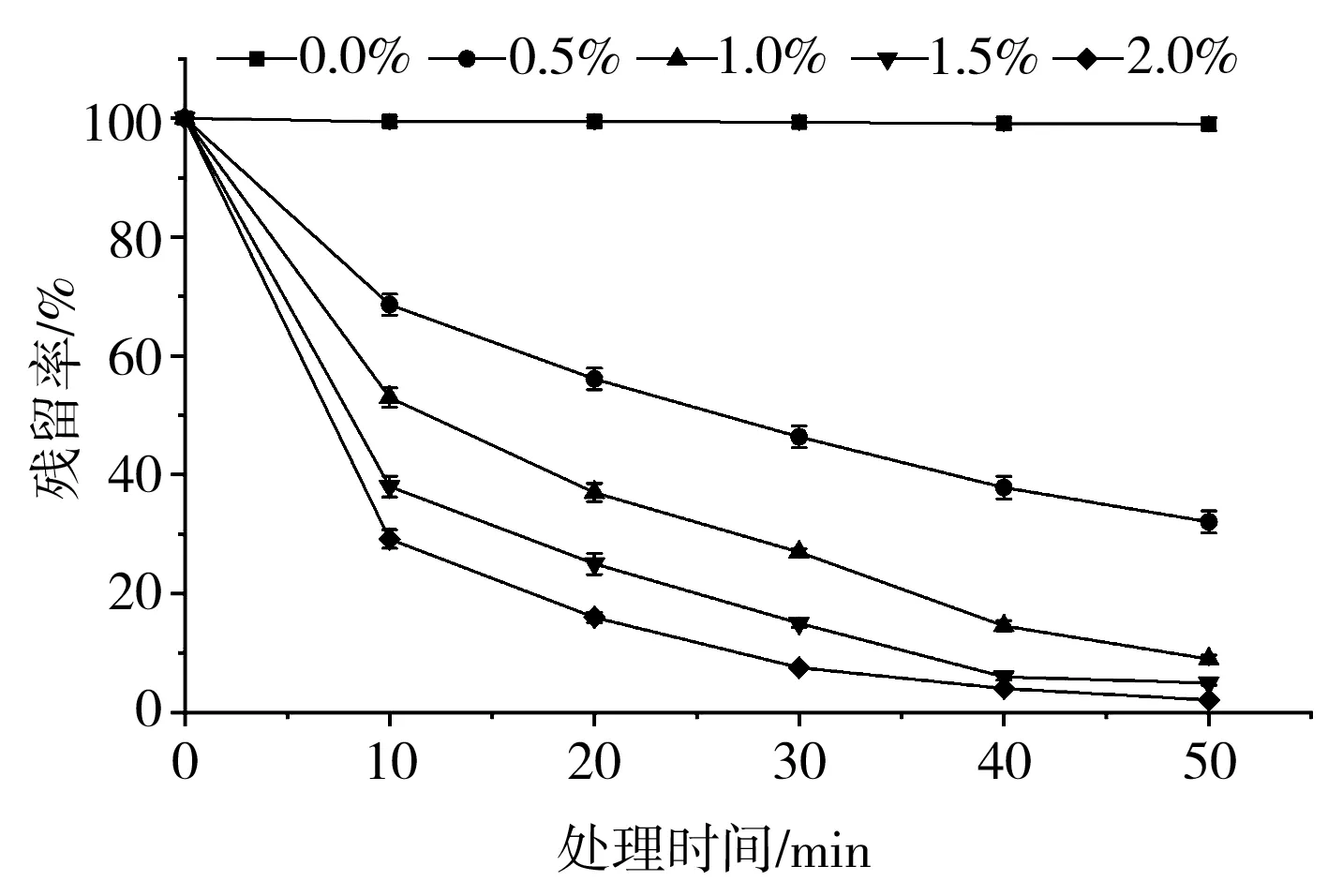
图5 H2O2对黑玉米花色苷稳定性的影响
由图6可知,随着处理时间的增加,不同质量分数的Na2SO3对黑玉米花色苷均有降解作用,处理时间为1 h时,质量分数为0.1%和1.0%的溶液花色苷残留率分别为56.35%和31.09%,处理时间为2 h时,残留率分别为48.17%和18.12%,处理时间为5 h时,残留率分别为45.13%和16.84%,说明还原剂处理超过2 h后,色素的残留率变化不大。文献[18-19]表明0.2%的Na2SO3可延缓花色苷的降解,本实验研究浓度范围内Na2SO3的添加均导致了花色苷的降解,可能是由于二者的花色苷来源不同。
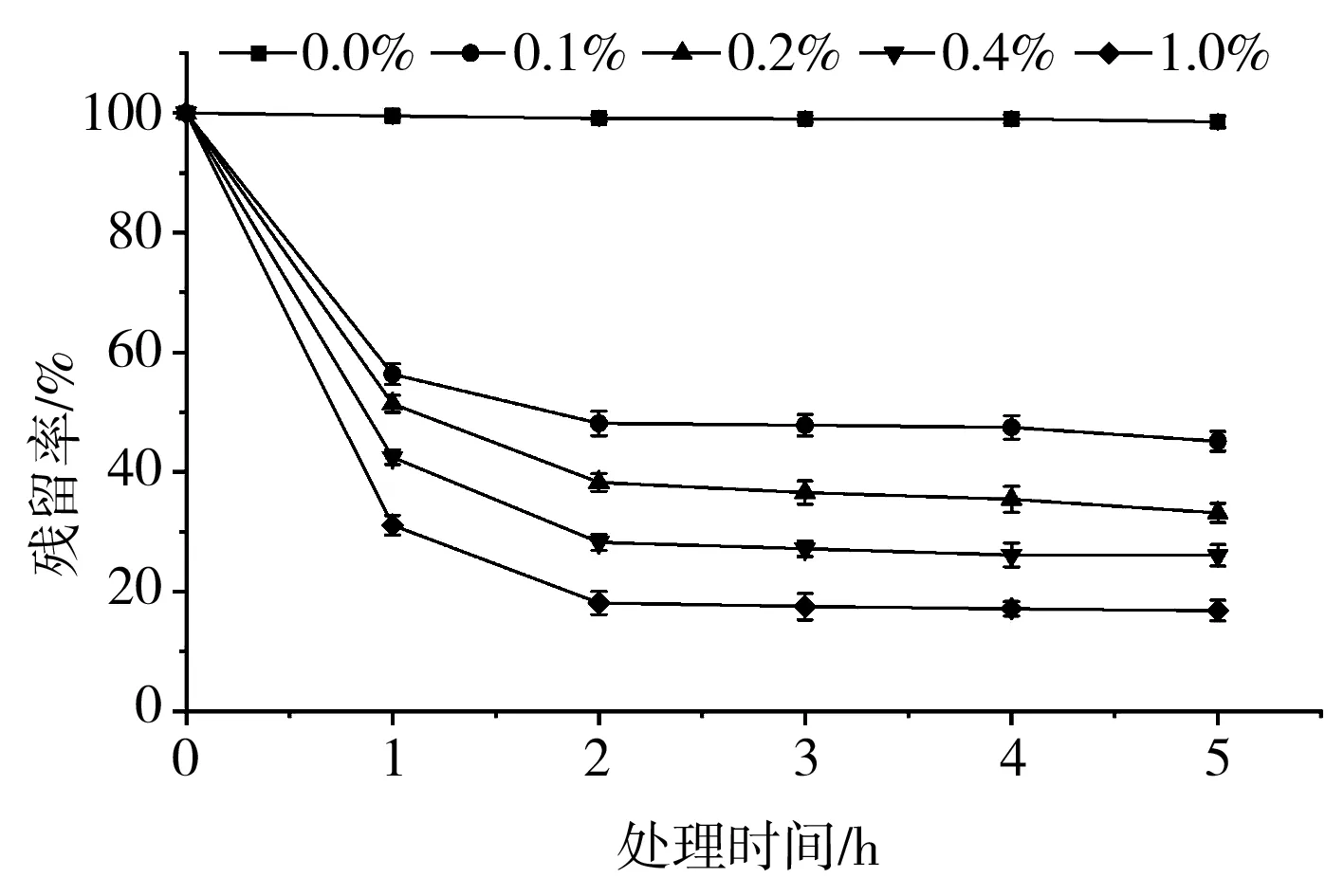
图6 Na2SO3对黑玉米花色苷稳定性的影响
3 结论
不同pH下黑玉米花色苷热稳定性不同,酸性条件下的热稳定性强于弱酸条件,pH为2.0时花色苷热稳定性最强,pH为5.0时花色苷对热最敏感。黑玉米花色苷的热降解符合一级动力学模型,当pH相同时,温度越高,其降解速率越快,伴随着半衰期和递减时间的减少;在不同pH体系中,活化能和Z值不同,pH为2.0时活化能最大,Z值最小。通过热力学分析得出,花色苷热降解为吸热非自发反应。黑玉米花色苷对光敏感,避光条件下降解速率较慢,而自然光条件下花色苷降解速率加快。黑玉米花色苷在H2O2处理条件下的降解符合一级动力学模型。H2O2的体积分数越大,花色苷的残留率越小。当用体积分数为2.0%的H2O2处理50 min时,溶液的颜色变浅,接近无色,花色苷的残留率仅为2.11%。不同质量分数的Na2SO3对花色苷的降解作用不同,其降解率随Na2SO3质量分数的增大而增大。本研究可为黑玉米籽粒花色苷的实际深加工和生产提供指导。

