多参数磁共振在乳腺非肿块性强化病变病理性质及分子亚型中评估作用探究
秦小雪,席佳佳,徐 佳
(东部战区总医院秦淮医疗区影像科,江苏 南京 210000)
乳腺非肿块性强化(Non mass enhancement of breast,NME)指乳腺内无肿块强化特征,病灶内夹杂脂肪、乳腺腺体等成分,致使强化影无连续的一种乳腺病变,NME由于无明显占位效应、边界不清晰,临床诊断时难以准确鉴别其良恶性,从而延误最佳治疗时机,因此,尽早定性诊断及明确其分子亚型至关重要[1,2]。以往临床常采用超声、钼靶等进行检查,虽可有效显示病灶形态结构等病理信息,但诊断灵敏度偏低,存在一定局限性[3]。磁共振(MRI)成像目前已广泛应用与乳腺疾病检查中,其中动态增强磁共振成像(DCE-MRI)可清晰显示乳腺病灶血管通透性、血管密度等信息,通过观察增强后病灶特征,可有效明确病灶良恶性[4];磁共振弥散加权成像(DWI)为一种可检测病灶组织内水分子扩散运动的检查方案,可通过获取表观扩散系数(ADC)分析乳腺病灶的性质[5]。国内外多篇报道均证实DCE-MRI、DWI检查对乳腺癌具有较高的鉴别诊断价值,但关于多参数MRI对NME良恶性及分子亚型的研究较为有限,基于此,本研究试分析多参数MRI在NME病变病理性质及分子亚型中评估作用。
1 资料与方法
1.1一般资料:选取2018年1月至2021年12月258例NME患者,根据病理结果分为恶性组(n=168)、良性组(n=90),两组基线资料比较见表1。
1.2纳入及排除标准:纳入标准:①均经临床检查确诊为NME;②恶性组均经临床病理检查证实为恶性NME;③可接受DWI、DCE-MRI检查;④均为初次确诊;⑤知晓本研究,并签订知情承诺书。排除标准:①合并其他乳腺疾病;②临床资料不完整;③合并DWI、DCE-MRI检查禁忌症;④合并精神障碍无法配合检查者;⑤合并肾、肝、凝血功能障碍;⑥既往存在手术、放化疗史者;⑦合并其他恶性肿瘤。
1.3剔除标准及处理方法:剔除标准:①研究中发现不符合纳入标准者;②经临床确诊后不接受治疗方案者;③自愿退出研究者;④检查过程出现意外情况,无法继续检查者;⑤影像出现较大伪影对诊断造成干扰者。剔除处理:剔除后根据例数采用1∶1原则重新纳入符合上述纳入标准NME患者。
1.4方法:均采用美国GE HDXT型3.0T超导磁共振扫描仪进行检查,所有检查操作及影像分析均有同两名具有丰富经验的影像学医师进行,当意见不一时经商讨后统一结论。
1.4.1MRI检查:选用8通道相控阵乳腺线圈,引导患者处俯卧位,常规定位后,行平扫,3D扰相快速梯度回波T1WI横轴位扫描参数:TR=600ms,TE=7.9ms,层间距为1mm,层厚为4.0mm,矩阵为320×256mm,激励次数(NEX)为1;脂肪抑制T2WI横轴位扫描参数:TR=820ms,TE=35ms,层间距为1mm,层厚为4.0mm,矩阵为320×192mm,NEX为2;平扫完成后行DWI检查,扫描参数:TR=600ms,TE=69.9ms,层间距为1mm,层厚为4.0mm,矩阵为128×128mm,选取扩散系数b=0、1000s/mm2采用脂肪抑制技术进行分析处理,获取对应表观扩散系数(ADC);DCE-MRI扫描参数:TR/TE=4.3/2.1ms,层厚为1.4mm,反转角度为14度,层间距为1mm,矩阵为416×320mm,NEX为1,先进行蒙片扫描,扫描后由手臂静脉采用高压注射器注入Gd-DTPA对比剂18mL,注射速率2.5mL/s,注射后给予等量、等速生理盐水,采集连续5个周期增强图像,得出动态增强-信号强度曲线(Time-intensity curve,TIC),分析病灶内部强化特点、分布特点及TIC类型。
1.4.2TIC分型标准:参照Kuhl等[6]提出的标准进行分型,其中Ⅰ型:TIC曲线信号强度呈持续缓慢升高,但无显著峰值;Ⅱ型:表现为明显早期强化,但信号强度上下浮动不超过10%,呈维持平台水平;Ⅲ型:表现为明显早期增强上升,2~4min内达到峰值,但中后期增强显著降低,且下浮超过10%。
1.4.3NME分子亚型标准:参照St.Gallen国际乳腺癌会议[7]经免疫组化获取的雌激素受体(ER)、孕激素受体(PR)、细胞周期调节蛋白Ki-67以及人类表皮生长因子受体-2(HER-2)表达情况分为Luminal A型(ER/PR+、HER-2-、Ki-67<20%)、Luminal B型(ER/PR+、HER-2-、Ki-67≥20%)、HER-2型(ER-、PR-、HER-2-)、三阴型(TNBC)(ER-、PR-、HER-2-)。
1.5观察指标:①比较恶性组、良性组多参数磁共振检测结果,包括内部强化特点(簇状、集丛样、不均匀、均匀)、分布特点(局灶、弥漫、多区域、区域、导管、节段)、TIC分型、ADC值及瘤周水肿。②分析多参数磁共振鉴别NME病理性质的诊断价值。③比较恶性NME不同分子亚型患者多参数磁共振检测结果。

2 结 果
2.1两组基线资料比较:258例NME患者,90例为良性(包括囊性增生病6例,腺病64例,导管内乳沟状瘤20例),168例为恶性(包括浸润性导管癌64例,导管内乳头状癌58例,导管内原位癌33例,小叶癌13例)。恶性组基线资料与良性组比较,差异无统计学意义(P>0.05)。见表1。

表1 两组基线资料对比n(%)
2.2两组多参数磁共振检测比较:恶性组内部强化簇状、节段样分布、瘤周水肿患者多于良性组,ADC值低于良性组(P<0.05)。见表2、图1、2。
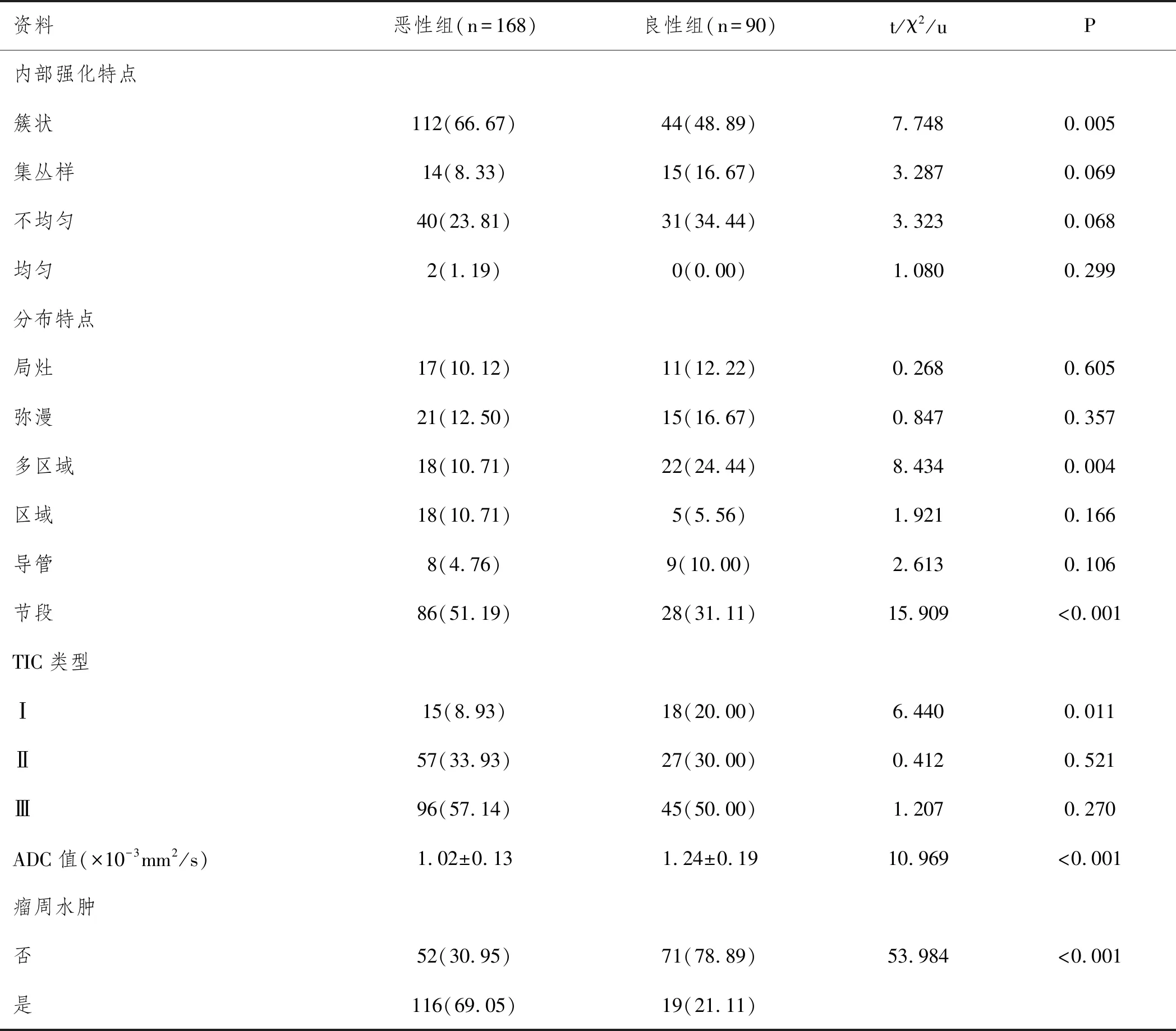
表2 两组多参数磁共振检测结果对比n(%)
图1 恶性组MRI图片
图2 良性组MRI图片
2.3多参数磁共振鉴别NME病理性质效能:绘制ROC曲线显示,内部强化簇状、节段样分布、ADC值、瘤周水肿联合诊断AUC大于任一单一参数,见图3、表3。

表3 多参数磁共振鉴别NME病理性质效能ROC分析结果
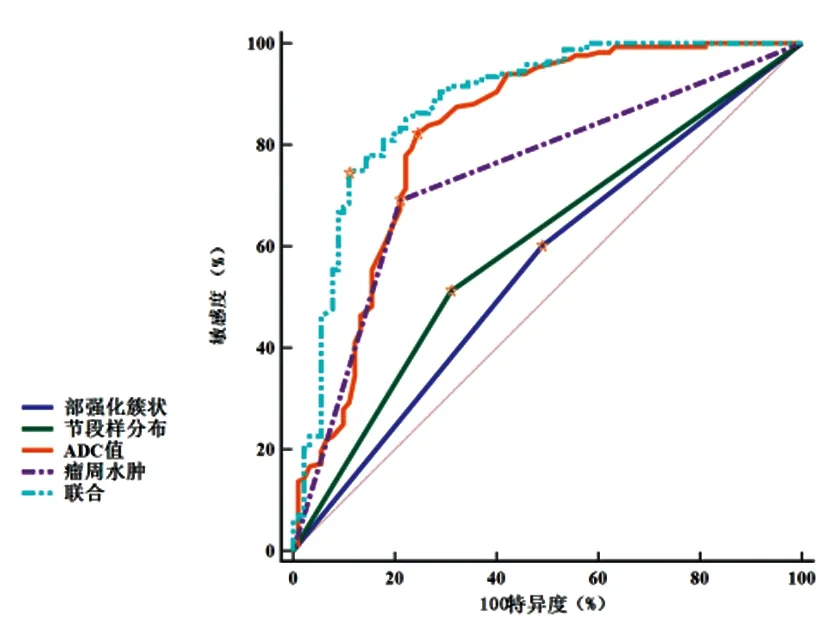
图3 多参数磁共振鉴别NME病理性质ROC曲线
2.4恶性NME不同分子亚型患者多参数磁共振比较:HER-2型ADC值高于Luminal A型、Luminal B型、TNBC型(P<0.05);HER-2型、TNBC型瘤周水肿患者多于Luminal A型、Luminal B型(P<0.05)。见表4。
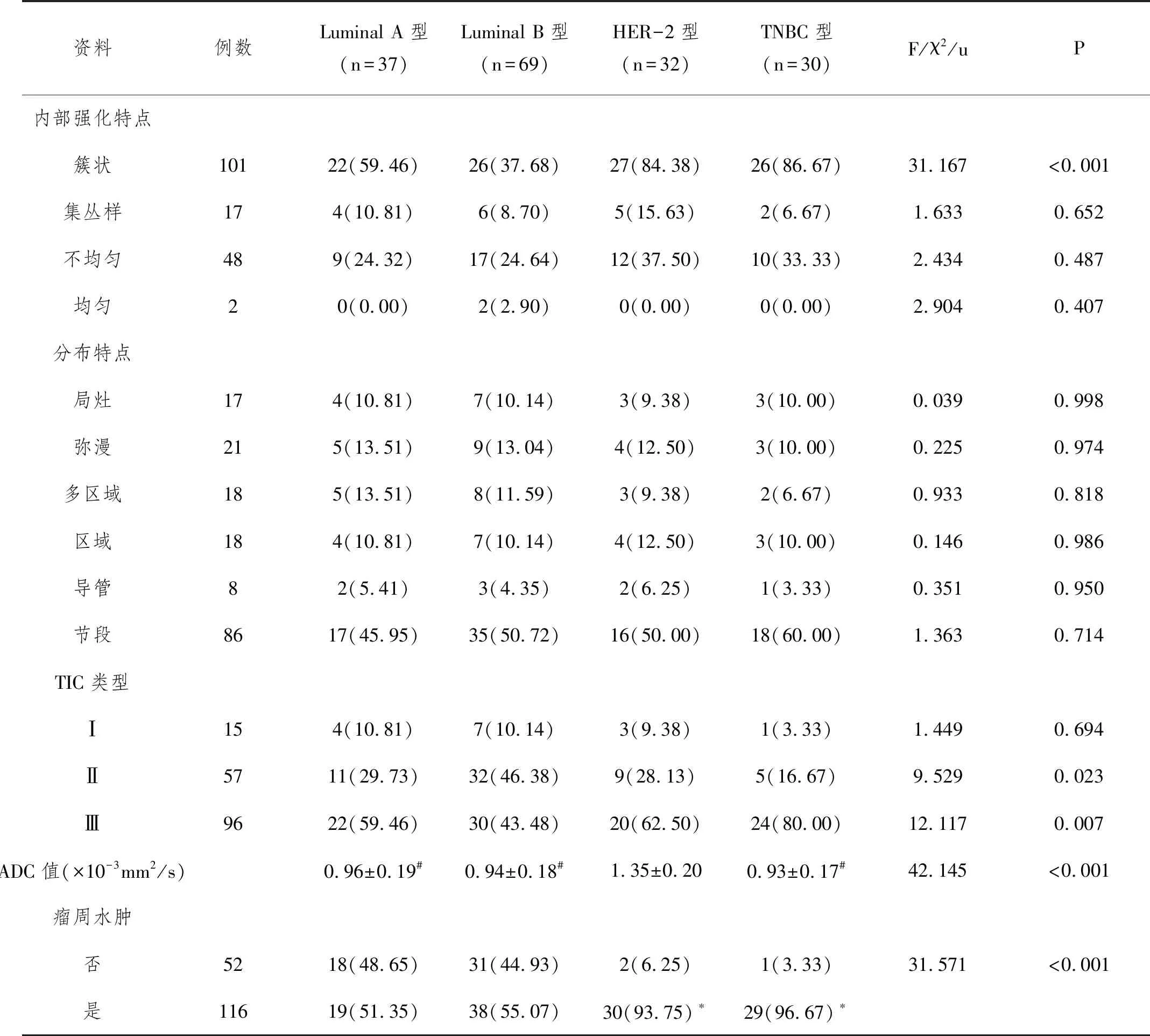
表4 恶性NME不同分子亚型患者多参数磁共振比较
3 讨 论
NME为乳腺MRI检查中较为特殊的一种类型,常规平扫T1WI、T2WI序列难以准确鉴别诊断其良恶性,对临床治疗方案的选择及预后评估造成一定影响,以往临床针对NME常采用超声、钼靶进行检查,但筛查效果一般[8,9]。随着MRI技术不断发展,DWI及DCE-MRI检查逐渐应用于乳腺疾病诊断中,有助于临床鉴别其良恶性[10]。
DCE-MRI检查可有效观察病灶组织的渗透性、血管密度、完整性等病理信息[11]。本研究经DCE-MRI检查显示,恶性组内部强化簇状、节段样分布患者多于良性组,对于恶性NME诊断AUC分别为0.556、0.600,具有一定诊断价值。结合马德晶、李艳玲等[12,13]学者研究分析其原因在于,DCE-MRI通过连续、重复、快速的成像方法,对比分析增强前后病灶组织影像,有效显示微循环功能参数,根据参数变化分析对比剂在病灶中的分布情况,进而鉴别良恶性,相较于常规MRI,DCE-MRI还可反映其生理性变化特征,更加有助于鉴别良恶性[14];于洪伟等[15]研究显示,以穿刺活检结果为“金标准”,DCE-MRI检查对恶性NME诊断准确率为93.17%,进一步证实DCE-MRI检查对NME良恶性的鉴别诊断价值;本研究结果与其结果类似,进一步证实其诊断价值。此外,本研究还发现,良恶性组TIC分型比较无显著差异,表明TIC对于NME良恶性鉴别诊断无意义,其原因可能在于,NME乳腺中包含脂肪组织及正常腺体,内部非完全病灶成分,对TIC反映病灶血流动力学造成一定影像,且NME内部血管较少,血管化程度不同,因此,TIC在NME中呈多样化表现,难以区分其良恶性。
DWI检查可通过测定与含水量相关的组织分子水平,反映病变组织形态学结构及细胞膜完整性等参数。本研究结果显示,恶性组ADC值低于良性组,对NME良恶性诊断AUC为0.823。分析ADC值在恶性NME降低的原因在于,恶性NME病灶组织细胞繁殖旺盛,细胞外容积降低,且细胞生物膜的限制及大分子物质对水的吸附效果增强,致使病灶组织内水分子运动受限;徐琳等学者以ADC=1.05×10-3mm2/s为诊断阈值对NME进行良恶性鉴别,其诊断符合率可达88.75%,进一步证实DWI检查对NME良恶性的诊断价值。临床可通过多参数联合诊断鉴别NME良恶性,以提高诊断准确率。本研究还发现,HER-2型ADC值高于Luminal A型、B型、TNBC型(P<0.05);HER-2型、TNBC型瘤周水肿患者多于Luminal A型、B型,且HER-2型、TNBC型NME更易出现瘤周水肿。杨成等学者研究表明,DWI检查ADC值用于乳腺癌分子亚型、预后评估中具有一定价值,本研究与其结果类似,证实ADC值可用于NME分子亚型评估中。
综上所述,多参数磁共振对于鉴别诊断NME良恶性具有较高价值,临床可通过多参数磁共振进行早期定性诊断及分子亚型分型,以制定相应治疗方案。

