猪δ 冠状病毒实时荧光RT-PCR检测方法的建立与应用
苑建军,杨德全,鞠厚斌,庄建萍,葛菲菲,杨显超,李鑫,沈海潇
(1.上海市崇明区动物疫病预防控制中心,上海 202150;2.上海市动物疫病预防控制中心,上海 201103;3.上海市嘉定区动物疫病预防控制中心,上海 201800)
猪δ 冠状病毒(porcine deltacoronavirus,PDCoV)属于冠状病毒科(Coronaviridae)冠状病毒亚科(Coronavirinae)δ 冠状病毒属,最先由香港大学的Woo等[1]于2012 年从死亡鸟类、鸡、哺乳动物的样本中发现。2014 年2 月,美国学者在表现腹泻症状的仔猪和母猪中发现了PDCoV,病毒导致的仔猪死亡率达30%~40%,造成了严重的经济损失[2-3]。此后,加拿大、韩国、泰国、中国、越南、老挝、日本和墨西哥等国家也相继发现了PDCoV[4-10]。PDCoV 可以感染试验鸡、犊牛和小鼠等多种动物[11-14],也可感染人[15],其跨物种传播的特性和潜力,对动物和人类健康构成了严重威胁[16]。
PDCoV 与猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病 毒(transmissible gastroenteritis virus,TGEV)等猪肠道病原感染引起的临床症状极为相似,且存在混合感染现象,因此对该病毒的检测主要依靠实验室方法进行。本研究建立了一种PDCoV 实时荧光RT-PCR 检测方法,以期为其临床检测和流行病学调查提供技术支持。
1 材料与方法
1.1 材料
1.1.1 病毒和菌株 PEDV、TGEV、猪轮状病 毒(porcine rotavirus,RV)、猪捷申病毒(porcine teschovirus,PTV)、猪嵴病毒(porcine kobuvirus,PKV)、大肠杆菌,均由本实验室保存。
1.1.2 临床样品 2017 年9 月—2019 年3 月,采集上海市规模化猪场出现腹泻症状的仔猪粪便样品42 份,置-80 ℃保存备用。
1.1.3 主要试剂 病毒RNA 提取试剂盒,购自广州美基生物科技有限公司;One Step PrimeScript™RT-PCR Kit、DNA 纯化回收试剂盒、pMD 19-T Vector Cloning Kit、DL 2 000 DNA Marker、DH5α感受态细胞,购自宝日医生物技术(北京)有限公司。
1.1.4 引物和探针设计 从GenBank 中下载不同PDCoV 毒株M基因序列,采用MEGA 5.0 软件进行序列比对,利用Primer express 3.0.1 软件设计引物和探针(表1)。
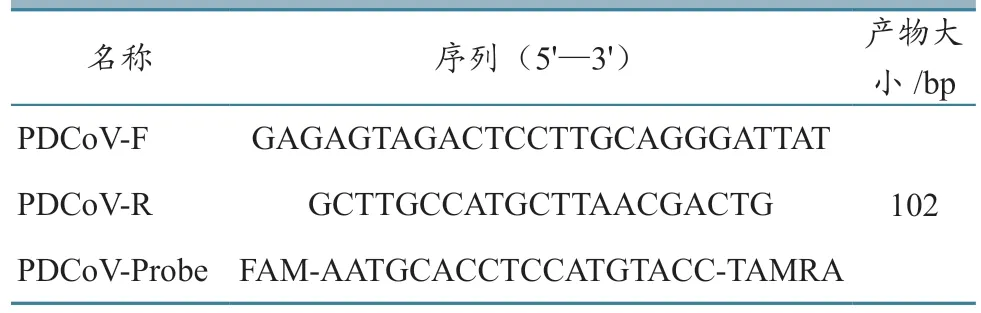
表1 引物及探针序列
1.2 方法
1.2.1 重组质粒标准品构建 将PDCoV S582N株(GenBank 登录号:LC216915)M基因序列送至生工生物工程(上海)股份有限公司合成,并克隆至pMD19-T 载体,转化至DH5α 感受态细胞内,构建重组质粒。测序鉴定无误后抽提质粒作为标准品,利用Nanodrop 2000c 测定质粒浓度,并按下面公式将浓度换算成拷贝数。DNA copies/μL=[6.02×1023×DNA 浓度(ng/μL)×10-9]/(DNA 碱基数×660)
1.2.2 反应条件优化 对反应体系中的引物和探针浓度(引物浓度1.0、0.8、0.6、0.4、0.2 μmol/L,探针浓度1.0、0.5、0.4、0.3、0.2、0.1 μmol/L)、反应参数(反转录时间5、10、15 min,退火温度56、58、60 ℃,退火时间20、30 s)等条件进行摸索和优化,确定最适反应条件。
1.2.3 标准曲线绘制 经计算,阳性重组质粒拷贝数浓度为1.3×1010copies/μL。用ddH2O对阳性重组质粒连续作10 倍系列稀释,分别取浓度为1.3×103~1.3×107copies/μL 的阳性重组质粒作为反应模板,按照优化好的反应条件进行实时荧光RT-PCR 反应,每个梯度重复3 次,绘制标准曲线。
1.2.4 特异性试验 分别以本实验室保存的PEDV、TGEV、RV、PTV、PKV、大肠杆菌核酸及PDCoV 阳性重组质粒为模板,进行实时荧光RT-PCR 扩增,设ddH2O 为阴性对照,评价方法的特异性。
1.2.5 灵敏性试验 用ddH2O 对阳性重组质粒连续作10 倍系列稀释,分别取1.3×100~1.3×106copies/μL的阳性重组质粒进行实时荧光RT-PCR 扩增,设ddH2O 为阴性对照,评价方法的灵敏性。
1.2.6 重复性试验 对拷贝数浓度范围为1.3×104~1.3×107copies/μL 的阳性质粒,采用同批次配制的反应体系重复检测3 次,计算批内变异系数;采用3 个不同批次配制的反应体系重复检测3次,计算批间变异系数。
1.2.7 临床样品检测 将42 份粪便样品分别与PBS按体积比1:10 混悬,震荡混匀,4 ℃ 12 000 r/min 离心10 min;取上清液用试剂盒提取核酸,加入上述反应体系进行实时荧光RT-PCR。同时,按照文献[17]中的普通RT-PCR 方法对样品核酸进行平行检测,将2 种方法的检测结果进行比较,计算两种方法的符合率。
2 结果与分析
2.1 反应条件优化
通过棋盘法对引物和探针浓度进行优化,当上下游引物浓度为0.2 μmol/L,探针浓度为0.4 μmol/L 时,荧光信号最强,荧光扩增效率最高,因此将其确定为最佳工作浓度;当反转录时间为5 min 时,荧光扩增效率较低,Ct 值略高,10 min和15 min 的荧光扩增效率基本一致,Ct 值无显著差异,从节约时间上考虑,选择反转录时间为10 min;当退火温度为60 ℃,退火时间为30 s 时,荧光扩增效率最高。因此,确定本研究建立的实时荧光RT-PCR 检测方法的最佳反应体系:2×One Step RT-PCR Buffer II 12.5 μL,TaKaRa ExTaqHS(5 U/μL)0.5 μL,PrimeScript RT Enzyme Mix II 0.5 μL,上下游引物(10 μmol/L)各0.5 μL,探针(10 μmol/L)1.0 μL,RNA 5.0 μL,最后用RNase Free ddH2O 补足至25.0 μL。反应条件:50 ℃ 10 min;95 ℃ 30 s;95 ℃ 15 s,60℃ 30 s,40 个循环。
2.2 标准曲线绘制
以拷贝数浓度为1.3×103~1.3×107copies/μL的阳性重组质粒为模板进行实时荧光RT-PCR 扩增,每个梯度重复3 次。结果(图1)显示,在该拷贝数浓度范围内,拷贝数对数值(x轴)与Ct 值(y轴)呈良好的线性关系,线性方程为y=-3.039x+27.464,R2=0.994。
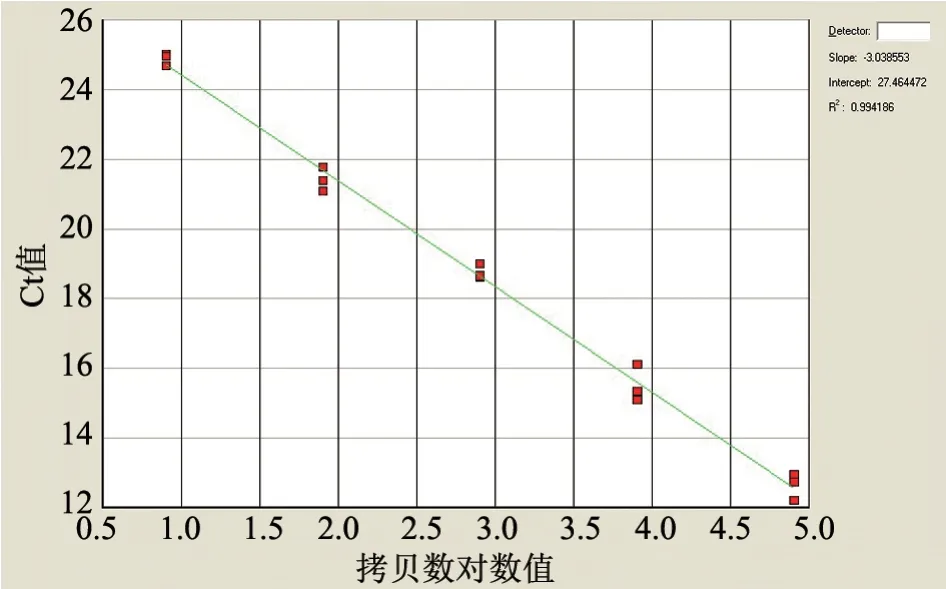
图1 标准曲线
2.3 特异性试验
分别以PEDV、TGEV、RV、PTV、PKV、大肠杆菌核酸及PDCoV 阳性重组质粒为模板,用本研究建立的实时荧光RT-PCR 检测方法进行扩增,验证方法的特异性。结果(图2)显示,仅PDCoV 出现特异性扩增曲线,而其他样品均未出现特异性扩增曲线,表明该方法的特异性良好。
2.4 灵敏性试验
用拷贝数浓度为1.3×100~1.3×106copies/μL的标准质粒进行实时荧光RT-PCR 扩增。结果(图3)显示,本方法的最低检出限为13 copies/μL。
2.5 重复性试验
结果(表2)显示,该方法的批内CV 为0.24%~0.76%,批间CV 为0.57%~ 2.15%,批内、批间变异系数均小于3%,表明本方法具有较好的重复性。
2.6 临床样品检测
利用本研究建立的实时荧光RT-PCR 检测方法对42份粪便样品进行检测,结果检出5份阳性样品,阳性率为11.9%(5/42),而使用普通RT-PCR 方法检测上述样品,有3 份为阳性(图4),阳性率为7.1%(3/42),二者的符合率为95.2%。
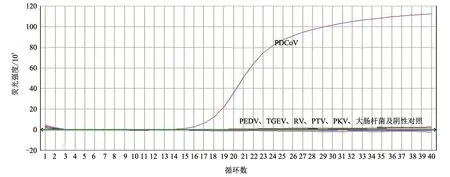
图2 特异性试验结果
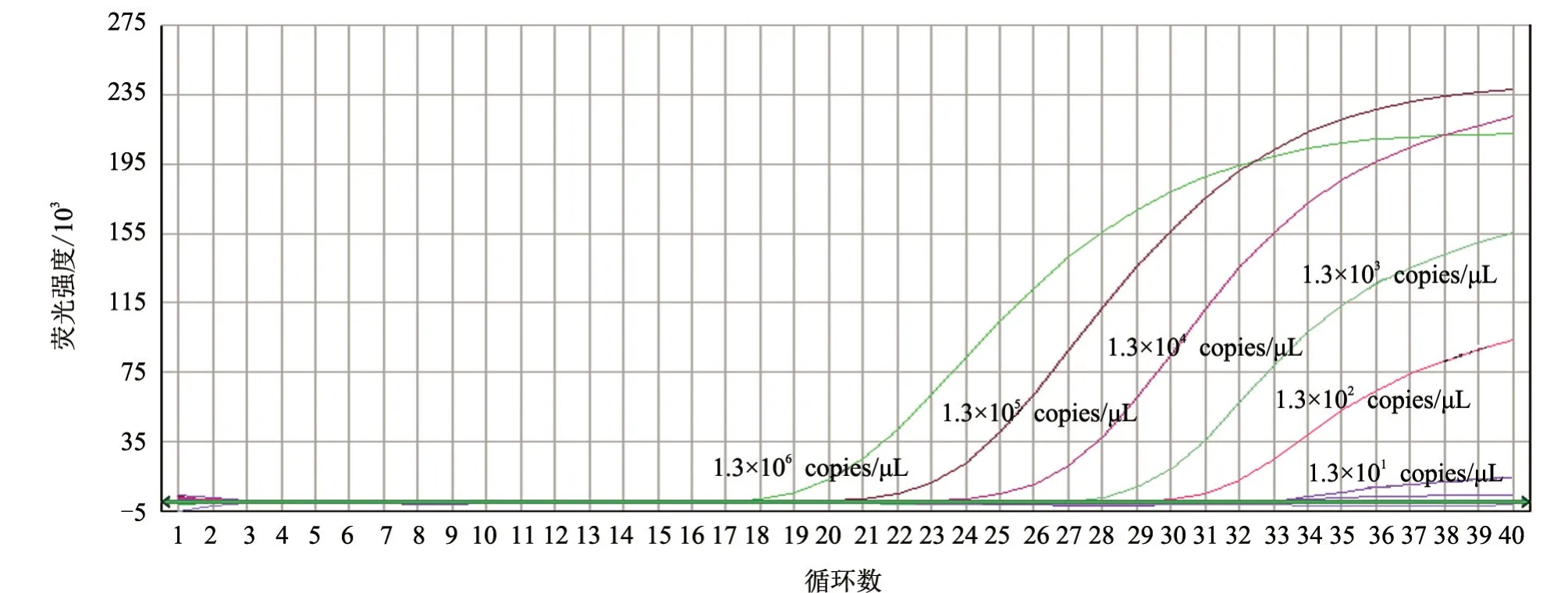
图3 灵敏性试验结果

表2 重复性试验结果

图4 普通RT-PCR 检测阳性结果
3 讨论
PDCoV 是引发猪腹泻的重要病原之一,可引起猪较高的发病率和死亡率,严重威胁我国生猪养殖业的健康发展。PDCoV 引发的腹泻症状与PEDV、TGEV 等猪肠道病原相似,均以呕吐、水样腹泻、脱水和食欲下降为主要特征,且各年龄段猪群均易感,其中新生仔猪的感染率和发病率较高,感染后死亡率为30%~40%。国内外多项研究[7,18-19]表明,检测样品中有20%~50%为PDCoV 和PEDV 双阳性,呈现共感染特征。目前国内的流行病学调查结果[7]显示,PDCoV 与PEDV 普遍共存于腹泻猪群中,给猪腹泻病的防控增加了难度。
目前,PDCoV 防控尚无商品化疫苗可用,在感染早期及时作出准确诊断至关重要。而传统的病毒检测方法,如病毒分离鉴定、普通PCR、ELISA等,存在操作复杂、费时费力、灵敏度低、特异性不强、试验周期长等不足。荧光定量PCR 因具有优异的灵敏度和特异性且快速简便而被广泛用于多种疫病的临床诊断中。由于TaqMan 探针法不受非特异性扩增及引物二聚体的影响,在特异性和准确性方面远远优于染料法,本研究根据NCBI 上已公布的PDCoV的M基因保守区域设计特异性引物和探针,通过对PCR 反应体系和条件进行优化和验证,成功建立了PDCoVTaqMan 实时荧光RT-PCR检测方法。
本研究建立的方法在1.3×103~1.3×107copies/μL拷贝数浓度范围内,拷贝数对数值与Ct 值呈良好的线性关系,R2=0.994;最低检出限为13 copies/μL,较文献[20-21] 报道的SYBR Green I 染料法和TaqMan 探针法更灵敏;利用该方法检测PEDV、TGEV、RV、PTV、PKV 和大肠杆菌等病原核酸,均无扩增曲线,表明本方法特异性良好。利用本研究建立的实时荧光RT-PCR 方法与普通RT-PCR同时检测临床样品,两种方法的符合率为95.2%,且实时荧光RT-PCR 阳性率(11.9%)高于普通RT-PCR(7.1%)。综上所述,本研究建立了一种灵敏、特异、可靠的PDCoV 实时荧光RT-PCR 检测方法,能够满足临床诊断和流行病学调查需求,为该病的有效防控提供了技术支持。

