高敏荧光免疫层析分析法检测牛分枝杆菌抗体
张家瑞,屈勇刚,樊晓旭,张力,剡文亮,孙淑芳,李敏,岳建国,李岩
(1.新疆生产建设兵团畜牧兽医工作总站,新疆乌鲁木齐 830021;2.石河子大学动物科技学院,新疆石河子 832003;3.中国动物卫生与流行病学中心,山东青岛 266032;4.成都市动物疫病预防控制中心,四川成都 610041)
牛结核病(bovine tuberculosis,bTB)是由牛分枝杆菌(Mycobacterium bovis,M.bovis)引起的一种慢性消耗性人兽共患病,可在人类、家畜及野生动物之间传播。奶牛是最易受到M.bovis感染的动物之一。规模化奶牛场是鲜乳生产的主要阵地,因此防控、净化bTB 意义重大[1]。目前,我国采用结核菌素皮内变态反应(tuberculin skin test,TST)作为bTB 检疫的标准方法,但该方法存在假阳性率较高的问题,以致对检疫阳性牛的处置难以抉择[2]。
随着人们对bTB 体液免疫机制研究的不断深入,研究人员开发了基于ESAT-6、MPB59、MPB64、MPB70、MPB83、CFP10、α-crystallin-2、Rv3616c、Acr1、PstS-1 等鉴别诊断抗原的血清学检测方法[3-7],提高了血清学诊断的灵敏性和特异性。近年来,在镧系荧光纳米微球技术的基础上,荧光免疫层析技术取得了飞速发展,开始广泛应用于病原检测和抗体水平检测。本研究测试了高敏荧光免疫层析法的特异性、灵敏性和重复性,并评价了临床检测M.bovis抗体的可行性,以期为bTB 检疫、控制及净化提供技术支持。
1 材料与方法
1.1 材料
1.1.1 样品来源M.bovis抗体强阳性血清参考品、M.bovis抗体阳性血清参考品,由中国动物卫生与流行病学中心提供;O 型口蹄疫抗体阳性血清、A 型口蹄疫抗体阳性血清、布鲁氏菌抗体阳性血清、bTB TST 阳性淘汰牛血清样品、bTB TST 抗体阴性血清样品,由新疆生产建设兵团畜牧兽医工作总站提供。
1.1.2 主要试剂与仪器 结核菌素提纯蛋白衍化物(PPD,批号:201702),购自哈药集团生物疫苗有限公司;M.bovisELISA 抗体检测试剂盒(批号:CS795),购自爱德士生物科技有限公司;M.bovis高敏荧光免疫层析检测卡(批号:TBB22011112473)、Wellray@ WR-1608 荧光检测仪,购自成都微瑞生物科技有限公司;Multiskan FC 型酶标仪,购自赛默飞世尔(上海)仪器有限公司。
1.2 方法
1.2.1 分析特异性试验 分别用样品稀释液以1:50 体积比稀释M.bovis抗体阳性血清参考品、O 型口蹄疫抗体阳性血清、A 型口蹄疫抗体阳性血清和布鲁氏菌抗体阳性血清。吸取80 μL 上述稀释血清分别加入M.bovis高敏荧光免疫层析检测卡孔中,并用稀释液作为空白对照,反应15 min 后,用荧光检测仪读取抗体效价。结果判定标准见表1。
1.2.2 诊断特异性试验 分别用样品稀释液以1:50 体积比稀释15 份bTB TST 抗体阴性血清。用移液器各吸取80 μL 加入对应编号的M.bovis高敏荧光免疫层析检测卡孔中,反应15 min 后,用荧光检测仪读取抗体效价。
1.2.3 灵敏性试验 用样品稀释液分别以1:200、1:400、1:800、1:1 600、1:3 200、1:6 400、1:12 800体积比稀释M.bovis抗体强阳性血清参考品。用移液器各吸取80 μL 加入M.bovis高敏荧光免疫层析检测卡孔中,反应15 min 后,用荧光检测仪读取抗体效价并绘制标准曲线。
1.2.4 稳定性试验 分别用样品稀释液以1:50体积比稀释M.bovis抗体强阳性血清和M.bovis抗体阳性血清。用移液器各吸取80 μL 加入M.bovis高敏荧光免疫层析检测卡孔中,反应15 min 后,用荧光检测仪读取抗体效价;重复试验6 次,应用Excel 软件计算变异系数。
1.2.5 临床样品检测 临床采集30 份bTB TST阳性淘汰牛血清样品。分别用样品稀释液以1:50体积比稀释上述待检血清;用移液器各吸取80 μL加入M.bovis高敏荧光免疫层析检测卡孔中,反应15 min 后,用荧光检测仪读取抗体效价;同时采用IDEXXM.bovisELISA 抗体检测试剂盒对样品进行抗体检测。结果判定标准见表1。应用Excel、SPSS 20.0 软件对2 种方法的检测结果进行一致性检验和卡方检验。

表1 结果判定标准
2 结果
2.1 分析特异性试验
采用M.bovis高敏荧光免疫层析检测卡检测不同阳性血清。结果(表2)显示,只有M.bovis抗体阳性血清参考品为阳性,O 型口蹄疫阳性血清、A 型口蹄疫阳性血清、布鲁氏菌抗体阳性血清和样品稀释液均为阴性。

表2 高敏荧光免疫层析分析法分析特异性试验结果
2.2 诊断特异性试验
采用M.bovis高敏荧光免疫层析检测卡检测15 份bTB TST 抗体阴性血清(宿主IFN-γ 体外释放试验结果也均为阴性),结果阴性率为100%(15/15)。
2.3 灵敏性试验
结果(表3)显示,在1:100、1:200、1:400、1:800、1:1 600、1:3 200 稀释比例下,M.bovis抗体强阳性血清参考品检测结果均为阳性,在1:6 400、1:12 800 稀释比例下,检测结果均为阴性。标准曲线(图1)显示,线性方程为y=-1.162 7x+5.438 2,R2=0.987 2,说明样品抗体效价与样品稀释倍数具有良好的线性关系。
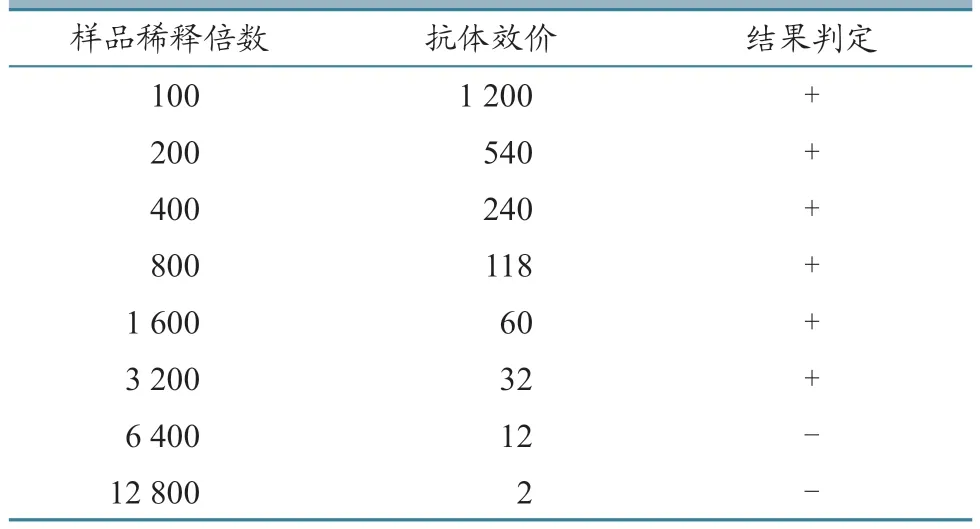
表3 高敏荧光免疫层析分析法灵敏性试验结果
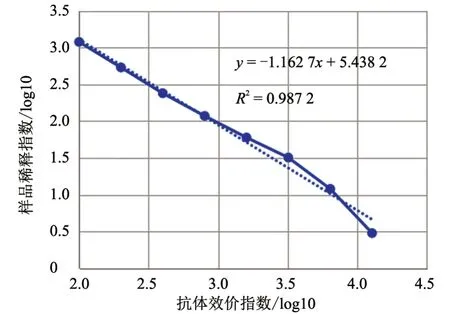
图1 标准曲线
2.4 稳定性试验
采用M.bovis高敏荧光免疫层析检测卡分别检测1:50 稀释的M.bovis抗体强阳性血清和M.bovis抗体阳性血清,结果均为阳性,变异系数(CV)分别为5.48%和5.83%(表4),说明高敏荧光免疫层析法检测结果离散度小,稳定性可满足试验要求。
2.5 临床样品检测
30 份临床bTB TST 阳性淘汰牛血清样品检测结果(表5)显示,高敏荧光免疫层析分析法检测阳性率为66.67%(20/30),IDEXXM.bovisELISA 抗体检测试剂盒阳性率为73.33%(22/30),两者的阳性符合率为86.36%(19/22),说明2 种方法具有较高的一致性(Kappa=0.684)且差异性不显著(P=0.573,P>0.05)。
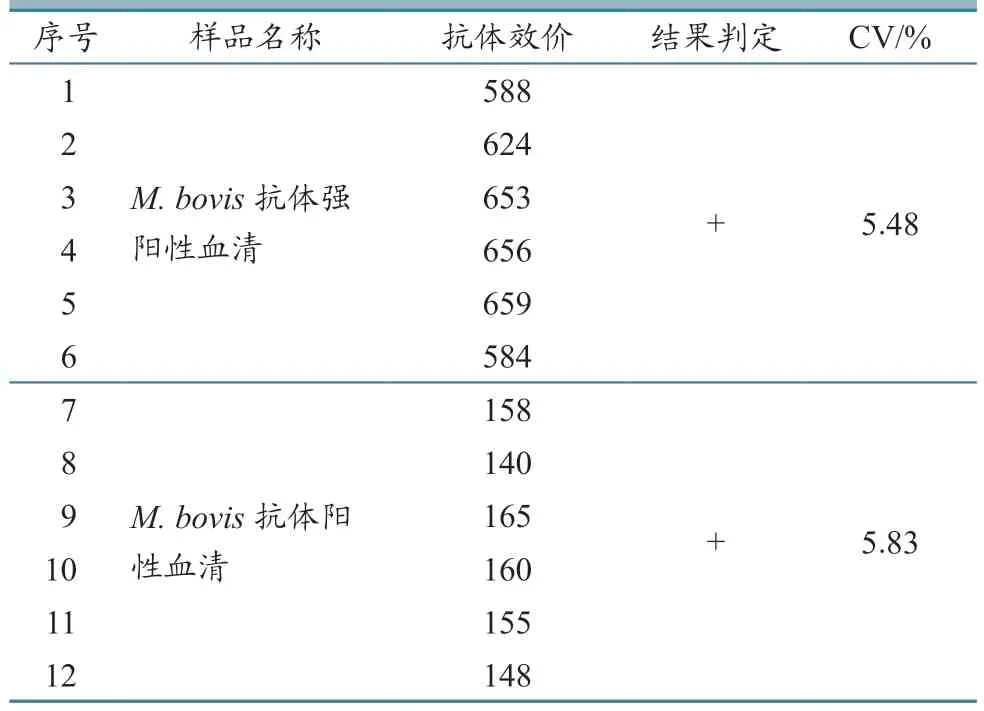
表4 高敏荧光免疫层析分析法稳定性试验结果
3 讨论
bTB 复杂的发病机制须依赖适当的诊断方法以保证检出准确率[10]。基于迟发性变态反应的TST 适合奶牛场bTB 普检,也是世界动物卫生组织(WOAH)推荐的检疫方法,但是单独进行TST 试验,其特异性会受到PPD 纯度、效价、剂量以及环境分枝杆菌对动物致敏作用的影响[11],时常出现检疫结果与病原学检测或病理学检测结果不一致的情况,导致检疫人员和养殖企业无法准确了解牛群的真实bTB 流行情况,难以对检疫阳性牛作出正确的处置,严重制约了bTB 的防控和净化进度[12]。
21 世纪以来,血清学检测技术在动物结核病诊断中的应用逐渐增多。在血清学诊断技术中,ELISA 技术应用最广泛,同时侧向层析检测、多抗原打印免疫分析及多重化学发光分析等新型动物结核病血清学诊断方法也在陆续开发中。影响这些技术应用于bTB 诊断的关键是方法的灵敏性和特异性。研究[13]发现,使用特异性抗原组合,如MPB83、MPB70、ESAT-6 和CFP-10,可提高血清学试验的灵敏性和特异性;Lyashchenko等[8]研究发现,感染M.bovis动物的ELISA 抗体在TST 后2~8 周会显著升高,这一发现可提高血清学检测的灵敏性,也说明抗体滴度的增强效应可成为一种有价值的诊断策略;王佃鹏等[9]发现,应用免疫层析法和荧光PCR 相结合的实验室诊断模式有助于肺结核的快速诊断和传染风险性评估。以上研究为血清抗体检测应用于bTB 诊断奠定了基础。WOAH 已经评估了一些用于牛血清和血浆检测的血清学诊断方法,并对其中两个试剂盒进行了注册登记(其中包括IDEXXM.bovisELISA 抗体检测试剂盒)[14]。
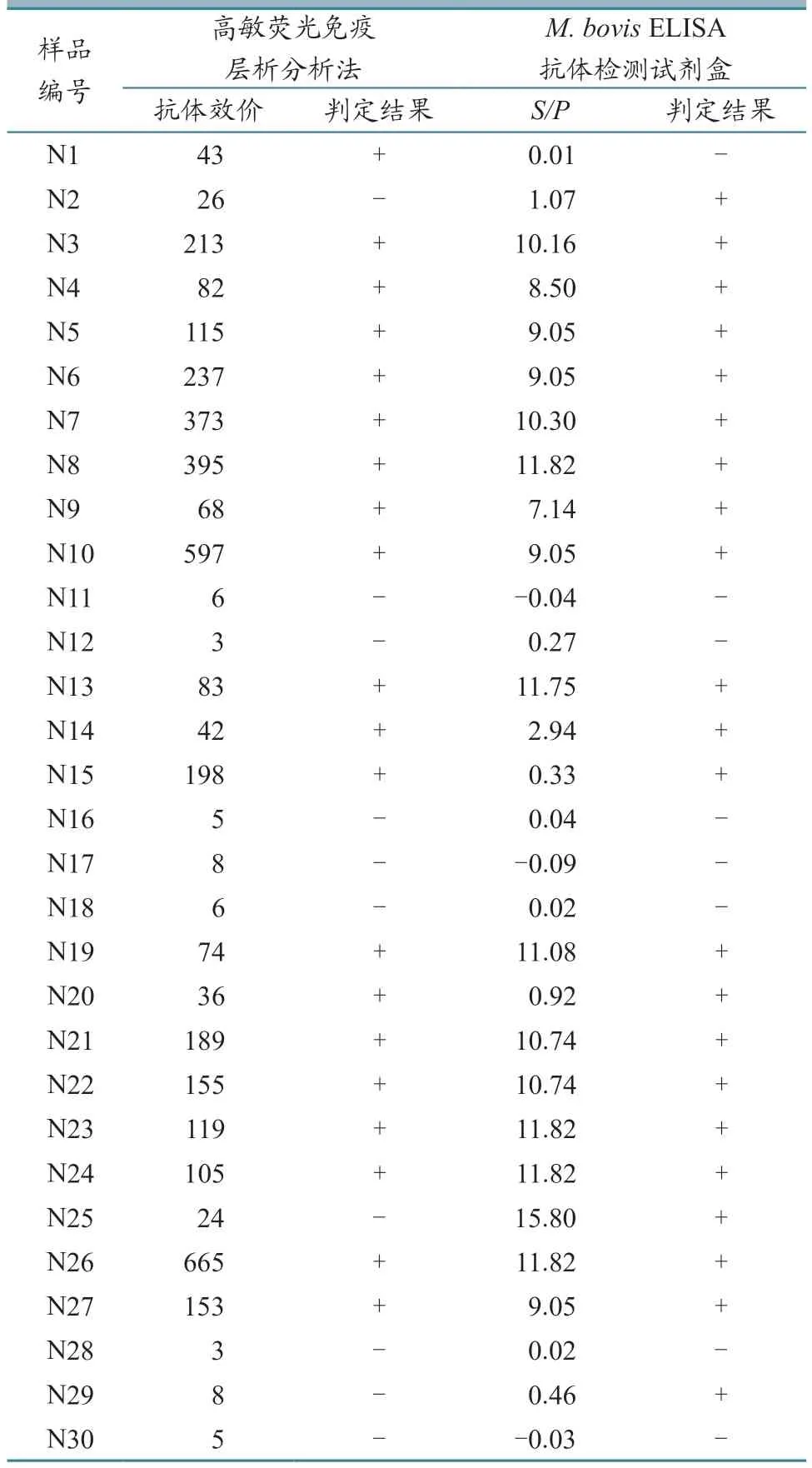
表5 临床样品检测结果
本研究所使用的高敏荧光免疫层析检测卡包被了MPB70、ESAT-6 和CFP-10 等特异性抗原。试验结果显示,该方法能够检出M.bovis抗体阳性血清参考品,而对O 型口蹄疫阳性血清、A 型口蹄疫阳性血清、布鲁氏菌阳性血清、样品稀释液和bTB TST 抗体阴性血清等均为阴性,具有较强的特异性;在3 200 倍稀释的情况下依然可以检出阳性血清,具有较高的灵敏度;检测1:50 稀释的bTB 强阳性血清和阳性血清的CV 分别为5.48%和5.83%,说明检测结果离散度小,稳定性可满足试验要求;在采集的临床样品检测试验中,高敏荧光免疫层析分析法与IDEXXM.bovisELISA 抗体检测试剂盒的阳性符合率为86.36%,具有较高的一致性且差异不显著,可用于生产中M.bovis抗体的检测。
4 结论
高敏荧光免疫层析分析法特异性强、灵敏度高、稳定性好,结果可靠,且操作简便、试验时间短,不易受人为因素干扰,可作为TST 方法的补充和辅助检测手段,用于bTB 的检疫、控制及净化。

