胰高血糖素样肽1受体在子宫内膜癌中的表达及意义研究
李武 刘松君 阮凡 吕雯
子宫内膜癌(endometrial cancer,EC)是继卵巢癌之后第二常见的妇科恶性肿瘤。近年来,EC不仅全球发病率有所上升,而且患者的发病年龄也逐渐年轻化。EC的进展是一个复杂的过程,涉及多个因素和步骤。雌激素长期刺激子宫内膜和(或)缺乏孕激素拮抗作用被认为是导致子宫内膜增生和发生癌变的主要因素。此外,还有多种诱发EC的危险因素,如高血压、肥胖和糖尿病。临床上,EC的治疗仍以手术结合辅助治疗(如化疗、内分泌治疗)为主,然而多年来患者总体生存率并没有显著提高。此外,晚期或复发EC患者由于出现化学药物抵抗,临床预后不良。因此,探讨EC的发病机制,阐明EC细胞在恶变过程中的生物学行为具有重要意义。为EC的分子生物学诊断、靶向治疗和预后监测寻找新的、有效的特异性生物标志物,是当前研究热点[1-3]。由胰高血糖素样肽1受体(glucagon-like peptide 1 receptor,GLP1R)基因编码的七跨膜蛋白—GLP1R蛋白可以刺激胰岛素分泌[4]。研究发现,GLP1R基因的多态性与糖尿病相关[5],GLP1R蛋白参与能量代谢、G蛋白偶联受体通路等[6-7]。有学者发现,GLP1R表达上调可抑制前列腺癌发生、发展[8]。基于此,本研究分析GLP1R在EC组织、细胞中的表达情况,并探讨GLP1R对EC细胞活力的影响,现报道如下。
1 材料和方法
1.1 组织标本和细胞 选取2019年至2020年在浙江省立同德医院行手术治疗的EC患者5例,收集其手术切除标本中的病变子宫内膜组织和配对的正常子宫内膜组织。患者均为初次治疗、术前未接受过内分泌治疗且无其他肿瘤病史。本研究经医院医学伦理委员会批准(批件号:2019038),患者知情同意并签署知情同意书。5种人EC细胞系分别为HEC-1A(武汉普诺赛生命科技有限公司)、RL95-2(上海中科院细胞库)、KLE(武汉普诺赛生命科技有限公司)、Ishikawa(南京科佰生命科技有限公司)和AN3CA(武汉普诺赛生命科技有限公司)。
1.2 方法
1.2.1 EC细胞培养 5种EC细胞均培养于含10%FBS、100 U/ml青霉素和 100 U/ml链霉素的DMEM培养基(北京Hyclone公司,批号:SH30243.01B)中,置于37℃、5%CO2饱和湿度环境中培养。
1.2.2 EC组织或细胞GLP1R mRNA表达水平检测采用RT-qPCR法。将组织或细胞均质破碎,然后加至1 ml Trizol试剂(美国Invitrogen公司,批号:3180310)中裂解5 min,离心后去除上清液。紫外分光光度计测定 1 μl RNA 的 OD260和 OD280,计算 RNA 纯度和浓度。在由 1 μl primescript酶混合物、1 μl RTprimer混合物、4 μl 5× primescript缓冲液、2.7631 μg RNA 和 Rnase free H2O组成的逆转录系统中,将RNA逆转录成cDNA。逆转录反应程序如下:37℃15 min;85℃5 s;4℃保持。采用RT-qPCR法检测1 μl正向引物、1 μl反向引物、10 μl 2×混合物、7 μl H2O和1 μl cDNA 反应系统中的mRNA表达水平。RT-qPCR程序如下:95℃10 min 1个循环;40个循环(95℃10 s,60℃15 s,72℃20 s),65℃~95℃0.5℃/5 s 1个循环。引物序列如下:GLP1R正向5'-TCGCTGTGAAAATGAGGAGG-3',反向 5'-TTGGCTGAGGTTAGAAGAGCC-3';GAPDH正向 5'-TCAAGAAGGTGGTGAAGCAGG-3',反向 5'-TCAAAGGTGGAGGAGTGGGT-3'。GLP1R mRNA 表达水平采用 2-ΔΔCt法定量。
1.2.3 EC组织或细胞GLP1R蛋白表达水平检测 采用Western blot法。裂解后的组织或细胞于4℃14 000 r/min离心15 min,收集上清液。根据裂解液的体积加入5×SDS上样缓冲液,100℃煮沸5 min。然后,样品通过10%SDS-PAGE电泳分离并转移到PVDF膜上。取出PVDF膜,用5%牛奶/TBST室温密封1 h。该膜与针对GLP1R(武汉Proteintech公司)和GAPDH(武汉AtaGenix公司)的一抗在4℃下孵育过夜。PVDF膜与辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔二抗(武汉Proteintech公司)一起孵育,室温下用5%牛奶/PBST稀释1 h。PVDF膜暴露于发光试剂2 min。用凝胶成像系统观察蛋白质条带。
1.2.4 EC组织GLP1R蛋白表达定性检测 采用免疫组化法。EC组织和正常组织石蜡包埋切片,用水脱石蜡。抗原修复后,将切片置于3%过氧化氢溶液中,室温孵育25 min,避光。洗涤后,切片用3%牛血清白蛋白(albumin from bovine serum,BSA)(北京 Solarbio公司)室温封闭30 min。切片中加入一定比例的一抗的PBS(美国Life公司),4℃孵育过夜。将载玻片置于PBS中并在脱色振荡器上振荡洗涤3次,5 min/次。将切片与HRP标记的二抗(武汉Proteintech公司)在室温下孵育50 min。DAB(美国DAKO公司)显影后,切片用HE染色液复染3 min。切片用1%盐酸乙醇分化20 s,氨水变蓝。切片脱水并用中性树胶封片,获取并分析图像。
1.2.5 细胞转染 吸出原始培养基后,将AN3CA细胞加入PBS并用胰蛋白酶消化2 min。使用移液管制备单个细胞。20 μl细胞悬液加入20 μl台盼蓝试剂计数。剩余的细胞悬液以1 000 r/min离心5 min,将细胞重新悬浮在培养基中。然后,将细胞悬液接种到6孔板(3×105个细胞/孔)中并培养过夜。1.5 μl 20 μmol/L 3种靶向GLP1R的小干扰RNA(small interfering RNA,siRNA)通过 100 μl opti-MEM 孵育 5 min。将 7.5 μl Lipofectamine RNAMAX试剂(美国Thermo Fisher公司,批号:CN2515133)添加到opti-MEM中并孵育5 min。siRNA混合物通过Lipofectamine混合物孵育5 min。此外,AN3CA细胞用100 nmol/L胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)类似物exendin-4处理。采用RT-qPCR法检测AN3CA细胞GLP1R mRNA表达水平,具体方法同1.2.2。
1.2.6 转染后细胞活力检测 采用CCK-8检测试剂盒(日本Dojindo公司批号:GX735)检测细胞活力。将100 μl细胞悬液加入96孔培养板(4 500个细胞/孔)中,在 37 ℃、5%CO2培养箱中培养。在 0、24、36、48和72 h检测细胞存活率,具体为每孔加入10 μl CCK-8溶液,孵育3 h,加入终止液后用微孔板检测器检测OD450。
1.3 统计学处理 采用GraphPad Prism 8.0统计软件。每个实验重复3次。计量资料两组比较采用两独立样本t检验,多组比较采用单因素方法分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 EC组织与正常子宫内膜组织GLP1R mRNA、蛋白表达水平比较 EC组织GLP1R mRNA、蛋白表达水平均高于正常子宫内膜组织(均P<0.05)。免疫组化检测显示,GLP1R蛋白主要在肿瘤细胞膜上表达。即EC组织中GLP1R表达上调,见图1(插页)。
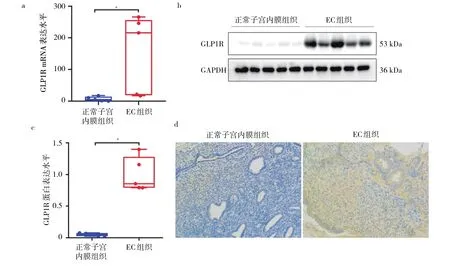
图1 EC组织与正常子宫内膜组织GLP1R mRNA、蛋白表达水平比较(a:mRNA表达水平比较;b:蛋白表达电泳图比较;c:蛋白表达水平比较;d:蛋白表达镜下所见比较,免疫组化染色,×100)
2.2 不同EC细胞GLP1R mRNA、蛋白表达水平比较 5种EC细胞(HEC-1A、RL95-2、KLE、Ishikawa和AN3CA)中,AN3CA细胞GLP1R mRNA、蛋白表达水平高于其他4种细胞(均P<0.05)。因此,本研究选择AN3CA细胞进行细胞转染。转染siRNA的AN3CA细胞GLP1R mRNA表达水平均低于未转染的AN3CA细胞(对照组)(均P<0.05),且转染siRNA-1的 AN3CA细胞表达水平最低(均P<0.05);为激活GLP1R表达,AN3CA细胞用GLP-1类似物exendin-4处理,处理后,AN3CA细胞GLP1R mRNA表达水平明显高于对照组细胞(P<0.05)。见图2。
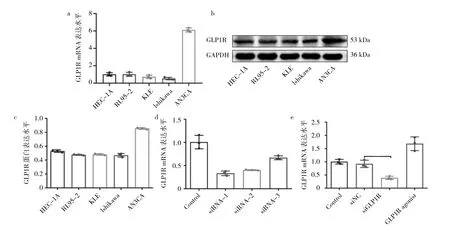
图2 不同EC细胞GLP1R mRNA、蛋白表达水平比较(a:5种EC细胞GLP1R mRNA表达水平比较;b:5种EC细胞GLP1R蛋白表达电泳图比较;c:5种EC细胞GLP1R蛋白表达水平比较;d:转染不同siRNA的AN3CA细胞GLP1R mRNA表达水平比较;e:转染siRNA后的AN3CA细胞与exendin-4处理的AN3CA细胞GLP1R mRNA表达水平比较)
2.3 转染siRNA后的AN3CA细胞与exendin-4处理的AN3CA细胞活力比较 在0 h,转染siRNA后的与或exendin-4处理的AN3CA细胞存活率比较差异无统计学意义(P>0.05)。在 24 h,exendin-4处理的AN3CA细胞存活率高于对照组细胞(P<0.05)。在36 h,转染siRNA后的AN3CA细胞存活率低于转染siNC(阴性对照)的AN3CA 细胞(P<0.05)。在48、72 h,exendin-4处理的AN3CA细胞存活率高于对照组(均P<0.05),转染siRNA后的AN3CA细胞存活率低于转染siNC(阴性对照)的AN3CA细胞(均P<0.05),即GLP-1类似物提高了AN3CA细胞的存活率,敲低GLP1R基因表达对细胞活力起抑制作用。见图3。
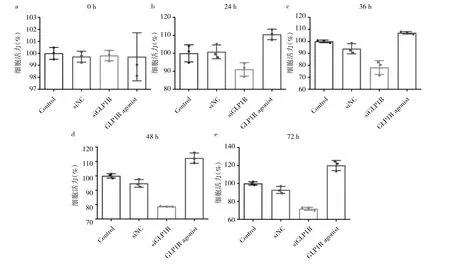
图3 转染siRNA后的AN3CA细胞与exendin-4处理的AN3CA细胞活力比较(a:0 h时细胞活力比较;b:24 h时细胞活力比较;c:36 h时细胞活力比较;d:48 h时细胞活力比较;e:72 h时细胞活力比较)
3 讨论
目前,EC的发病机制尚不明确。探讨EC的临床创新治疗策略有重要意义[9]。本研究结果显示EC组织中GLP1R表达上调,对EC发挥致癌作用。敲低GLP1R基因表达对细胞活力起抑制作用。相反,GLP1R表达上调促进EC细胞活力。这说明,GLP1R对EC的发生、发展起促进作用。
本研究发现EC组织中GLP1R表达上调,提示GLP1R对EC具有致癌作用。现有研究已在前列腺癌、乳腺癌等中发现GLP1R过表达[10-11]。GLP1R主要分布在EC细胞的细胞膜上[12]。本研究进一步分析了GLP1R在AN3CA细胞中的生物学功能。持续增殖是EC细胞的特征。GLP1R表达上调的促增殖和GLP1R表达下调的抗增殖都可以诱导不受控制的细胞增殖并呈现无限增殖。沉默GLP1R延缓了AN3CA细胞的细胞增殖能力。相反,GLP-1类似物exendin-4会促进AN3CA细胞增殖。前期研究发现,GLP1R激活降低了前列腺癌细胞和卵巢癌细胞的增殖能力[13-14]。细胞周期变化是影响肿瘤进展的关键因素。细胞周期停滞导致细胞周期延长,肿瘤细胞增殖势必受到影响。已有研究显示,exendin-4提高了卵巢癌、结肠癌和胰腺癌细胞的细胞凋亡[14-16]。本研究结果显示,敲低GLP1R基因表达显著增加了AN3CA细胞的凋亡水平,而exendin-4降低了AN3CA细胞的凋亡水平。
EC的侵袭增加了肿瘤进展和患者死亡的风险。肿瘤转移也导致EC的高死亡率[17-18]。一些患者在确诊时已经转移,临床上Ⅲ期或Ⅳ期EC患者约占30%[19-20]。EC的转移需要一系列复杂过程。首先,由于细胞间的黏附力减弱,肿瘤细胞从原位脱落,获得迁移和侵袭能力,局部浸润,从而侵犯血管和淋巴管,发生远处转移[21]。脱落的肿瘤细胞在新环境中继发生长。Nie等[22]报道,exendin-4通过GLP1R/sirt3途径抑制神经胶质瘤细胞迁移以及侵袭性表型。此外,Luciani等[23]发现exendin-4诱导神经母细胞瘤细胞的侵袭潜力。Cases等[24]强调了GLP1R对胰腺导管腺癌细胞迁移和侵袭的辅助作用。因此,有必要探讨EC的侵袭和转移机制,从而制定抗肿瘤转移策略,延长患者的生存时间[25-27]。
综上所述,EC组织和细胞中GLP1R表达上调,其表达上调促进EC细胞增殖,加速EC的进展。GLP1R可能在EC细胞中发挥致癌基因功能。GLP1R或可成为EC的生物标志物和治疗EC的生物靶点。

