miR-16-5p通过调控PD-L1表达影响肝星状细胞炎症反应的研究
詹东昂 柯峰 杨超 刘华
肝纤维化是对一系列慢性肝损伤的愈合反应,主要特征为细胞外基质(extracellular matrix,ECM)过度沉积并最后发展为肝硬化[1]。肝星状细胞被激活后增殖,大量分泌ECM导致肝纤维化发生[2]。miRNA为小分子非编码RNA,长度约21~25个碱基,广泛参与调控细胞的增殖、凋亡及机体炎症反应等多种生命活动[3-5]。相关研究报道miRNA参与调节肝纤维化的发生,如马艳华等[6]研究表明健康人与肝纤维化患者的血浆样本中存在104个差异miRNA,其中72个表达下调,包括miR-450b-5p、miR-455-5p等,32个miRNA表达上调,包括miR-16-5p、miR-182-5p等;冉龙娇等[7]也发现在肝星状细胞的活化及肝纤维化过程中,均有多种miRNA出现差异表达,或上调或下调。通过靶基因预测在线分析发现,miR-16-5p可能与程序性死亡受体-1(programmed cell death-1,PD-1)存在结合位点,PD-1及其配体PD-L1(CD274)属于负共刺激分子,主要参与调控多种肿瘤及自身免疫性疾病的免疫逃逸过程,抑制免疫应答的激活,目前作为肿瘤等治疗的重要免疫检查点[8]。相关研究表明,抑制PD-1/PD-L1表达与治疗自身免疫性肝炎密切相关[9]。因此推测miR-16-5p可能介导PD-L1表达参与调控活化的肝星状细胞及炎症反应。本实验以大鼠肝星状细胞HSC-T6为研究对象,探讨miR-16-5p是否参与调控PD-L1表达而影响肝星状细胞生理形态及炎症水平,以期为临床上治疗肝纤维化及炎症提供可能的治疗靶点,现报道如下。
1 材料和方法
1.1 主要材料 肝星状细胞HSC-T6(武汉普诺赛生命科技有限公司);DMEM培养基(美国Hyclone公司,批号:SH30022.01B);FBS(美国 Gibco公司,批号:10270-106);PBS(批号:P1010)、胰蛋白酶(批号:T1350)和浓度测定试剂盒(批号:PC0020)均来自北京索莱宝科技有限公司;Trizol试剂(美国Ambion公司,批 号 :15596026);转 化 生 长 因 子 β1(transforming growth factor-β1,TGF-β1,英国Abcam公司);CCK-8试剂盒(中国Solarbio公司,批号:CA1210);蛋白质Marker(美国Helix公司,批号:P12103);PVDF转移膜和化学发光试剂(中国Millipore公司,批号:IPVH00010);鼠抗细胞PD-L1抗体、兔抗NF-κB抗体、兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体 、羊抗兔IgG和羊抗鼠IgG(中国Bioswamp公司);兔抗磷酸化的NF-κB(nuclear factor kappa B,p-NF-κB)抗体(中国CST公司)。
1.2 方法
1.2.1 细胞培养、分组及处理 HSC-T6细胞培养于含10%FBS的DMEM培养基中,于37℃、5%CO2培养箱内培养,均按照1∶2~1∶4进行传代。将细胞分为6组并分别处理:对照组、模型组(5 ng/ml TGF-β1处理48 h)、miR-16-5p超表达组(转染miR-16-5p mimics 24 h后,再用 5 ng/ml TGF-β1处理48 h)、miR-16-5p抑制组(转染miR-16-5p inhibitor 24 h后,再用5 ng/ml TGF-β1处理48 h)、超表达-空载组(转染mimics-NC 24 h后,再用5 ng/ml TGF-β1处理48 h)和抑制-空载组(转染inhibitor-NC 24 h后,再用5 ng/ml TGF-β1处理48 h)。
1.2.2 细胞转染 将 100 pmol miRNA、5 μl Lipofectamine 2000分别稀释于250 μl Opti-MEM中,混匀后,将两者混合液室温孵育20 min,然后将其加入到融合度为90%的细胞中,37℃、5%CO2转染4 h后,更换新鲜培养基,培养24 h,测定miR-16-5p的表达水平以观察转染效果。
1.2.3 各组细胞 TNF-α、IFN-γ、miR-16-5p、PD-L1、IL-6、IL-10 mRNA表达水平检测 采用RT-qPCR法。加入TGF-β1处理48 h收集细胞,用Trizol法提取各组细胞总RNA,将mRNA反转录成cDNA。以cDNA为模板进行qPCR扩增。反应条件为:95℃预变性3 min,95 ℃变性5 s,56 ℃退火10 s,72 ℃延伸25 s,共40个循环,其中GAPDH和U6作为内参进行样品间的校正,使用2-ΔΔCt法进行统计分析。引物序列见表1。

表1 引物序列
1.2.4 各组细胞形态学观察 收集各组细胞,稀释细胞悬液浓度至1×105个细胞/孔,每孔2 ml,37℃、5%CO2培养箱中培养过夜,使细胞贴壁。对照组于正常培养基中培养,模型组、miR-16-5p超表达组、miR-16-5p抑制组、超表达-空载组和抑制-空载组的细胞培养基中加入终浓度为5 ng/ml的TGF-β1,继续培养24、48、72或48 h。取出细胞培养板,光镜下观察各组细胞形态,拍照、收样。
1.2.5 各组细胞增殖能力检测 采用CCK-8法。将细胞浓度稀释为3×103个细胞/孔,取100 μl细胞液接种到96孔板,37℃、5%CO2培养箱中培养过夜,使细胞贴壁。对照组于正常培养基中培养,另外5组细胞培养基中加入终浓度为5 ng/ml的TGF-β1刺激48 h,然后均加入10 μl CCK-8溶液,继续培养4 h。酶联免疫检测仪测量各孔450 nm处的吸光值,以吸光值表示细胞增殖能力。同时设置调零孔(培养基、CCK-8溶液),每组设定3个复孔。
1.2.6 各组细胞PD-L1、NF-κB、p-NF-κB蛋白表达水平检测 采用Western blot法。收集各组细胞,加入适量预冷的1×PBS洗涤后,按照每1×106个细胞加入裂解液200 μl,充分裂解后,取上清液进行蛋白质定量。SDS-PAGE电泳后,选用90 V转膜50 min,5%脱脂奶粉4℃封闭过夜,加一抗,PD-L1抗体(1∶2 000)、NF-κB抗体(1∶1 000)、p-NF-κB抗体(1∶1 000)和GAPDH抗体(1∶10 000)室温孵育1 h,洗膜,按照1∶10 000稀释HRP标记的二抗,室温孵育1 h。洗膜,选用ECL化学发光法显色,通过TANON GIS软件读取相关条带灰度值。
1.3 统计学处理 采用SPSS 23.0统计软件。计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 对照组和模型组细胞形态学比较 光镜下观察可见,对照组和模型组细胞在开始培养时(0 h),细胞形态和数量无明显差异。与对照组同期培养时间相比(24、48、72 h),模型组细胞数量明显增多,延展性更好,并且5 ng/ml TGF-β1刺激后,细胞表现为肌纤维细胞形态的特征。随着培养时间增加,细胞密度增大,形态变小,呈现出多边形的梭形,且相邻细胞有伪足相连,在培养板表面整齐均匀分布。见图1。
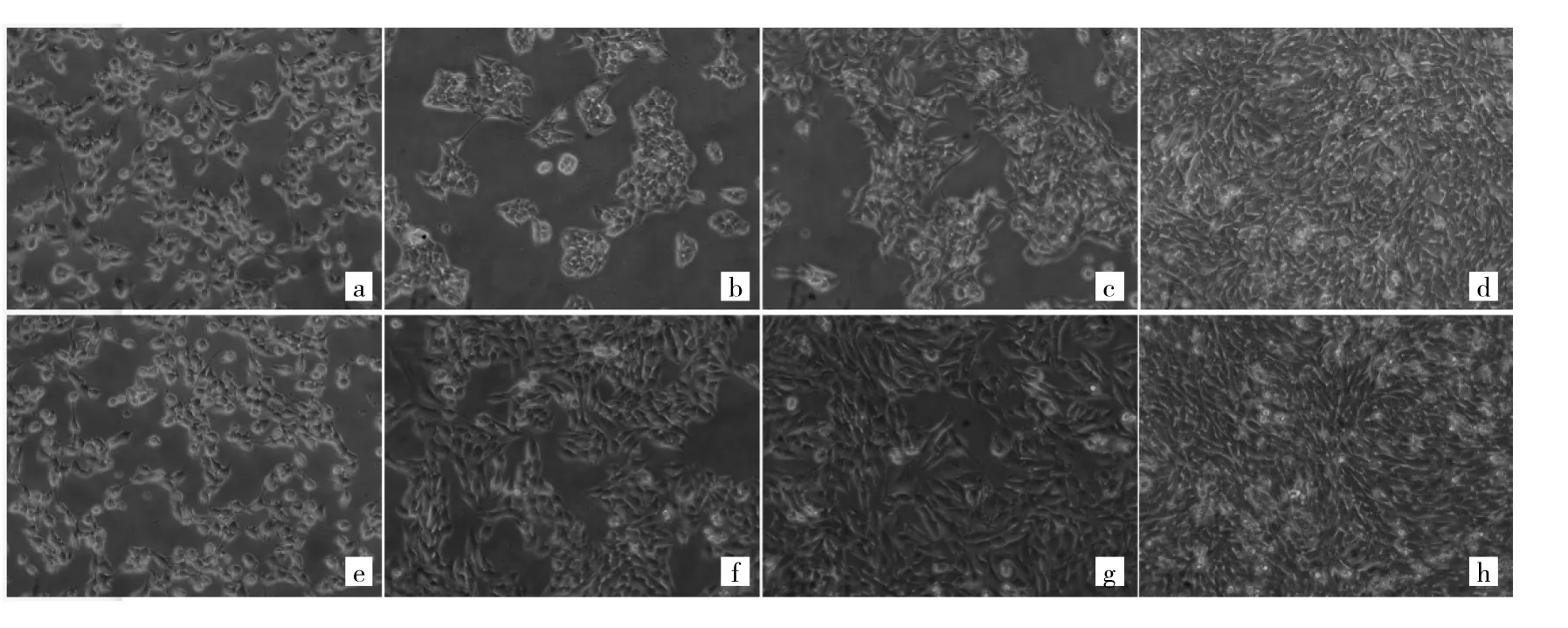
图1 对照组和模型组细胞形态学比较(a、b、c、d:分别为对照组细胞培养0、24、48、72 h;e、f、g、h:分别为模型组细胞培养0、24、48、72 h;×200)
2.2 TGF-β1不同作用时间的模型组细胞TNF-α、IFN-γ mRNA表达水平比较 与TGF-β1作用0 h相比,TGF-β1作用24 h时的模型组细胞TNF-α、IFN-γ mRNA表达水平比较差异均无统计学意义(均P>0.05);TGF-β1作用48、72 h时的模型组细胞TNF-α、IFN-γ mRNA表达水平比较显著增高(均P<0.05),且以48 h时最高(P<0.05)。见图2。

图2 TGF-β1不同作用时间的模型组细胞TNF-α、IFN-γ mRNA表达水平比较
2.3 各转染组细胞转染效果比较 与对照组相比,超表达-空载组和抑制-空载组细胞中miR-16-5p表达水平差异均无统计学意义(均P>0.05);与超表达-空载组相比,miR-16-5p超表达组细胞miR-16-5p表达水平升高(P<0.05);与抑制-空载组相比,miR-16-5p抑制组细胞miR-16-5p表达水平降低(P<0.05)。见图3。
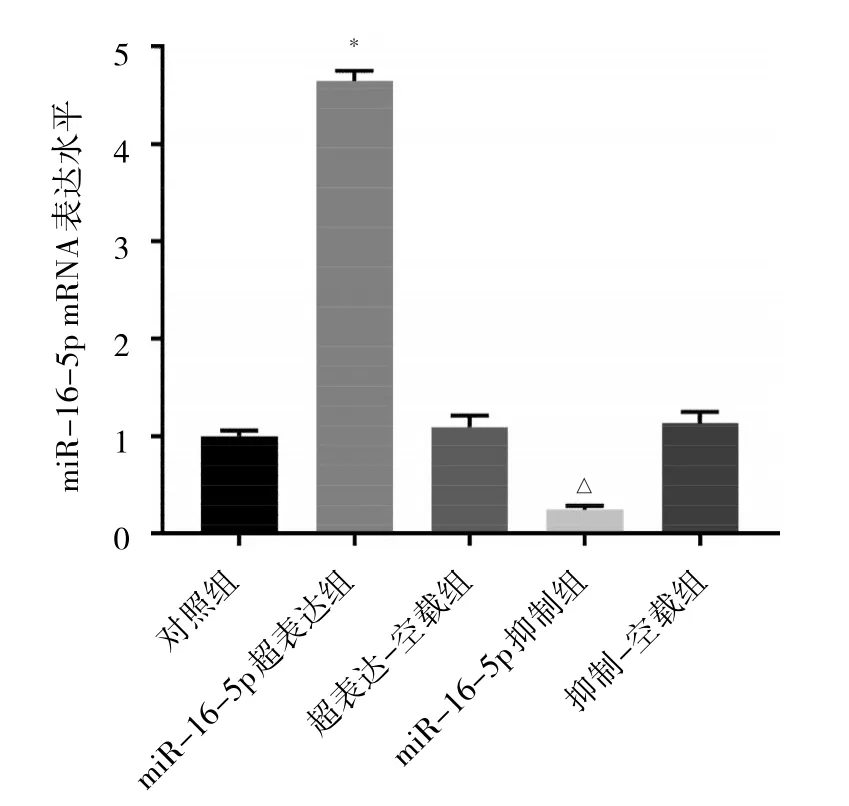
图3 各转染组细胞miR-16-5p表达水平比较
2.4 模型组、miR-16-5p超表达组、miR-16-5p抑制组、超表达-空载组和抑制-空载组细胞形态学比较与模型组相比,miR-16-5p超表达组细胞数量明显减少,肌纤维细胞形态减少;miR-16-5p抑制组细胞数量明显增多,形态无明显变化;超表达-空载组和抑制-空载组细胞形态及数量无明显差异。见图4。

图4 模型组、miR-16-5p超表达组、miR-16-5p抑制组、超表达-空载组和抑制-空载组细胞形态学比较(a:模型组;b:miR-16-5p超表达组;c:miR-16-5p抑制组;d:超表达-空载组;e:抑制-空载组;×200)
2.5 各组细胞增殖能力比较 与模型组相比,miR-16-5p-超表达组A值明显降低(P<0.05),细胞增殖能力下降;miR-16-5p抑制组A值明显升高,细胞增殖能力增强(P<0.05);超表达-空载组和抑制-空载组细胞增殖能力均无明显变化(均P>0.05)。见图5。
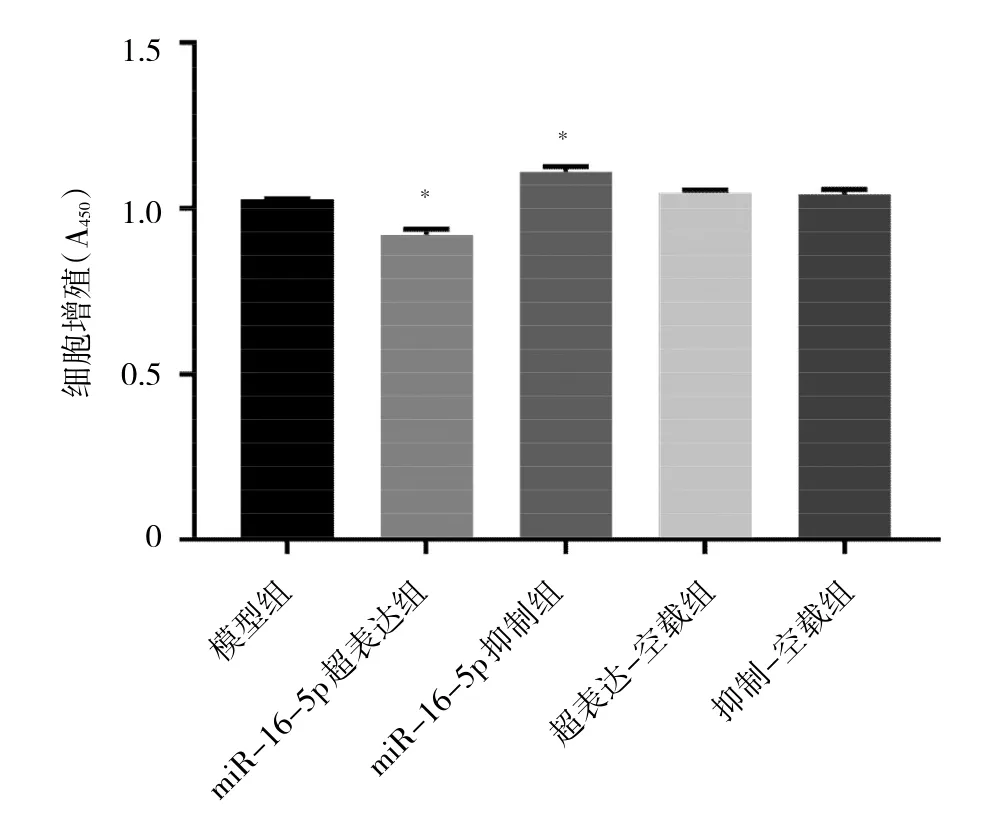
图5 各组细胞增殖能力比较
2.6 各组细胞PD-L1、NF-κB、p-NF-κB蛋白表达水平比较 与模型组相比,超表达-空载组和抑制-空载组细胞中PD-L1、p-NF-κB/NF-κB蛋白表达水平均无统计学差异(均P>0.05);miR-16-5p超表达组PD-L1蛋白表达水平升高(P<0.05),p-NF-κB/NF-κB蛋白表达水平降低(P<0.05);miR-16-5p抑制组PD-L1蛋白表达水平降低(P<0.05),p-NF-κB/NF-κB蛋白表达水平均升高(均P<0.05)。见图6。
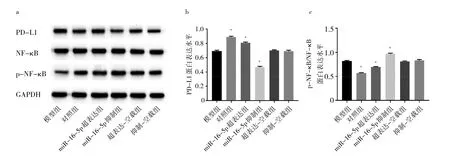
图6 各组细胞PD-L1、NF-κB、p-NF-κB蛋白表达水平比较(a:蛋白表达电泳图比较;b:PD-L1蛋白表达水平比较;c:p-NF-κB/NF-κB蛋白表达水平比较)
2.7 各组细胞miR-16-5p、PD-L1、TNF-α、IFN-γ、IL-6、IL-10 mRNA表达水平比较 与模型组相比,超表达-空载组和抑制-空载组细胞miR-16-5p、PD-L1、TNF-α、IFN-γ、IL-6、IL-10 mRNA 表达水平比较差异均无统计学意义(均P>0.05);miR-16-5p超表达组miR-16-5p、PD-L1、IL-10 mRNA表达水平均升高(均 P>0.05),TNF-α、IFN-γ、IL-6 mRNA 表达水平均降低(均P>0.05);miR-16-5p抑制组miR-16-5p、PD-L1、IL-10表达水平均降低(均P<0.05),TNF-α、IFN-γ、IL-6 mRNA表达水平均升高(均P<0.05)。见图7。
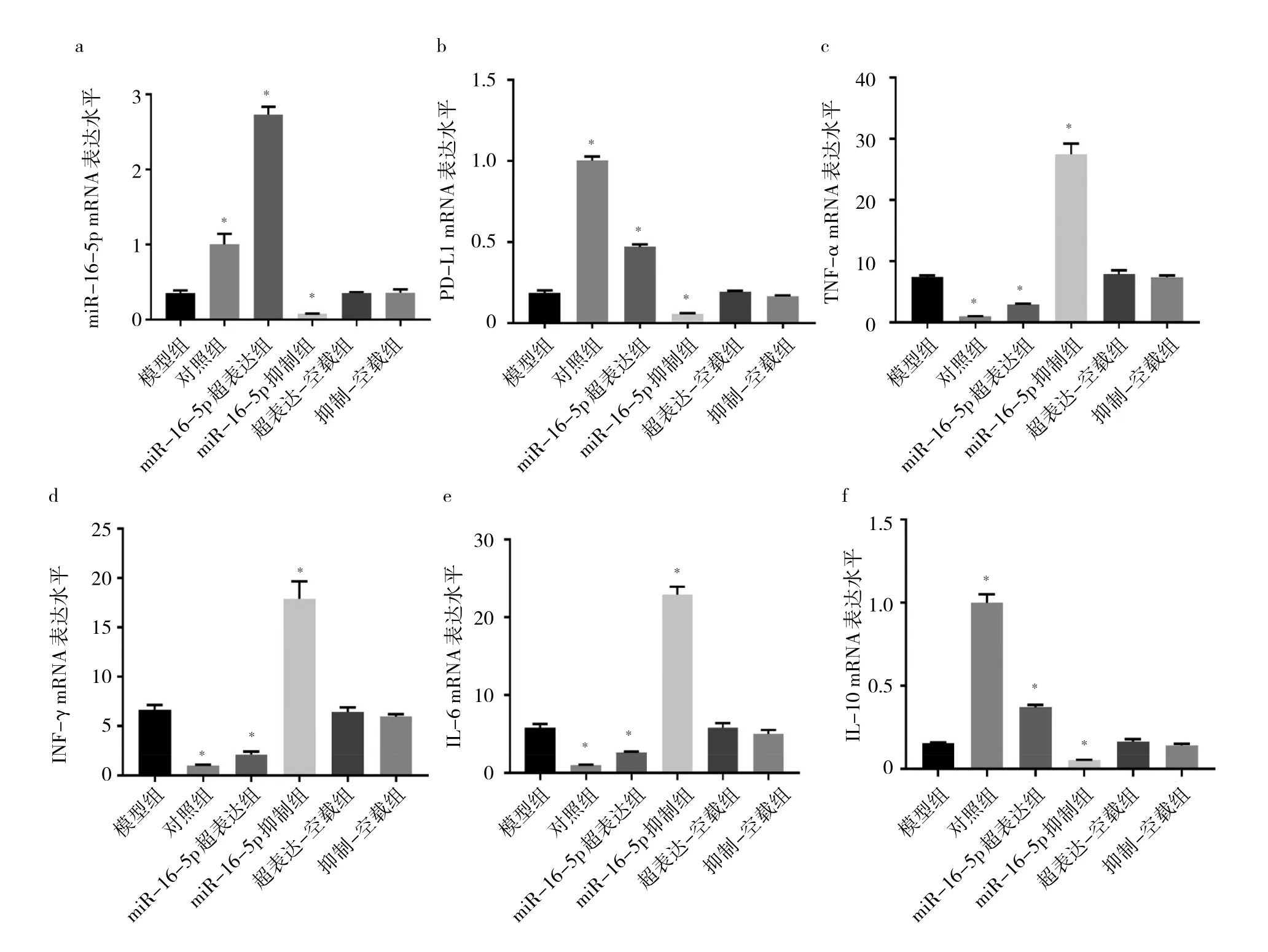
图7 各组细胞miR-16-5p、PD-L1、TNF-α、IFN-γ、IL-6、IL-10 mRNA表达水平比较
3 讨论
肝星状细胞分为静息和激活两种状态,在某些介质因素如活性氧物质、纤维化细胞因子如TGF-β、血小板源生生长因子(platelet derived growth factor,PDGF)[10]等的刺激下,肝星状细胞被激活,增殖并转化为肌成纤维细胞样细胞(myofibroblast like cells,MFB)[2]。肝星状细胞的活化属于级联活化模式,肝细胞受损后分泌有丝分裂的作用因子刺激自身细胞增殖,丧失接触抑制能力,同时与其毗邻细胞共同作用释放大量TNF-α、TNF-β、IFN-γ等细胞因子促进肝星状细胞活化、增殖,另外MFB样细胞也会自分泌TGF、PDGF等细胞因子促进自身的活化及增殖等[11]。本研究选用TGF-β1刺激HSC-T6细胞0、24、48、72 h,TGF-β1介导的TGF-β/Smad信号通路是肝星状细胞活化及增生的关键环节[10],结果显示细胞增殖具有时间诱导依赖性,细胞数量随药物处理时间的延长而增多,另外发现TGF-β1刺激HSC-T6细胞48 h,细胞内TNF-α和IFN-γ表达含量显著升高,这表明TGF-β1处理48 h时,细胞内的炎症反应最强,HSC活化正处于最繁盛时期。因此筛选此时间点为TGF-β1的最佳作用时间。
我国有大量的急性肝炎发展为慢性炎症,最终形成肝硬化的病例。肝纤维化的发展速度受发病病因、环境和遗传因素等的影响[12]。近年来大量文献表明多种miRNA与肝纤维化的发生密切相关,miRNA的异常表达参与调控HSC的活化及肝纤维化相关信号通路[13]。如Lakner等[14]通过miRNA微阵列分析静息态HSC被激活后miRNA的表达情况,发现3种miRNA表达上调(miR-34c、miR-184和miR-221),8种miRNA表达下调(miR-16、miR-19a、miR-19b、miR-29a、miR-29c、miR-92a、miR150、miR-194)。本研究发现肝星状细胞被TGF-β1刺激活化后,胞内miR-16-5p的表达水平也出现下调,并且预测的目的靶蛋白PD-1表达水平也明显下降,与miR-16-5p的表达呈正相关。PD-1是一种免疫共抑制分子,通过负调控T、B细胞激活而抑制免疫应答,张宏宇等[15]研究表明PD-1通过抑制其表达降低肝细胞损伤,减少炎症反应,抑制肝炎向肝纤维化的发展。本研究检测肝星状细胞活化后相关炎症细胞因子,发现促炎症因子p-NF-κB/NF-κB、TNF-α、IFN-γ、IL-6表达水平显著升高,而抗炎因子IL-10表达水平明显降低。NF-κB可调控多种炎症和抗炎因子的表达来调节肝星状细胞的活化、增殖从而影响肝纤维化的发展[16-17];IFN-γ和TNF-α在人表皮淋巴管内皮细胞的炎症反应中具有协同促进PD-L1表达的作用[11]。与之相同,对比模型组,miR-16-5p超表达组细胞内miR-16-5p、PD-L1表达上调,炎症反应降低,抑制细胞增殖;miR-16-5p抑制组miR-16-5p、PD-L1表达下调,细胞活化增殖,炎症反应加剧。
综上所述,miR-16-5p在激活的肝星状细胞中的表达水平低于静息态细胞,高表达miR-16-5p可促进PD-L1表达上调,抑制细胞增殖,降低细胞炎症反应,其作用机制可能参与治疗肝纤维化的发展。

