利拉鲁肽联合达格列净治疗肥胖2 型糖尿病的疗效观察
刘博研
糖尿病是一种以高血糖为基础病理改变的代谢性疾病,导致该病发生的因素较多,同时结合患者临床症状差异可将糖尿病分为1 型糖尿病与2 型糖尿病。1 型糖尿病与免疫功能异常有关,2 型糖尿病与遗传因素、环境因素有关,据流行病学调查显示,约有80%~90%的糖尿病确诊患者为2 型糖尿病,患者伴有多饮、多食、多尿、体重下降等“三多一少”典型症状[1,2]。近些年,伴随我国居民生活水平以及消费水平的提升,2 型糖尿病正逐渐发展为临床常见代谢系统疾病,其中约有60%~80%的2 型糖尿病患者发病前为肥胖者,这主要是由于营养过剩导致胰岛B 细胞超负荷,进而影响胰岛功能的正常发挥,诱发糖尿病[3-5]。肥胖2 型糖尿病患者临床治疗以控制血糖、降低糖尿病并发症发生率为主,由于肥胖2 型糖尿病患者治疗中伴有胰岛素抵抗(IR),因此胰岛素利用效率低,应用胰岛素降糖可致使机体代偿性分泌过多胰岛素,从而诱发高胰岛素血症,达格列净以非胰岛素依赖方式控制人体血糖,为肥胖2 型糖尿病患者常用药。近些年,部分医学研究者提出利拉鲁肽联合达格列净可提升肥胖2 型糖尿病的疗效[6]。本次研究为论证上述观点,选取本院2019年6月~2020年6月收治的64例肥胖2 型糖尿病患者为研究对象,分析利拉鲁肽联合达格列净的治疗效果。
1 资料与方法
1.1 一般资料 选取本院2019 年6 月~2020 年6 月收治的64 例肥胖2 型糖尿病患者,按照治疗方法不同分为对照组和实验组,各32 例。实验组患者男16 例,女16 例;年龄35~75 岁,平均年龄(55.62±7.42)岁;文化程度:小学及以下15 例,初中10 例,高中及以上7 例。对照组患者男18 例、女14 例;年龄33~74 岁,平均年龄(55.60±8.45)岁;文化程度:小学及以下14 例,初中11 例,高中及以上7 例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入及排除标准 纳入标准:①患者均出现多饮、多食、多尿、体重下降等“三多一少”症状,空腹血糖>7.0 mmol/L,餐后2 h 血糖>11.1 mmol/L,糖化血红蛋白>6.5%,体质量指数>30 kg/m2,结合尿糖测定结果、葡萄糖耐量试验,均确诊为肥胖2 型糖尿病;②本次研究征得患者及其家属同意,同时本次研究符合医院伦理会标准。排除标准:①非首次系统接收药物治疗肥胖2 型糖尿病患者;②对本次用药方案过敏患者;③合并酮症酸中毒、糖尿病足、糖尿病肾病等其他糖尿病并发症患者;④本次研究期间失访患者。
1.3 方法 两组患者均低糖饮食,结合患者每日运动量规定每日摄入的主食量,轻体力、中体力及重体力患者每日摄入的主食量分别为250~300 g、300~350 g及≥350 g,三餐主食量的比值为1∶2∶2,同时患者应禁食香蕉、西瓜、糖果等高糖饮食,规律作息,养成良好的生活习惯。对照组患者采用利拉鲁肽治疗,三餐前5 min 均皮下注射利拉鲁肽注射液[诺和诺德(中国)制药有限公司,国药准字J20160037,规格:3 ml∶18 mg/支(预填充注射笔)],0.6 mg/次,3 次/d。实验组采用利拉鲁肽联合达格列净治疗,利拉鲁肽用法用量同对照组;达格列净片(阿斯利康制药有限公司,国药准字J20170040,规格:10 mg×14 片),口服5 mg/次,清晨给药1 次。两组患者均持续治疗4 周为1 个疗程,连续治疗3 个疗程。
1.4 观察指标
1.4.1 治疗前后血糖指标 治疗前及治疗3 个疗程后采用血糖仪检测患者空腹血糖、餐后2 h 血糖、糖化血红蛋白水平。
1.4.2 治疗前后炎症指标 治疗前及治疗3 个疗程后抽取患者空腹静脉血5 ml,血液标本高速离心提取血清,应用放射免疫分析法检测超敏C 反应蛋白、肿瘤坏死因子-α、白细胞介素-6 水平。
1.4.3 治疗前后肾功能指标 治疗前及治疗3 个疗程后应用分光光度计测定患者血肌酐、尿素氮水平。
1.4.4 治疗前后体质量指数 测定时间为治疗前及治疗3 个疗程后,体质量指数=体重(kg)/身高2(cm2)。
1.4.5 药物不良反应及糖尿病不良事件发生情况 药物不良反应包括过敏反应、恶心呕吐等。糖尿病不良事件包括低血糖、糖尿病足、酮症酸中毒等。
1.5 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差 ()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组治疗前后血糖指标比较 治疗前,实验组患者空腹血糖为(12.54±0.21)mmol/L、餐后2 h 血糖为(16.43±2.32)mmol/L、糖化血红蛋白为(10.43±2.34)%,对照组患者空腹血糖为(12.51±0.24)mmol/L、餐后2 h血糖为(16.41±2.31)mmol/L、糖化血红蛋白为(10.41±2.31)%;治疗后,实验组患者空腹血糖为(5.95±0.21)mmol/L、餐后2 h 血糖为(6.13±1.37)mmol/L、糖化血红蛋白为(6.15±0.23)%,对照组患者空腹血糖为(6.35±0.24)mmol/L、餐后2 h 血糖为(7.15±1.32)mmol/L、糖化血红蛋白为(6.56±0.21)%。治疗前,两组患者空腹血糖、餐后2 h 血糖及糖化血红蛋白比较,差异无统计学意义(P>0.05);治疗后,两组患者空腹血糖、餐后2 h 血糖、糖化血红蛋白均低于治疗前,且实验组均低于对照组,差异具有统计学意义(P<0.05)。见表1。
表1 两组治疗前后血糖指标比较()
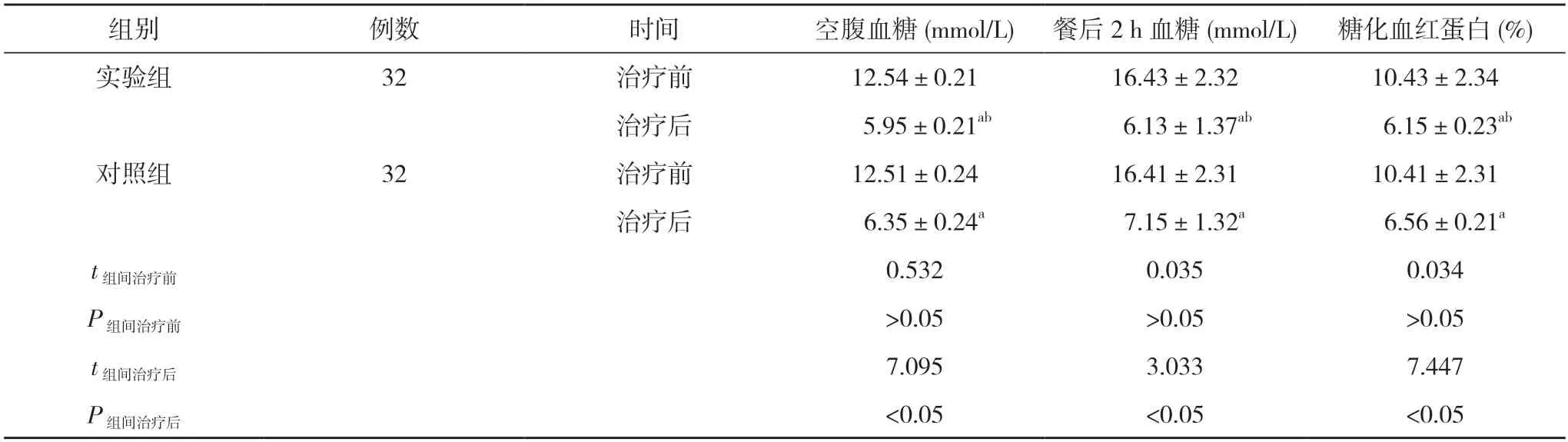
表1 两组治疗前后血糖指标比较()
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
2.2 两组治疗前后炎症指标比较 治疗前,实验组患者超敏C 反应蛋白为(14.34±2.43)mg/L、肿瘤坏死因子-α 为(58.34±2.43)ng/L、白细胞介素-6为(205.43±4.32)pg/ml,对照组患者超敏C 反应蛋白为(14.32±2.48)mg/L、肿瘤坏死因子-α 为(58.31±2.41)ng/L、白细胞介素-6 为(205.41±4.31)pg/ml;治疗后,实验组患者超敏C 反应蛋白为(6.42±0.31)mg/L、肿瘤坏死因子-α 为(24.32±1.32)ng/L、白细胞介素-6为(104.34±4.54)pg/ml,对照组患者超敏C 反应蛋白为(8.64±0.33)mg/L、肿瘤坏死因子-α 为(27.65±1.35)ng/L、白细胞介素-6 为(125.43±4.58)pg/ml。治疗前,两组患者超敏C 反应蛋白、肿瘤坏死因子-α、白细胞介素-6 水平比较,差异无统计学意义(P>0.05);治疗后,两组患者超敏C 反应蛋白、肿瘤坏死因子-α、白细胞介素-6 水平均低于治疗前,且实验组低于对照组,差异具有统计学意义(P<0.05)。见表2。
表2 两组治疗前后炎症指标比较()

表2 两组治疗前后炎症指标比较()
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
2.3 两组治疗前后肾功能指标比较 治疗前,实验组患者血肌酐为(156.43±2.32)μmol/L、尿素氮为(12.65±2.43)mmol/L,对照组患者血肌酐为(156.47±2.36)μmol/L、尿素氮为(12.65±2.41)mmol/L;治 疗后,实验组患者血肌酐为(104.54±2.32)μmol/L、尿素氮为(6.45±1.43)mmol/L,对照组患者血肌酐为(112.34±2.34)μmol/L、尿素氮为(8.65±1.45)mmol/L。治疗前,两组患者血肌酐、尿素氮水平比较,差异无统计学意义(P>0.05);治疗后,两组患者血肌酐、尿素氮水平均低于治疗前,且实验组低于对照组,差异具有统计学意义(P<0.05)。见表3。
表3 两组治疗前后肾功能指标比较()

表3 两组治疗前后肾功能指标比较()
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
2.4 两组治疗前后体质量指数比较 治疗前,实验组患者体质量指数为(33.65±1.65)kg/m2,对照组患者体质量指数为(33.61±1.61)kg/m2;治疗后,实验组患者体质量指数为(30.43±1.32)kg/m2,对照组患者体质量指数为(31.34±1.35)kg/m2。治疗前,两组患者体质量指数比较,差异无统计学意义(P>0.05);治疗后,两组患者体质量指数低于治疗前,且实验组低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组治疗前后体质量指数比较(,kg/m2)

表4 两组治疗前后体质量指数比较(,kg/m2)
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
2.5 两组药物不良反应及糖尿病不良事件发生情况比较 实验组患者发生1 例过敏反应,2 例恶心呕吐,药物不良反应发生率为9.38%;对照组患者发生1 例过敏反应,1 例恶心呕吐,药物不良反应发生率为6.25%。实验组患者药物不良反应发生率略高于对照组,但差异无统计学意义(P>0.05)。实验组患者发生1 例低血糖,1 例酮症酸中毒,糖尿病不良事件发生率为6.25%;对照组患者发生5 例低血糖,2 例糖尿病足,3 例酮症酸中毒,糖尿病不良事件发生率为31.25%。实验组患者糖尿病不良事件发生率低于对照组,差异有统计学意义(P<0.05)。见表5。

表5 两组药物不良反应及糖尿病不良事件发生情况比较(n,%)
3 讨论
2 型糖尿病可发生于任何年龄段,流行病学调查显示,该病常见于中老年患者,患者起病隐匿,临床症状较轻,但是机体长期处于高糖水平,微小血管、神经出现不同的损伤,进而致使出现多尿、多饮、多食以及体重下降等症状,部分患者可伴有肢体乏力[7-9]。但是近些年临床研究发现,肥胖并发2 型糖尿病患者比例逐年增多,肥胖因素正逐渐发展为诱发2 型糖尿病的重要因素之一。肥胖并发2 型糖尿病的发生与患者能量摄入多,糖类体内代谢依赖于胰岛B 细胞分泌的胰岛素,摄入的饮食多,则胰岛B 细胞分泌的胰岛素也随之增多,肥胖患者长期摄入的能量超过人体代谢所需能量,大量的糖类蓄积在患者体内,同时长期胰岛B 细胞处于高负荷状态,久而久之超过胰岛B 细胞可承受的最大范围,胰岛细胞损伤,从而导致血糖升高,诱发肥胖2 型糖尿病[10-13]。
肥胖2 型糖尿病临床治疗包括饮食控制及降糖药物治疗,2 型糖尿病既往常用降糖药物类型为双胍类降糖药、噻唑烷二酮类降糖药物,双胍类降糖药通过增加周围组织对胰岛素的敏感性,提升胰岛素利用率,抑制肝糖原的产生,以达到降糖的效果[14,15]。药动力学研究显示,双胍类降糖药物血浆半衰期在1~5 h,12 h 内肾脏清除,该药物主要经小肠吸收,因此,饮食可直接影响该药物有效成分的吸收。噻唑烷二酮类降糖药物包括罗格列酮、吡格列酮,该类降糖药物通过激活脂肪、骨骼肌、肝脏组织内过氧化物酶体增殖物激活受体γ(PPARγ)核受体以调节胰岛素应答基因的转率,进而提升外周组织以及肝脏对胰岛素的敏感性,达到降糖的目的,药动力学研究显示,该药物给药后可在2 h 达到血药浓度峰值[16-19]。肥胖2 型糖尿病患者应用双胍类降糖药、噻唑烷二酮类降糖药物均不适用,达格列净为新型降血糖药物,该药物通过影响钠-葡萄糖转运蛋白通道的开放,肾小管细胞钠-葡萄糖转运蛋白对于达格列净最为敏感,该药物可促使患者体内多余葡萄糖经尿道排出,进而维持患者体内血糖水平,以达到降糖的目的。此外,该药物可刺激胰岛B 细胞,抑制胰岛B 细胞凋亡,促使胰岛B 细胞新生,同时延缓胃排空,因此,适用于肥胖2 型糖尿病患者临床治疗[20]。利拉鲁肽为内源性肠促胰岛素激素类似物,该药物给药后可激活胰岛B 细胞上胰高血糖素肽-1(GLP-1)受体,进而促进胰岛B 细胞的敏感性,同时抑制胰高血糖素的分泌,在降低患者血糖的同时发挥保护胰岛B 细胞的目的。此外,该药物可抑制机体炎性反应[21]。
王万民[22]临床研究显示,应用利拉鲁肽与达格列净联合治疗的观察组患者治疗前体质量指数、空腹血糖、餐后2 h 血糖、糖化血红蛋白与单纯应用达格列净治疗的对照组比较,差异无统计学意义(P>0.05);治疗后观察组体质量指数、空腹血糖、餐后2 h 血糖、糖化血红蛋白显著低于对照组,差异有统计学意义(P<0.05);其研究结果与本次研究结果一致。本次研究中应用利拉鲁肽与达格列净联合治疗的实验组患者治疗后空腹血糖、餐后2 h 血糖、糖化血红蛋白及超敏C 反应蛋白、肿瘤坏死因子-α、白细胞介素-6 水平均低于对照组,差异有统计学意义(P<0.05)。此外,本次研究在既往研究基础上,比较两组患者治疗前后血肌酐、尿素氮等肾功能指标及体质量指数、药物不良反应以及糖尿病不良事件发生情况,结果显示,治疗后,两组患者血肌酐、尿素氮、体质量指数以及糖尿病不良事件发生率均低于对照组,差异有统计学意义(P<0.05);两组患者药物不良反应发生率比较,差异无统计学意义(P>0.05)。由此可见,肥胖2 型糖尿病患者应用利拉鲁肽联合达格列净治疗可显著提升治疗效果,保护患者肾功能,减轻患者炎症反应以及糖尿病不良事件,但是不会明显增加不良反应发生情况。
综上所述,肥胖2 型糖尿病应用利拉鲁肽与达格列净联合治疗效果显著优于单纯利拉鲁肽治疗,可有改善血糖水平、炎症反应、肾功能及体重情况,且安全性较高,值得临床推广。

