具核梭杆菌与食管癌关系的研究进展
殷海森 张建伟 余保平
武汉大学人民医院消化内科 湖北 武汉 430060
食管癌是最常见的消化道恶性肿瘤之一,也是世界上第六大常见的癌症相关死亡原因[1]。食管癌患者的 5 年生存率仅为15%~25%[2]。遗传、环境、饮食习惯、体质量指数(BMI)、饮酒等危险因素可导致食管癌的发生。多种微生物被证明与癌症的发病相关,如幽门螺杆菌与胃癌、EB 病毒与鼻炎癌、人乳头状病毒与宫颈癌等。近年来,研究者们发现食管中微生物也可能参与食管癌的发生发展[3]。
具核梭杆菌(Fusobacterium nucleatum,Fn)是专性厌氧的革兰阴性杆菌,菌体两端有锐利的尖端,可广泛黏附并定植于口腔、消化道和呼吸道内[4,5],与牙周炎、阑尾炎、呼吸道感染、类风湿性关节、早产等有关[6]。近期研究表明,Fn 在大肠癌、口腔癌、乳腺癌及食管癌中的阳性检出率明显高于正常人群及配对的癌旁组织,并且越来越多的研究支持 Fn 促进食管癌的进展,并影响其预后[7‑10]。以下将从Fn 与食管癌的关系及其促癌作用的机制等方面作系统综述。
1 食管微生物的特征
从口腔经食道到远端直肠,细菌的多样性和数量 发 生 了 显 著 的 变 化 。 Pei 等[11]通 过 16S rDNA PCR 法检测出了正常食道共有6 门95 种细菌。另外,食管与口咽、胃和食团的细菌种类及组分比例不同,而食管标本之间无明显差异,表明食管微生态的稳定性。组织的显微镜检查证实了细菌与原位黏膜上皮细胞表面之间的紧密联系,表明食管菌群是食管的长期固有菌群而不是短暂的临时生物群。
食管不同疾病对应不同的菌群分布,利用食管不同疾病或同一疾病不同阶段之间微生物的差异可对食管疾病进行诊断。Li 等[12]对食管鳞状细胞癌、食管胃交界处癌、根治性食管切除术后9~12 个月的患者和健康对照的食管微生物进行了研究,结果显示,食管鳞状细胞癌组、食管胃交界处癌组及根治性食管切除术组的微生物多样性显著低于健康对照组。食管鳞状细胞癌组梭菌门丰度高于健康对照组,放线菌门丰度低于健康对照组。食管鳞癌组和健康对照组的微生物成分分析和PICRUSt 检测结果均有显著差异,而食管切除术后的微生物组成和代谢途径与健康对照组相似。因此食管微生物组成和代谢可一定程度上反映食管疾病所处状态。
2 具核梭杆菌与Barret 食管
Liu 等[13]发现梭杆菌属在反流性食管炎和 Bar‑rett 食管患者中普遍存在,但在正常食管中未检出。Di Pilato 等[14]的研究也发现 Fn 在内的某些革兰阴性菌群的富集可能与胃食管反流病的发生有关,并可能促进Barrett 食管甚至食管腺癌的发生。这些结果表明Fn 在食管癌前病变中已经存在,但Fn 在食管癌发生中的作用仍需更多的流行病学研究支持。
3 具核梭杆菌与食管癌
Elliott 等[15]通过对 86 例食管黏膜 16S rRNA 基因扩增子进行测序,发现食管癌黏膜的微生物多样性明显降低,而癌组织中 Fn 富集。Yamamura 等[16]用PCR 法检测包括食管癌在内的多种肿瘤组织及配对正常组织的石蜡包埋切片的Fn 含量发现:食管癌中的Fn 检测率为20%,表面区域的检出率高于深部组织。该团队继续检测325 例接受食管癌手术切除的患者癌组织中Fn 的DNA 含量,结果显示74例(占23%)癌组织中含有Fn。且食管癌组织中Fn的DNA 阳性与肿瘤的临床分期及不良预后相关[17]。该团队继续研究了Fn 与食管癌对化疗耐药影响,用qPCR 法对来自两个队列的551 例食管癌患者(包括101 例术前接受新辅助化疗的食管癌患者)进行Fn 的检测,结果发现高丰度Fn 的食管癌患者无复发生存时间(relapse free survival,RFS)更短,且对新辅助化疗的反应性差[18],据此推断用抗生素杀灭Fn 可能会改善食管癌患者的治疗效果。Kageyama 等[19]发现患者的唾液标本中具核梭杆菌丰度较对照组高,为食管癌早期诊治提供新思路。
4 机制
4.1 具核梭杆菌与免疫细胞的相互作用髓源性抑制细胞是肿瘤相关巨噬细胞(M2 型巨噬细胞)、粒细胞和树突状细胞的(dendritic cell,DC)的前体,在促进肿瘤发展和血管生成中起关键作用[20]。巨噬细胞在局部炎症反应特异性微环境中,可分化为促炎的M1 型巨噬细胞或促肿瘤的M2 型巨噬细胞[21,22]。Fn 能增加肿瘤相关巨噬细胞的局部浸润,通过TLR4 促进巨噬细胞M2 型分化,激活IL‑6/STAT3/c‑Myc 型号通路,促进肿瘤的发生[20,23]。喂食Fn 的小鼠肠内CD103+调节性DC 的数量明显增加,这些细胞通过增加Foxp3+调节性T 细胞而降低肿瘤免疫[24]。
自然杀伤(natural killer,NK)细胞是免疫监视的关键部分,通过激活和抑制受体来杀灭异常细胞(如病毒感染细胞和肿瘤细胞)。酪氨酸抑制基序(TIGIT)受体使NK 细胞表达的一种抑制性受体,Fn 的 Fap2 蛋白结合 NK 细胞表面的 TIGIT 受体,导致抑制性级联反应,抑制NK 细胞激活,减少体内具有细胞毒性的NK 细胞数量,使肿瘤细胞逃逸免疫清除[25]。
有研究发现CD3+的T 细胞数目与具核梭杆菌在结肠组织中的丰度负相关[26]。Fn 的提取物FDC364 能抑制T 细胞对抗原的作用,诱导T 细胞发生细胞周期阻滞,促进 T 细胞凋亡[27,28]。近年来,Cur 等[25]研究发现 Fn 的毒力蛋白 Fap2 可直接与 T细胞表面的TIGIT 结合,抑制T 细胞的肿瘤免疫应答反应,并促进T 淋巴细胞局部凋亡。因此Fn 以及其相关代谢产物能够直接或者间接抑制T 细胞的活性从而促进肿瘤的发生和进展。见图1。
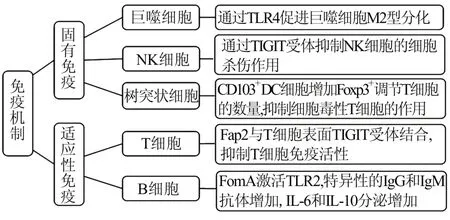
图1 Fn 调节免疫机制促进肿瘤免疫逃逸
4.2 促炎症⁃肿瘤微环境形成Fn 可增加炎症细胞因子和趋化因子产生促炎肿瘤微环境。Fn 的黏附因子(fusobacteriumadhesin A,FadA)结合至肠道上皮细胞的 E‑钙黏蛋白(E‑cadherin),激活 β‑联蛋白(β‑catenin)信号通路;产生核转录因子(NF‑κB),促炎细胞因子如 IL‑6、IL‑8、IL‑18、Wnt7a、Wnt 7b、Wnt9a,转录因子淋巴增强因子/T 细胞因子、Myc、Cyclin D1 等促炎细胞因子[28]。慢性炎症与肿瘤形成密切相关。Fn 高丰度食管癌组织转录组测序后的KEGG 分析提示“细胞因子‑细胞因子受体”的相关通路较对照组显著活化,趋化因子配体20(CCL20)升高,推断 Fn 可能通过激活 CCL20 促进肿瘤侵袭转移[17]
4.3 FadA、Fap2 和脂多糖(lipopolysaccharide,LPS)的毒力作用FadA 具有帮助细菌黏附和破坏上皮细胞、内皮细胞的作用,对于细菌的传播具有重要意义。目前研究表明,FadA 与E‑cadherin 结合,诱导 β‑cateinin/Wnt 信号的激活[28],也可以诱导肿瘤细胞产生趋化因子,如CXCL1 和IL‑8,而这些趋化因子可促进肿瘤细胞转移[29]。食管癌中E‑cad‑herin 高表达,且与食管癌侵袭和转移密切相关[30],因此 FadA 激活 E‑cadherin/β‑cateinin/Wnt 信号通路是Fn 促进食管癌发展的机制之一。
Fap2 是Fn 表达的一种半乳糖敏感的黏附蛋白,在Fn 定植上皮细胞机制中发挥重要作用。Fap2 蛋白可与肿瘤细胞表面的Gal‑GalNAc 结合介导细菌富集,而用O‑聚糖酶降低Gal‑GalNAc 的表达可减少大肠癌中Fn 的累积[31]。除大肠癌外,在乳腺癌等其他多种腺癌中也发现了高水平的Gal‑Gal‑NAc,Gal‑GalNAc 水平的 升 高 能促进乳腺癌 的 进展,且 Fn 的 gDNA 量与 Gal‑GalNAc 水平相关[7]。
在结直肠癌中,Fn 的LPS 通过用TLR4 抑制剂TAK‑242 阻滞 TLR4/p‑PAK1/β‑cateinin 信号通路,可 减 少 Fn 诱 导 的 肠 肿 瘤 发 生[32]。 说 明 Fn 通 过TLR4/p‑PAK1 激活 β‑catenin 信号通路促进肠道肿瘤的发生和发展。在食管癌细胞中也检测到了TLR4 的高表达[33]。因此,Fn 也可能通过 LPS 激活TLR4 信号通路促进食管癌的发生发展。见图2。
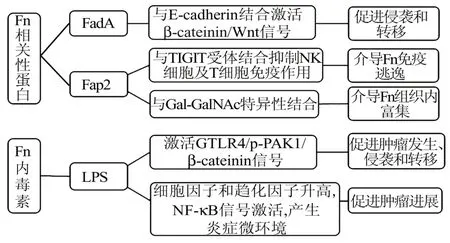
图2 Fn 的毒力蛋白及内毒素促进肿瘤进展
4.4 促癌性非编码RNA 的异常表达Fn 感染肿瘤细胞后,miRNA 表达谱发生变化,其中有很多促癌性 miRNA 表达显著上升。Yang 等[34]发现 Fn 可通过激活TLR4/MYD88/NF‑κB 通路上调结肠癌细胞系中 miR‑21 的表达,Fn 处理后的 APCMin/+小鼠结肠肿瘤数量、肿瘤大小均增加,而敲减miR‑21 可逆转 Fn 的促癌作用。同时,Yu 等[35]发现,Fn 可通过 调 节 TLR4/MYD88、miR ‑ 18a、miR ‑ 4802 与ULK1/ATG7 自噬网络之间关系,导致结直肠癌细胞对5‑氟尿嘧啶和奥沙利铂耐药。
最近的研究发现,肿瘤细胞受Fn 刺激后可分泌miR‑1246/92b‑3p/27a‑3p 丰富的外泌体,这些外泌体携带促癌性miRNA 可促进结直肠癌细胞转移[36]。因此,Fn 不仅能直接作用于被感染的细胞,而且可以通过被感染的细胞分泌的外泌体影响未感染的细胞,促进转移。这也意味着Fn 持续存在于肿瘤细胞内并不是Fn 介导转移的必要条件[37]。
Fn 不仅可以引起miRNA 的变化,也可以通过改变LncRNA 的表达来促进肿瘤的发生发展。Fn通 过转录 因 子 SP1 上 调 lncRNA ENO1‑IT1 的表达,LncRNA ENO1‑IT 引导 KAT7 组蛋白乙酰转移酶对其特定的靶基因(包括ENO1)进行组蛋白修饰,促进肿瘤细胞的糖酵解及肿瘤形成[38]。另一项研究表明 Fn 可通过lncRNA MIR4435‑2HG/miR‑296‑5p/Akt2/SNAI1 信号通路介导上皮间质转化(epithelial‑mesenchymal transition,EMT),从而促进非肿瘤细胞的恶性转变,促进口腔癌的发生[9]。见图3。

图3 Fn 通过调节非编码RNA 的表达促进肿瘤的发生发展
4.5 自噬的激活近期的研究表明Fn 在食管中能通过自噬诱导化疗耐药[39]。Liu[39]通过透射电镜和激光扫描共聚焦显微镜捕捉到Fn 侵袭食管癌细胞系以及持续存在于食管癌细胞内,并发现Fn 感染引起了LC3 和ATG7 表达上调,以及自噬小体的形成,并诱导食管癌细胞出现5‑氟尿嘧啶、顺铂和多西他赛耐药,而敲减LC3 可以逆转Fn 诱导的化疗耐药。提示Fn 激活自噬促进食管癌产生化疗耐药。而该文并对Fn 如何引起LC3 改变,以及是否与引起经典自噬激活的分子相关,并未深一步探讨。
5 小结与展望
除食管癌外,在大肠癌、口腔癌、乳腺癌组织中也有Fn 的富集,并越来越多的研究表明Fn 促进了肿瘤的发生、进展及转移。虽然,Fn 在食管肿瘤内呈高检出率,且流行病学显示合并高丰度Fn 的食管癌患者临床分期更高、化疗效果更差及预后不良,但要证实二者之间是否相关,Fn 究竟是致癌的危险因素还是仅为炎症微环境的构成因素等问题,还需要大量的临床流行病学研究及相关的分子水平的机制研究。
Fn 与食管癌关系的确定在临床上对预防、早期发现和有效治疗食管癌都有重要意义。目前Fn 对食管癌的转移相关的研究并未见报道,Fn 引起食管癌耐药、预后不良的作用机制相关的报道很少。Fn对肿瘤的直接作用相关的研究较多,而Fn 的代谢产物对肿瘤的影响仍处于空白状态。因此,仍需要大量的研究继续对相关作用机制进行阐述。

