重症新型冠状病毒肺炎患者短期生存分析及列线图构建
张 凯 叶明亮 付学东 柯亨宁,5
武汉大学中南医院 1湖北省艾滋病培训指导中心,2感染科,3消化内科,4儿科湖北 武汉 430071;5宁夏医科大学总医院肿瘤研究所 宁夏 银川 750004
截至2020 年9 月29 日,世界卫生组织的疫情简报显示全球新型冠状病毒肺炎(COIVD‑19)累积确诊人数已超过三千万人,累积死亡人数超过一百万人,而且疫情发展趋势仍处于高峰期[1]。呼吸衰竭是新型冠状病毒肺炎最常见的并发症之一[2]。根据研究表明,约5%~16%的COIVD‑19 患者合并有呼吸衰竭[3,4]。重型和危重型 COVID‑19 患者常合并有炎症因子风暴的产生,并伴有多个器官衰竭的情况,其中以呼吸衰竭最为常见[5]。COVID‑19 患者一旦合并难治性急性呼吸衰竭,其从入住重症监护室到发生死亡仅1 周[6],病情十分凶险。虽然已有许多COVID‑19 疫苗的研究已处于三期临床试验,但是疫苗免疫接种的有效性及其保护的持续时间尚未可知,而且每天世界其他地方仍有许多新发的COVID‑19 患者。虽然目前已有一些模型预测COVID‑19 患者死亡,但缺少能预测这类患者的短期生存率的列线图模型,因此本研究建构能预测合并呼吸衰竭的重症COVID‑19 患者短期预后的列线图,以期为临床医生诊治COVID‑19 提供帮助。
1 资料与方法
1.1 研究对象和方法COVID‑19 患者的纳入标准根据《新型冠状病毒肺炎诊疗方案(试行第七版)》[7]。所有患者为本地居民和当地务工人员,所有患者均统一收治到隔离病房救治。再根据以下标准诊断呼吸衰竭:当地大气压下,吸入空气时动脉血氧分压(PO2)<60 mmHg(8 kPa),伴或不伴有二氧化碳分压(PCO2)>50 mmHg(6.65 kPa)。所有患者均通过鼻咽拭子取样,并经过逆转录聚合酶链反应(PCR)进行核酸检测。所有临床数据来自电子病历系统,资料不全的病历未纳入研究中。本研究为回顾性研究,患者均为雷神山医院和武汉市第七医院住院患者,所有患者的姓名和个人信息被删除,因此豁免知情同意书。本课题已通过中南医院科伦理委员会批准,伦理号:2020011。
1.2 数据统计患者数据包括既往史、主要临床症状、生命体征、实验室检查和影像学检测等。其中实验室检查包括肌酸激酶同工酶(CK‑MB)、肌钙蛋白T、氨基末端脑钠肽前体(NT‑proBNP)、超敏C 反应蛋白(Hs‑CRP)、血清淀粉样蛋白 A(SAA)、D‑二聚体、动脉血气分析等,以上数据为患者入院后24 h 内的首次结果。治疗手段包括吸氧方式(非机械通气和机械通气)和药物治疗(抗病毒、抗炎、抗栓、抗血小板等治疗)。
1.3 统计学分析连续型变量以中位数(四分位数间距)[M(P25,P75)]表示,分类变量用例数(百分率)[例(%)]表示。将表1~3 中的数据进行单因素Cox 回归分析,再将有统计学意义的变量纳入多元Cox 回归分析。利用独立风险因素构建预后列线图。因考虑到COVID‑19 患者常合并呼吸道及全身高炎症状态,所以临床医师在救治重症COVID‑19时使用孟鲁司特以减少COVID‑19 患者的高炎症反应,同时产生抗病毒效应[8,9],因此将孟鲁司特纳入多因Cox 回归模型中。分析服用孟鲁司特和未服用孟鲁司特患者的Kaplan‑Meier 生存曲线,并用Log‑rank 验证。采用 SPSS 25.0 版软件包和 R 语言3.6.1 版进行统计学分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 患者入院时基本情况和临床特点通过对385 名确诊COVID‑19 住院患者的筛选,选出合并呼吸衰竭的72 名患者(18.7%),这些患者年龄范围为 39~88 岁,中位年龄为 67(61,73)岁,其中男性患者47 名(64.8%)。60~79 岁年龄段所占人数比例最多(72.2%)。最常见的基础疾病包括高血压病37 例(51.8%),2 型糖尿病15 例(20.8%)以及冠心病 9 例(12.5%)。7 名(9.7%)患者有脑血管疾病史,各有2 名患者(2.8%)有慢性阻塞性肺疾病和慢性肾功能不全史(表1)。

表1 合并呼吸衰竭的重症COVID⁃19 患者临床资料
超半数患者最早症状表现为咳嗽,半数患者出现呼吸困难,多见的症状还包括咳痰、乏力或肌痛、胸闷等,较多患者入院时表现呼吸频率过快及外周血氧饱和度下降。所有患者中有41 名(56.9%)入住 ICU 治疗,ICU 的中位住院时间为12(6,20)d,入院后转至 ICU 病房的中位时间为 5(1,8)d。所有患者的中位住院时间为17(9,27)d。
2.2 实验室检查结果白细胞计数中位值为7.79(5.58,12.72)×109/L,但淋巴细胞减少和中性粒细胞升高较为常见。多数患者反映心脏损伤的肌钙蛋白 T 和 NT‑proBNP、炎症指标(Hs‑CRP,SAA)及D‑二聚体水平升高。动脉血清分析提示大多数患者肺泡动脉氧分压差(A‑aDO2)升高[245(103.5,330)mmHg],所有患者均有低氧血症表现,但高碳酸血症在入院时并不常见(见表2)。
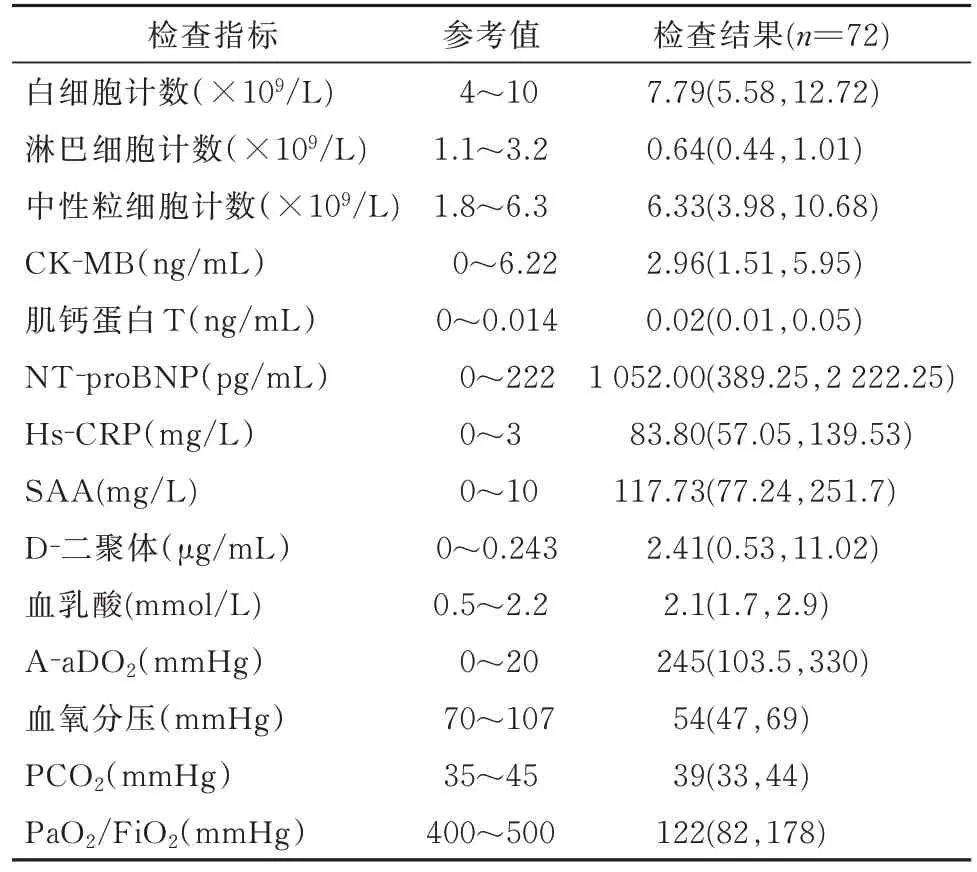
表2 合并呼吸衰竭的重症COVID⁃19 患者入院时实验室检查结果[M(P25,P75)]
2.3 治疗及临床结局在治疗方面,有16 名患者(22.2%)接受非机械通气氧疗(包括鼻导管及面罩吸氧)。56 名患者(77.8%)行机械通气氧疗,其中32 名(44.4%)为有创呼吸机治疗,24 名(33.3%)为无创呼吸机治疗。机械通气治疗的中位时间为9(4,17)d。另有5 名患者接受肾替代治疗。药物治疗方面,所有的患者均接受抗生素治疗,大部分患者给予抗病毒治疗[55(76.4%)],抗病毒药物包括阿比多尔、利巴韦林以及奥司他韦。还有部分患者接受了抗凝、抗血小板和双抗治疗。部分患者因表现出过度炎症反应,所以接受糖皮质激素治疗[60(83.3%)]。另外,因孟鲁司特可能会减轻高炎症反应及存在抗病毒效应,所以也将孟鲁司特纳入研究中,共有15 例患者(20.8%)服用孟鲁司特片。
有14 例患者(19.4%)住院期间合并有感染性休克,15 例患者合并肾功能不全。截至2020 年3 月12 日,约1/3 患者好转出院,另有7 例患者转至上级医院治疗,而有42 例患者(58.3%)死亡。这些患者从入院到死亡中位时间为13(6,20)d,死亡患者年龄多在60~79 岁之间(图1,表3)。
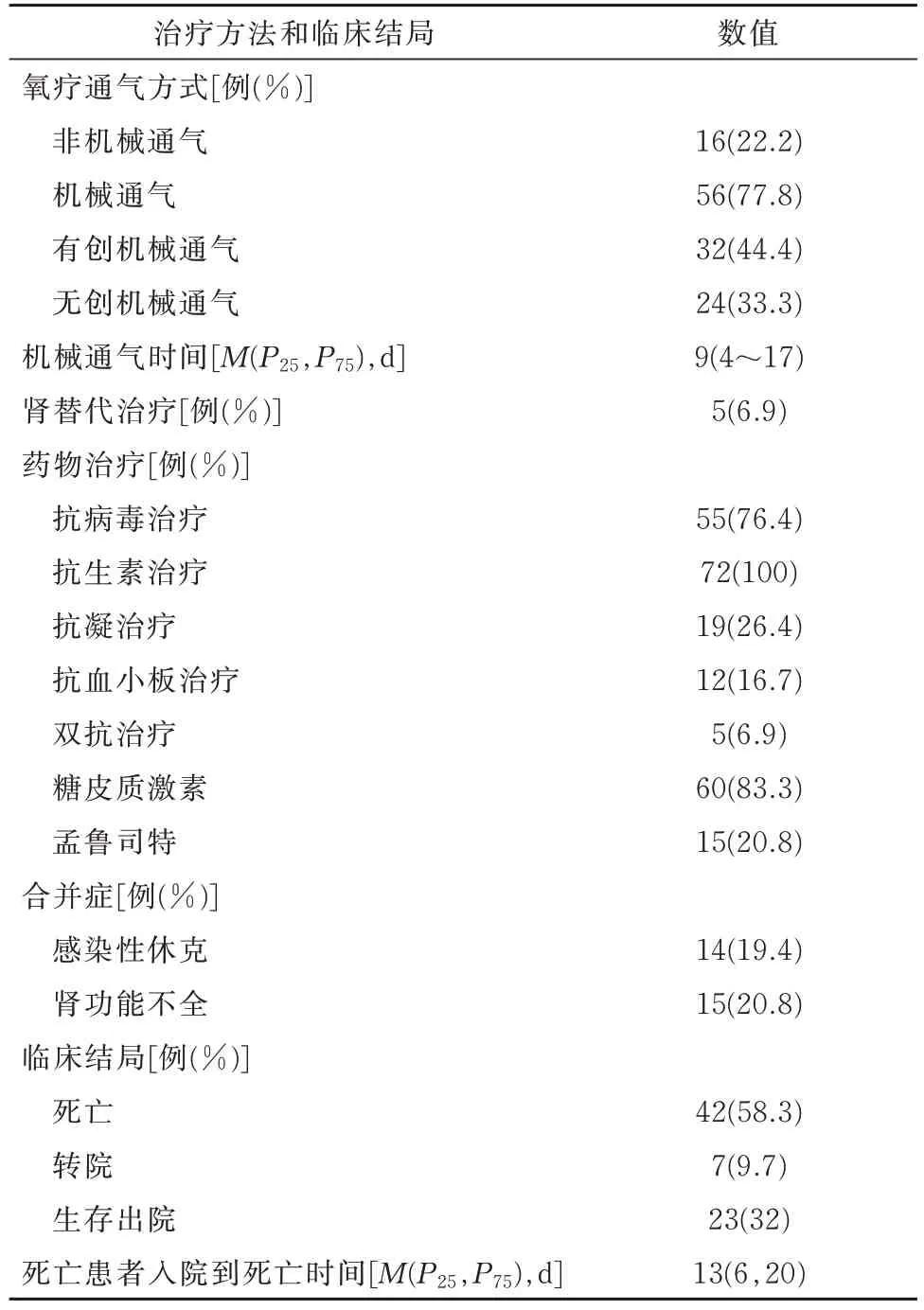
表3 合并呼吸衰竭的重症COVID⁃19 患者的治疗和临床结局
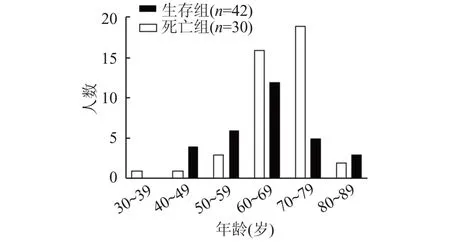
图1 生存组和死亡组患者的年龄分布
2.4 多因素Cox 回归分析及列线图构建通过多因 素 Cox 回 归 分 析 发 现 ,年 龄(aHR:1.052;95%CI:1.002~1.105),NT‑proBNP(aHR:1.020;95%CI:1.002~1.039)和 D‑二聚体(aHR:1.044;95%CI:1.017~1.071)与死亡率明显相关。延长机械通气(包括无创机械通气和有创机械通气)疗程可 以 减 少 死 亡 率 的 发 生(aHR:0.912;95%CI:0.861~0.965)。服用孟鲁司特片的患者则表现出较 低 的 死 亡 风 险(aHR:0.23;95%CI:0.065~0.821)。经过单变量Cox 回归分析本研究中的其他药物(包括抗病毒药物、抗生素、抗凝药物、抗血小板药物、糖皮质激素)不是影响生存概率的独立因素,故未纳入到Cox 回归分析中(表4,图2)。图2反映出孟鲁司特可能减少患者死亡风险(K‑M 检验:Log‑rankP=0.001)。
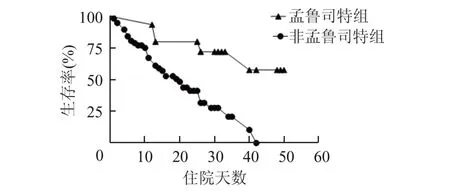
图2 孟鲁司特组和非孟鲁司特组的K⁃M 生存曲线比较
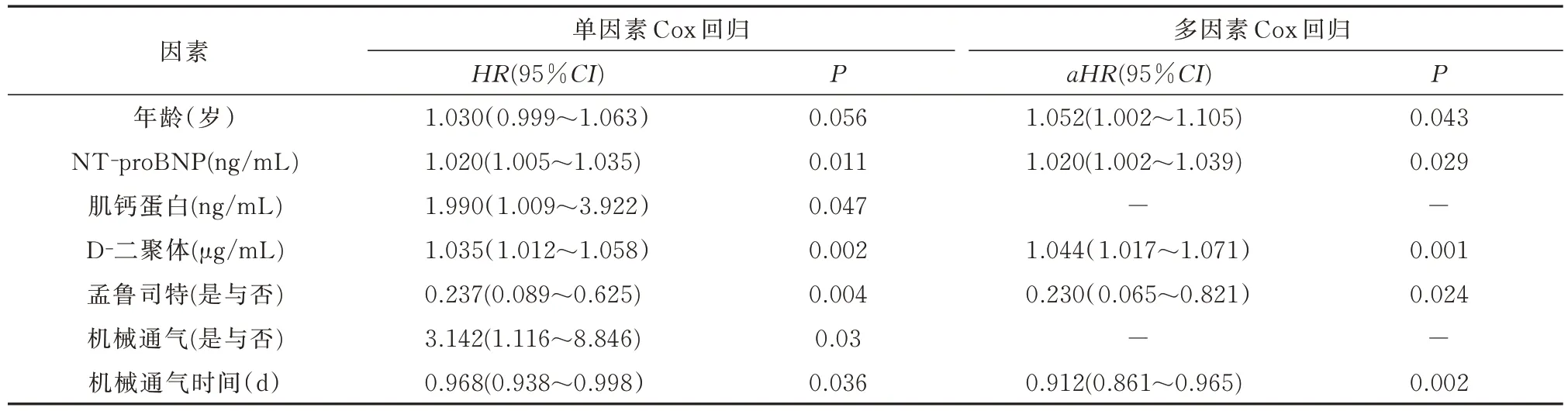
表4 合并呼吸衰竭重症COVID⁃19 患者死亡相关的Cox 回归分析
将多因素Cox 回归的独立危险因素——年龄、NT‑proBNP 和 D‑二聚体作为预测因素,应用 R 语言构建预测模型(图3)。根据这三个独立危险因素各自对临床结局的影响程度赋分,然后再将每个评分进行累加,最后通过总分与临床结局发生概率进行关系转换,从而预测单个患者在不同时间段里的生存率预测值。然后用Calibration 曲线验证1 周、4周和6 周的预测生存率与实际观测值的一致性(图4a)。图4 显示由三个点连接的折线平均分布在对角线附近,说明列线图的预测生存率与实际的临床生存率保持良好的一致性。然后通过ROC 曲线对1 周、4 周和6 周生存率分析,验证列线图的准确性(图 5)。1 周、4 周和 6 周生存率的 ROC 曲线下面积(AUC)分别 为 0.656、0.790 和 0.909,三个模 型AUC值均大于0.5,说明三个预测模型均有临床意义,其中6 周生存率预测模型准确率最高,4 周预测准确率高于1 周预测准确率。

图3 1 周、4 周和 6 周的生存率列线图
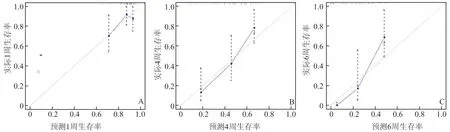
图4 Calibration 曲线验证1 周(A)、4 周(B)和6 周(C)的预测生存率与实际观测值的一致性

图5 预测模型的ROC 曲线
3 讨论
本次研究收集了合并呼吸衰竭的COVID‑19 患者的人口统计学资料、入院后24 h 内临床信息、治疗方案和实验室检查等,统计出与死亡相关的风险因素和保护性因素。并构建出在入院当天能预测合并呼吸衰竭的 COVID‑19 患者 1 周、4 周和 6 周的生存概率模型。
本研究发现并发呼吸衰竭的COVID‑19 患者年龄多在60~89 岁(79.1%),以男性多见,这与之前的报道一致[10],56.9%患者因病情危重转入ICU 治疗,这一比例高于美国疾控中心公布的数据[11]。有42 名患者(58.2%)最终结局以死亡出院,这说明呼吸衰竭可能是导致患者入住ICU 和死亡的原因之一。本研究发现合并呼吸衰竭的重症COVID‑19 患者在使用孟鲁司特后有较高的生存率。孟鲁司特是一种高选择性白三烯受体拮抗剂,该药物可以抑制气道高炎症反应,减少嗜酸粒细胞浸润及微血管渗出的作用[12]。有研究发现该药不仅可以减少动物肺中白细胞介素 13(IL‑13)的水平[13],同时还具有抗病毒的作用[14]。IL‑13 属于 2 型免疫效应分子,其在重型COVID‑19 患者体内的水平要高于轻型患者[15]。另有研究表明IL‑13 可以明显诱导跨膜丝氨酸蛋白酶 2(TMPRSS2)介导的黏液渗出[16],同时还可能增加新型冠状病毒的复制[17]。由此推测,孟鲁司特可能通过抑制IL‑13 降低气道炎症水平及减少气道内渗出,还可能抑制新型冠状病毒复制。在合并呼吸衰竭的COVID‑19 患者血清中还发现有多种细胞因子和趋化因子[如单核细胞趋化蛋白1(MCP‑1)、IL‑8、γ 干 扰 素(IFN‑γ)、和 IL‑17)]升高[18‑21],这些因子可能对加重 COVID‑19 病情具有推动作用。一项孟鲁司特联合甲泼尼龙治疗肺部支原体感染的研究表明,该药可以降低血清中MCP‑1、IL‑8、IFN‑γ 和 IL‑17 的水平[22]。因此,孟鲁司特不仅可能干扰相关细胞因子的活化、选择性地抑制气道白三烯受体以及其下游分子的激活,还可能起到直接抗新型冠状病毒作用及间接抑制病毒复制的作用。目前有关孟鲁司特治疗COVID‑19 的临床研究资料有限,值得进一步临床试验。
机械通气是呼吸衰竭患者的常规性治疗方法。在ICU 病房的80%COVID‑19 患者都接受有创呼吸机治疗[23]。据报告,无创呼吸机可以降低各种原因引起的肺水肿和急性呼吸衰竭的死亡率,早期应用无创呼吸机治疗可以提高生存率[24]。本研究的发现与Bhatraju 等[25]报告的结果相似,延长机械通气时间和延迟拔管对接受有创机械通气的呼吸衰竭患者是有益的。虽然机械通气对生存结果没有影响,但是根据多变量Cox 回归分析,延长机械通气治疗的持续时间可能会增加生存率。总之,机械通气治疗的持续时间延长可能会增加这类患者的生存率。
一些研究发现高龄COVID‑19 患者的病情更容易发展成重型和危重型[10],这些研究也强调了人口统计学特征、临床特征和实验室指标对COVID‑19的重要作用,但很少利用前2 h 的危险因素来预测呼吸衰竭患者在未来几周的生存概率。本研究所建立的列线图是基于三个独立的危险因素,包括年龄、NT‑proBNP 和D‑二聚体。许多研究表明,年龄和 D‑二 聚 体 水 平 是 疾 病 的 独 立 危 险 因 素[26‑28]。COVID‑19 激活血液的高凝性状态,一方面可以引起血栓栓塞性疾病,另一方可能会限制新型冠状病毒播散从而抑制病毒的侵入[29]。此外,D‑二聚体既是COVID‑19 患者发生深静脉血栓(VTE)的预测因子,又是监测抗凝治疗效果的指标[30]。另有研究发现D‑二聚体水平可以反映弥散性血管内凝血(DIC)的风险[31],这可能会导致 VTE 或肺栓塞以及与疾病相关的死亡率。
NT‑proBNP 是一项反映心功能情况的治疗,血清中NT‑proBNP 的升高常提示心肌收缩功能障碍及心肌缺血。有些研究报道在感染SARS‑CoV‑2后,有心血管基础病的患者更容易出现心脏的损害[32],NT‑proBNP 的 升 高 提 示 患 者 可 能 合 并COVID‑19 相关的急性心肌炎和心包炎[33]。还有研究发现,高度系统性炎症的老年COVID‑19 患者往往表现出高血清水平的 NT‑proBNP[34]。BNP 是由心肌细胞合成的心脏利钠肽类物质,与NT‑proBNP等量分泌到循环中。在没有心脏收缩功能障碍的脓毒血症患者体内发现脑钠肽(BNP)水平与血清炎症标志物水平相关[35]。另外,BNP 参与了细胞因子 释 放 综 合 征(CRS)的 毒 性 反 应[36],提 示NT‑proBNP 升高可能是细胞因子风暴的结果。所以,NT‑proBNP 除了反映心脏功能外,还可以作为一个反映COVID‑19 患者炎症状态的指标。最后,将NT‑proBNP 与年龄和D‑二聚体联合应用于呼吸衰竭患者的生存率评估,对于列线图总分高的患者应加强重症监护,以防止严重并发症的发生。
综上所述,高龄、D‑二聚体和 NT‑proBNP 水平升高与合并呼吸衰竭的COVID‑19 患者死亡相关。对于机械通气治疗的患者而言,延长机械通气治疗时间可能会减少死亡的发生。孟鲁司特可能提高这类患者的生存率,建议在发病早期应用。基于年龄、D‑二聚体和NT‑proBNP 的列线图可以预测住院后6 周的生存概率。

