miR⁃144 通过LIS1 抑制胆管癌细胞的增殖和侵袭
华 黎 杨 锐
武汉市第五医院 1体检中心,2血管外科 湖北 武汉 430050
microRNA(miRNA,miR)在生物的生长发育、细胞增殖、分化与凋亡及人类疾病发生发展的过程中发挥重要的调控作用[1,2]。寻找 miRNA 调控的靶基因,并以此为线索研究miRNA 在特定的生理病理过程中的作用,是明确 miRNA 功能所必须的[3,4]。目前有多种生物信息学的方法用于靶基因的预测[5]。
为了明确miR‑144 在胆管癌细胞的具体作用靶点及机制,我们采用生物信息学的方法,利用mi‑Randa、PicTar 和 TargetScan 预测网站预测 miR‑144的靶基因,确定无脑回致病基因LIS1(Lissencepha‑ly 1)是miR‑144 在胆管癌中的作用靶基因,并通过生物学效应的验证,确定miR‑144 的靶基因功能。LIS1 在胆管癌增殖、侵袭转移过程中是一个重要的功能基因。
1 材料与方法
1.1 试剂及细胞培养胆管癌细胞系HCCC‑9810、CCLP1、HuCCT1 和 RBE 购自于中国细胞典藏委员会细胞库;正常胆管上皮细胞系BEC 由日本Hiromi Ishibashi 馈赠;DEME、RPMI‑1640 高糖培养液、胰酶购自于Hyclone 公司;胎牛血清购自于GIB‑CO 公司;胆管癌细胞系于37 ℃ 5% CO2条件下,以含 10% 胎牛血清(FBS)(Invitrogen)及 100 U/mL青霉 素的 DEME 或 RPMI‑1640 培养 液培养 ;BEC细胞培养液配置如下:Ham′s F12 和 DEME 等体积混合,5%胎牛血清、表皮生长因子10 ng/mL、氢化可的松 0.4 µg/mL、三碘甲状腺原氨酸 1.3 µg/mL、转化因子 5 µg/mL、胰岛素 5 µg/mL、腺嘌呤 24.3µg/mL、肝细胞生长因子10 ng/mL。双荧光报告系统 检 测 试 剂 盒(Promega 公 司 )、SYBR®PrimeScript ™miRNA RT‑PCR Kit(Takara 公司)、NotⅠ和XhoⅠ限制性内切酶(Thermo Scientific 公司)、Psi‑check2(Promega 公司)、FastStart Universal SYBR Green Master(Rox)(Roche 公司)。anti‑miR‑144 或 anti‑miRNA 抑制剂对照(NC)(Applied Bio‑systems 公司)。
1.2 方法
1.2.1 构建含有靶基因LIS1 3′UTR 的重组质粒在人胆管癌细胞CCLP1 基因组中克隆LIS1 3′UTR序 列 的 引 物(5′—3′)。 上 游 引 物 :AAACTC‑GAGTTGTGTCTCCTTCGGCCC(含XhoⅠ酶切位点),下游引物:AAAGCGGCCGCGGCATTTA‑ATAGTTTACCAGTTGGT(含NotⅠ酶切位点)。PCR 反应条件:98 ℃,30 s;98 ℃,10 s,55 ℃,1 min,72 ℃,1 min,32 个循环,循环结束后 72 ℃延伸 5 min。 PCR 产 物 以 Psi‑check2 双 酶 切 ,酶 切 条 件 :37 ℃,1 h,电泳、胶回收后,将目的片段 LIS1 3′UTR和 Psi‑check2 片段进行连接,连接条件:室温,3~4 h。行质粒的转化和提取,最终质粒送测序鉴定。
1.2.2 构建含LIS1 3′UTR 位点突变的重组质粒突变质粒构建引物序列分别为,突变1:上游5′‑GT‑GAATCCAAATTGTATACTGTAAATTTACA‑ TACGTTGTCTAGA ‑ 3′,下 游 5′ ‑ TCTAGA‑CAACGTATGTAAATTTAGACCCTACAATT‑TGGATTCAC‑3′;突变 2 序列:上游 5′‑TAAA‑CAGGTCAAAAAAGGGTCTCATACTCTAAG‑CTTCTATTTTC‑3′,下 游 5′‑GAAAA ‑TAGA ‑AGCTTAGAGTATGAGACCCTTTTTTGACC‑TGTTTA‑3′。PCR 反应条件:98 ℃,30 s;98 ℃,10 s,55 ℃,1 min,72 ℃,1 min,32 个循环,循环结束后72 ℃延伸5 min。酶切:在上述PCR 反应体系中加入 1 µLDpnⅠ酶,37 ℃,4 h 后,65 ℃,10 min 灭活。转化、挑菌送测序鉴定突变成功后,大提质粒,获得LIS1‑UTR‑MUT、LIS1‑UTR‑MUT1、LIS1‑UTR‑MUT2 三种突变的质粒。
1.2.3 转染(质粒或 siRNA) si‑LIS1 的序列(5′—3′):UGACCAUUAAACUAUGGGAUU;对照序列(NC):AACGUACGCGGAAUACUUCGA,细胞融合度达到60%~70%时进行转染。
1.2.4 双荧光素酶报告基因的检测 HEK‑293T细胞种植于24 孔板中,融合度大约60%~70%时转染相应质粒,后继续培养36 h。弃上清,以预冷的PBS 洗 涤 细 胞 2 次 。 每 孔 加 100 µL PLB(Passive lysis buffer)裂解液,室温摇床震荡30 min,吹打混匀裂解细胞。取30 µL 细胞裂解产物于EP 管中,加入45 µL 配 置 好 的 LAB Ⅱ(Luciferance Assay BufferⅡ)溶液,混匀后检测萤火虫荧光的强度。
取 45 µL 按要求配置的 1×Stop&Glo substrate溶液,混匀后检测海肾素荧光的强度。将所得的数据经萤火虫荧光标准化后分析结果。
1.2.5 RNA 的提取、逆转录和PCR 逆转录条件:37 ℃,60 min;85 ℃,5 s;转录产物分装好放置于-20 ℃冻存备用。RT‑PCR 反应条件:95 ℃,10 s;95 ℃,5 s,58 ℃,30 s,40 个循环。
1.2.6 CCK8 检测细胞增殖 收集对数生长期的细胞,以含10%FBS 的DMEM 高糖培养液稀释细胞,调整细胞的浓度。96 孔板内最外围的孔内加无菌的 PBS 200 µL,实验孔每孔加 4×103个细胞,体积100 µL。培养至相应的时间点后,每孔加CCK8 10 µL,以加了相应量培养液和CCK8 试剂但是没有加细胞的孔作为空白对照。细胞培养箱内继续培养0.5~4 h。450 nm 波长处测量吸光度。
1.2.7 划痕实验 于6 孔板背后以记号笔均匀划横线,每隔1 cm 划一道,横穿过孔,每孔划5 条线。每孔接种约5×105个细胞,每组设3 个复孔。细胞培养过夜后,以200 µL 的枪头垂直于背后的标志线划痕,以PBS 润洗细胞3 次,去掉脱落的细胞,加入无血清培养液,于显微镜下拍照,在标记线与划痕交界处测量出0 h 的划痕宽度,然后放置于37 ℃、5% CO2培养箱中继续培养。连续观察细胞的迁移情况,选择不同的时间点拍照,软件计算划痕愈合的面积,进行统计学分析。
1.2.8 Transwell 实验 将冻存于-20 ℃冰箱中的Matrigel 放置于4 ℃过夜,基质胶溶解为液态后备用。基质胶和无血清培养液按1∶5 稀释,每孔加入50 µL 稀释后的基质胶,均匀铺满内室的底部,避免气泡的产生,37 ℃培养箱中放置1~2 h。对数生长期细胞消化后以无血清培养液重悬、计数。每孔加入细胞悬液100 µL,约含细胞1×105个。下室内加入500 µL 含10%胎牛血清的完全培养液。37 ℃培养箱中继续培养24~48 h。达到培养时间后,用棉签擦去上室内的基质胶和细胞,以PBS 洗涤2 次。室温下以4%的多聚甲醛固定15 min。PBS 洗2 次后,加入0.1%的结晶紫染色20 min,以PBS 漂洗3次以上,脱去非特异性染色。倒置显微镜下观察,随机选取多个视野统计并拍照。
1.2.9 Western Blot 将培养好的胆管癌细胞用预冷的PBS 溶液洗2 次,胰酶消化后收集到离心管中,4 ℃ 1 200 r/min,5 min。去上清,用 2 mL 预冷 PBS溶液清洗细胞,4 ℃ 1 200 r/min,5 min,共 2 次。以每 5×106个细胞用 400 µL 含 PMSF 的 RIPA 裂解液(1∶100),重悬细胞,吹打混匀,置于冰上裂解约30 min,期间间断振荡。4 ℃,12 000 r/min,10 min。取上清到洁净的1.5 mL EP 管中,100 ℃水浴5 min,充分变性蛋白质样品,蛋白样品保存于-80 ℃。BCA 法处理样品,酶联免疫检测仪测定各样品的吸光度,根据吸光度值计算样品的蛋白浓度和每孔样品的上样量,确保每孔蛋白上样量一致。
1.3 统计学方法应用SPSS 22.0 统计软件进行数据处理。计量资料用表示,组间差异采用t检验。所有结果以P<0.05 为差异有统计学意义。
2 结果
2.1 miR⁃144 靶基因序列及突变序列通过公共数据库(miRanda、PicTar 和 Target Scan)分析,其结果用单因素方差分析进行匹配以获得最终的靶基因,我们发现 LIS1 的 3′UTR 存在两个 miR‑144 的可能结合位点(见图1A、B),根据结合位点我们构建了两个突变的质粒,位点突变后的序列见图1C、1D。

图1 miR⁃144 序列和LIS1 3'UTR 可能的结合位点序列
2.2 miR⁃144 对LIS1 报告基因的影响在HEK‑293T 细胞中共转染野生型 LIS1 3′UTR 报告载体质粒 Vector 或 PCDH‑miR‑144,荧光素酶活性的检测结果表明,miR‑144 显著降低 LIS1 3′UTR 的活性(图 2A)(P<0.01)。而完全突变型 LIS1 3′UTR 报告载体两组之间无明显差异,突变其中任何一个结合位点,miR‑144 过表达仍然可以使荧光素酶的活性降低(图 2B、2C)(P<0.05),但降低的程度较未突变组低,说明两个结合位点都影响荧光素酶活性的表达,第一个结合位点的作用更强大。而两个结合位点都突变后,miR‑144 的过表达则不影响荧光素酶的活性(图2D)(P>0.05)。

图2 miR⁃144 对LIS1 3'UTR 荧光素酶活性的影响
2.3 过表达miR⁃144 对LIS1 mRNA 和蛋白表达水平的影响在转染野生型LIS1 3′UTR 报告载体质粒 Vector(miR‑144 正常表达)及 PCDH‑miR‑144(miR‑144 过表达)后的胆管癌细胞系中检测LIS1 mRNA 和蛋白的表达水平,结果显示,在胆管癌细胞株 HCCC‑9810 和 CCLP1 中,miR‑144 显著降低LIS1 mRNA 的表达(图 3A)(P<0.01),同时显著降低LIS1 蛋白的表达水平(图3B)。

图3 过表达miR⁃144 对LIS1 mRNA 和蛋白表达水平的影响
2.4 低表达miR⁃144 对LIS1 mRNA 和蛋白表达水平的影响通过在胆管癌细胞HuCCT1 和RBE中转染 anti‑miR‑144 后,24 h 后检测细胞内 LIS1 的mRNA 表达水平的变化(图4A),可见转染anti‑miR‑144 后 LIS1 的表达水平明显增高(P<0.05);48 h后检测细胞内LIS1 的蛋白表达水平的变化,LIS1表达量明显增高(图4B)。
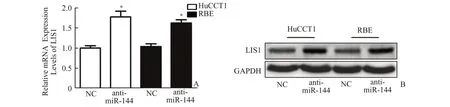
图4 低表达miR⁃144 对LIS1 mRNA 和蛋白表达水平的影响
2.5 si⁃LIS1 效果的验证在 HCCC ‑9810 和CCLP1 胆 管 癌 细 胞 中 转 染 si‑LIS1 序 列 ,检 验 si‑LIS1 的效果,Western Blot 实验结果显示,在两种胆管癌细胞中两条 si‑LIS1 均有效应(图 5),si‑LIS1‑2效果更明显,后续的实验我们采用si‑LIS1‑2,进一步的研究其他的生物学功能。

图5 Western Blot 验证 si⁃LIS1 的效果
2.6 si⁃LIS1 对胆管癌细胞增殖的影响在HCCC‑9810 和 CCLP1 细胞中转染 si‑LIS1,通过 CCK8 实验检测si‑LIS1 对胆管癌细胞增殖的影响,以测得的OD 值减空白对照组OD 值即为细胞相对数的值。结果显示si‑LIS1 可以显著抑制胆管癌细胞的增殖能力。在HCCC‑9810 细胞中转染NC(阴性对照)和 si‑LIS1,48 h 后 细 胞 相 对 数 分 别 为 0.663±0.076、0.950±0.132(P<0.05),培养 72 h 后细胞相对数分别为 1.220±0.167、1.650±0.151(P<0.05)(图 6A)。NC 和 si‑LIS1 细胞中,培养 48 h 后细胞相对数分别为 0.661±0.114、0.980±0.114(P<0.05),培养72 h 后细胞相对数分别为1.213±0.170、1.823±0.137(P<0.05)(图 6B)。si‑LIS1可以获得miR‑144 过表达同样的生物学效应。

图6 低表达LIS1 后对胆管癌细胞增殖的影响
2.7 si⁃LIS1 对胆管癌细胞迁移的影响胆管癌细胞中转染 NC 和 si‑LIS1 后行划痕实验,分别于 0 h、36 h 拍照(图7A、7B),实验结果显示:HCCC‑9810细胞中,36 h 后 si‑LIS1 组细胞的迁移面积同 NC 组相比较减少(57.67±5.13)%(P<0.01),CCLP1 细胞中,细胞的迁移面积同NC 组相比较减少(49.0±7.55)%(P<0.01)(图 7C)。

图7 si⁃LIS1 后对胆管癌细胞迁移能力影响
2.8 si⁃LIS1 对胆管癌细胞侵袭的影响转染NC和 si‑LIS1 后的胆管癌细胞系行侵袭实验,36 h 后光镜下拍照显示(图8A),胆管癌细胞中LIS1 表达减少后细胞的侵袭数明显减少;统计学分析显示,同NC 组相比较,si‑LIS1 组的 HCCC‑9810、CCLP1 细胞侵袭能力分别减少(47.67±6.11)%(P<0.05)、(54.33±9.02)%(P<0.05)(图8B)。

图8 si⁃LIS1 后对胆管癌细胞侵袭能力影响
2.9 si⁃LIS1 对胆管癌细胞增殖和转移相关指标的影响胆管癌细胞中转染 NC 和 si‑LIS1,48 h 后提取细胞总蛋白,检测增殖、转移信号通路相关的生化指标 MMP‑2 和 p‑AKT,发现 si‑LIS1 明显下调MMP‑2 和 p‑AKT 的表达,AKT 的含量则没有明显变化。见图9。

图9 Western Blot 验证 si⁃LIS1 对 MMP⁃2、p⁃AKT、AKT 表达的影响
3 讨论
LIS1 是血小板激活因子乙酰化酶(platelet‑acti‑vating factor acetylhydrolase 1b,PAFAH1B)的一个调节亚基,因而也被命名为 PAFAH1B1[6]。
LIS1 参与多种蛋白质‑蛋白质之间的相互作用,因而LIS1 的水平与多种细胞活动相关联[7]。LIS1 蛋白N 末端由LisH 域和卷曲螺旋结构域构成,这一结构对蛋白质的二聚化起着重要作用[8,9]。紧接着是7 个WD 重复单位,这种重复为蛋白质间的相互作用提供平台[10]。生化分析显示,当LIS1 与Ndel1 相互作用时,LIS1 和催化亚基 PAFAH‑1B 之间不能相互作用[10]。大多LIS1 已知的活性与胞浆内分子马达动力蛋白相互作用有关。很多与LIS1相互作用的蛋白是动力蛋白的调节因子,包括Ndel、Ndel1、CLIP‑170 等[7,11]。胞浆动力蛋白是一种大而又复杂的微管相关的分子马达,向微管的反方向运动,在神经元中是主要的逆行运动的马达[12,13]。胞浆动力蛋白中研究的最透彻的是LIS1和dynactin,二者的活动似乎是一致的[14]。
LIS1 是 一 种 参 与 神 经 迁 移 失 调 的 基 因[15,16]。无脑回‑巨脑回畸形疾病谱包括多种导致大脑表面光滑度增加或无脑回、巨脑回畸形的疾病。这些大脑畸形反映严重的人类染色体17p13.3 区LIS1 半合子的缺失,部分原因是由于在大脑发育过程中神经迁移功能的破坏。正常的6 个皮层的消失,取而代之的是4 个皮层[17]。神经元在大脑皮层中的位置取决于他们形成的日期和正确的运动。LIS1 的含量对正常大脑的发育影响非常敏感。LIS1 的数量低于正常量的一半时会引起脑回缺失,含量过高则导致认知功能的障碍[18]。LIS1 的部分重复则会导致不同的表型,如小头畸形、神经发育延迟、脑白质萎缩等[19]。
LIS1 蛋白含量丰富,在多种组织,不同的发育阶段均有表达。通过对人类和小鼠大脑表型进行分析,发现神经细胞对LIS1 的含量更加敏感。实际上,LIS1 与其结合蛋白Nde1 或Ndel1 在神经元动力蛋白的运输中活动活跃,而在非神经元中活动并不明显[20,21]。在大鼠皮层神经元注射 LIS1 抗体,或者在海马神经元中RNAi 干扰LIS1 的表达严重的影响了神经元细胞中囊泡的运输[22]。在成人背根神经节神经元中也发现了相似的结果,在LIS1 敲除鼠中,LIS1 的敲除优先抑制大囊泡的运输。LIS1 的过表达提高了大、小细胞器逆行运输的速度和延伸的能力[21]。
LIS1 在肿瘤发展中的作用的相关研究近年来也陆续报道。以LIS1 为作用靶点,治疗神经母细胞瘤,维甲酸通过降低人神经母细胞瘤细胞LIS1 的含量,从而降低神经母细胞瘤迁移和侵袭的能力[23]。LIS1 在肝细胞癌中起着抑癌基因的作用,在肝细胞癌中LIS1 表达下调,过表达LIS1 后可以抑制肝细胞癌的增殖和迁移能力[24]。Lo 等[25]的研究通过免疫组化的方法检测肺癌患者LIS1 蛋白的表达含量,发现在亚洲人和白人中LIS1 蛋白的过表达率分别达到68%和70%。进一步的研究发现,LIS1 的过表达与肺癌的肿瘤发生、差的预后相关联,这种作用是通过干扰肺癌细胞的微管网络和胞外多聚纤连蛋白的聚合,从而促进肺癌细胞的迁移和侵袭[26]。
LIS1 参与多种细胞活动,包括细胞增殖、细胞迁移和细胞运输。LIS1 活性的多样性与其发挥作用过程中的枢纽位置相关,也与它在分子马达形成重要的复合物相关联。对其分子机制的理解有利于我们对其在人类疾病中的作用。在未来随着研究的深入,LIS1 越来越多的功能将被发现。
本研究中,我们发现LIS1 是miR‑144 直接的作用靶点,miR‑144 通过靶定 LIS1,在 mRNA 水平和蛋白水平均降低LIS1 的表达。而这种作用可以通过荧光素酶报告基因的检测所验证,在LIS1 mRNA 的 3′UTR 有两个 miR‑144 的结合位点,突变这两个结合位点后,miR‑144 对LIS1 的调控作用则消失。为了证明miR‑144 对LIS1 的直接调控作用,我们通过si‑LIS1 的技术,检测干扰LIS1 的表达后能否获得miR‑144 过表达相同的生物学效应,发现外源性干扰LIS1 表达后,胆管癌细胞的增殖能力同样受到抑制,同时胆管癌细胞的迁移和侵袭的能力也下降,进一步证实miR‑144 过表达引起胆管癌增殖抑制、迁移和侵袭能力下降是通过靶定LIS1 实现的。同时对增殖和侵袭迁移相关信号通路的的检测发现,miR‑144 过表达或干扰LIS1 都可以使p‑Akt 和 MMP‑2 的蛋白表达量下降。
在体外的研究中,我们已经证明miR‑144 通过 靶 定 LIS1 调控下游 信 号分子 p‑Akt 和 MMP‑2的表达,从而抑制肿瘤的增殖、侵袭和迁移的能力。体内是否有相同的效应,需要进一步的实验来验证。

