沙门氏菌中主要毒力因子的研究进展
刘理慧 储锦华 隋雨欣 陈杨 程古月,2
(1. 华中农业大学农业部畜禽产品质量安全风险评估实验室(武汉),武汉 430070;2. 华中农业大学国家兽药残留基准实验室(HZAU)农业部食品兽药残留检测重点实验室,武汉 430070)
沙门氏菌作为重要的致病菌之一,可以通过污染多种食物感染包括人类在内的多种宿主。其血清型众多,目前已经发现2 600多种血清型。沙门氏菌(Salmonella)的血清型分为邦戈尔沙门氏菌(S.bongori)和肠道沙门氏菌(S. enterica)两个种,后者包括6 个亚种,除enterica亚种分离自温血动物以外,其他亚种(salamae、arizonae、diarizonae、houtenae和indica)一般来自于冷血动物和环境。不同血清型的沙门氏菌对人和动物的致病性不同。沙门氏菌的致病性是由于大量毒力相关因子相互作用的结果,主要有毒力岛毒力因子、质粒毒力因子、结构性毒力因子(包括菌毛和鞭毛)、肠毒素毒力因子等。本文综述了沙门氏菌主要的毒力因子以及各自编码的分泌系统和/或毒力基因及其功能,并讨论了全基因组测序(WGS)预测沙门氏菌毒力的可行性,有助于了解沙门氏菌中各种毒力因子及相关基因在致病性中的分子特征和作用,便于从源头上控制沙门氏菌病。
1 沙门氏菌毒力岛毒力因子
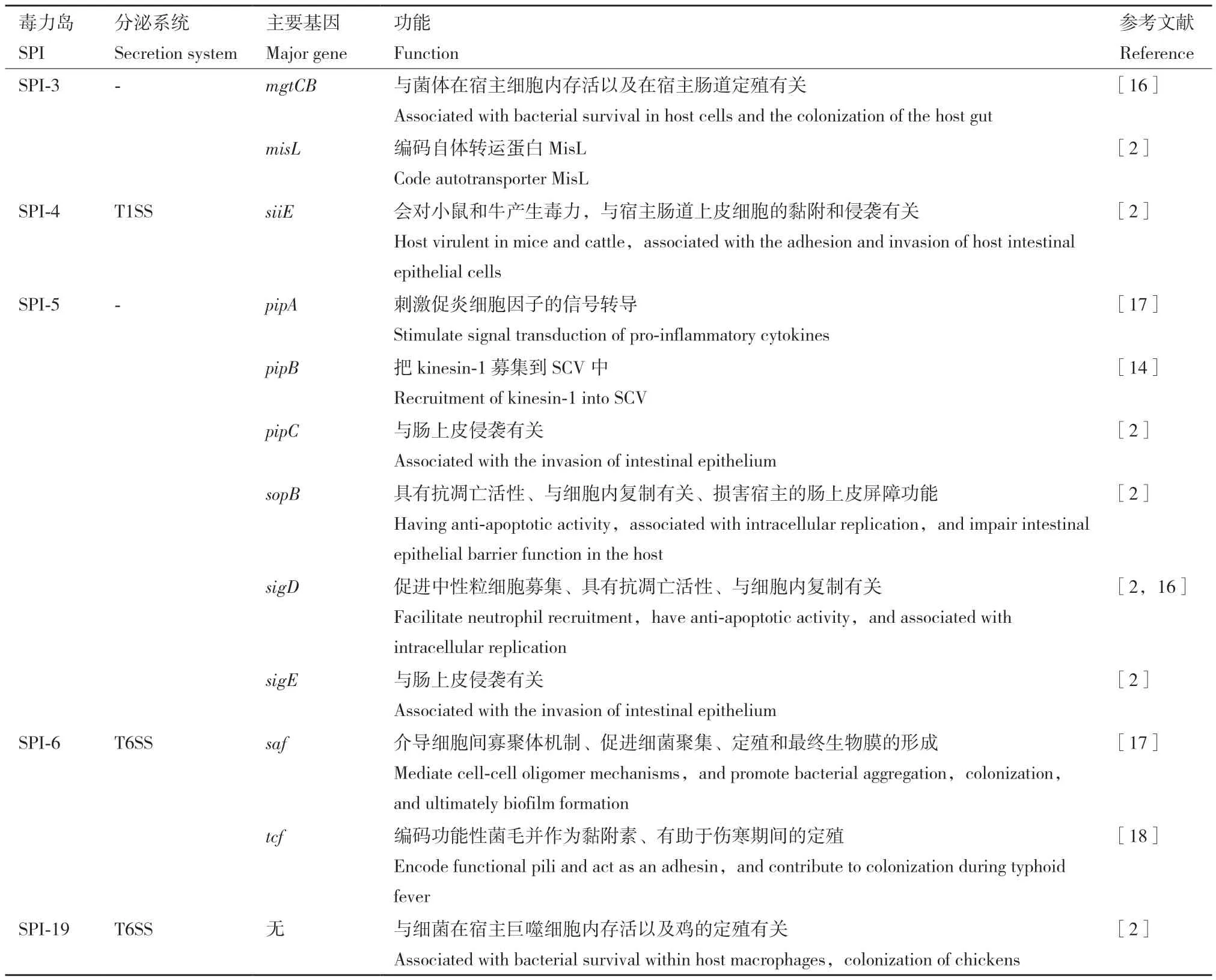
沙门氏菌毒力岛(Salmonella pathogenicity island,SPI)是一段含有毒力相关基因的、不稳定的位于染色体上的DNA片段。目前为止,已经发现24 个SPI,研究最广的为SPI-1-SPI-6以及SPI-19(表1)。其中,参与肠道感染阶段的毒力基因位于SPI-1和SPI-2中,其余的SPI参与沙门氏菌在宿主细胞内存活、菌毛表达、镁和铁摄取、多重抗生素耐药性和全身感染发展等生理学过程[1]。
1.1 SPI-1
SPI-1大小为43 kb,含有47个基因,分别为invABCEFGHIJ、spaOPQRS、sicAP、iacBP、iagB、sitABCD、sprAB、prgHIJK、orgABC、avrA、sipABCD、sptP、sopABDD2EE2以及hilACD。其中有31个基因编码一种III型分泌系统(type III secretion system,T3SS)T3SS1,包括19个T3SS结构基因(spaOPQRS、invACGJI、prgHIJK、sipBCD、orgAB)和 12 个 T3SS效应基因(avrA、sipABCD、sptP和sopABDD2EE2)。调节SPI-1的基因有的位于SPI-1内(如hilACD和invF), 有 的 位 于 SPI-1外( 如 rtsA、barA、sirA、csrA、leuO和fliZ等)。目前在与沙门氏菌致病力的相关性方面研究最多且最为清楚的基因有avrA、iacB、invB、sicA、sicP、sipABC、sptP,它们通过参与细菌侵入宿主细胞,引发肠道炎症及诱导巨噬细胞凋亡的过程来影响沙门氏菌的毒力(表1)。

表1 沙门氏菌毒力岛及其编码的分泌系统、主要基因以及基因功能Table 1 Salmonella pathogenicity island and encoded secretion system,major gene,and gene function
续表(Continued)
目前,还有少数SPI-1基因的功能不太清楚。Lerminiaux等[19]发现SPI-1 TS33的效应蛋白SopD影响多种信号和蛋白质相互作用,并有助于沙门氏菌对宿主的感染以及胃肠炎的发展。此外,对SPI-1外的调节因子的研究也取得一定进展。人们发现SPI-1外的正调节因子loiA对负调节因子lon的抑制利于鼠伤寒沙门氏菌对小鼠肠上皮细胞的入侵和毒性的发挥[20]。谷氨酰胺合成酶基因glnA通过上调fliZ、hilA和 hilD 水平改善 SPI-1 相关效应基因的表达,如sopA、sopB、sopD和 invF[21]。同时已发现一些小分子化合物对SPI-1的调节有影响。氯化血根碱是一种假定的 SPI-1 抑制剂,可抑制沙门氏菌对宿主细胞的侵袭[22]。甲硫腺苷通过抑制 invF 和 sipB的表达降低沙门氏菌的毒力[23]。生物素 a 是红三叶、卷心菜、苜蓿和其他一些草药膳食补充剂中发现的主要异黄酮成分,可抑制sipA、sipB、sipC、hilA和hilD 的表达,并通过下调 SPI-1 表达逆转巨噬细胞极化[24]。这些化合物和药物可能对沙门氏菌感染的宿主细胞具有免疫调节作用并调节其杀菌活性,是有前景的新型抗沙门氏菌药物。
1.2 SPI-2
SPI-2大小为40 kb,含有72个基因[25],分别为 ssaBCDEGHIJKLMNOPQRSTUV、ssrAB、sscAB、sseABCDEFGHIJK1K2K3、pipBB2、steABCDE、sifAB、slrP、srgE、cigR、sspH1H2、srfJ、gtgAE、gogB、sopDD2、spiC、spvBCD、ttrABCRS以 及 7 个 功 能未知的开放阅读框 orf32、orf48、orf70、orf242、orf245、orf319、orf408。其中有54个基因编码另一个III型分泌系统T3SS2[26],包括20个T3SS结构基因(ssaBCDEGHIJKLMNOPQRSTUV),32个 T3SS效 应 基 因(sseFGHIJK1K2K3、pipBB2、steABCDE、sifAB、slrP、srgE、cigR、sspH1H2、srfJ、gtgAE、gogB、sopDD2、spiC、spvBCD),2 个 T3SS 调节基因(ssrAB)。目前在与沙门氏菌致病力的相关性方面研究最多的基因为ssaBE、sscAB、sseLFG、ttr,它们与细菌引发宿主全身性感染和在巨噬细胞内的存活及复制有关。最新研究表明,在发生氧化应激的沙门氏菌中诱导 SPI-2 基因有助于巨噬细胞内病原体对抗 NOX2 黄素血蛋白的抗菌活性,其依赖于DksA、DnaJ和 DnaK 蛋白的协调调控[27]。
以往的研究表明,沙门氏菌致病力的强弱和SPI-2中的sseL基因密切相关,致死率高的沙门氏菌均携带sseL基因,而致病力相对较弱的沙门氏菌则没有检出该基因[14]。由于基因存在水平转移,细菌的致病性开始进化,Pérez-Morales等[28]证实SPI-2编码的转录调节因子ssrB在细胞内感染阶段抑制SPI-1的表达,这有助于沙门氏菌向细胞内生活方式的转变。2020年,Jiang等[29]揭示了SPI-2外一种新的调节因子pagR,它可以通过上调SPI-2内的调节因子slyA的表达而增强鼠伤寒沙门氏菌的系统毒性。
1.3 SPI-3
SPI-3大小为17 kb,包含sugR、rhuM、rmbA、misL、fidL、marT、slsA、cigR、mgtB和mgtC 10个基因,目前在与沙门氏菌致病力的相关性方面研究最多且最为清楚的基因为misL和mgtBC,它们与沙门氏菌在宿主的肠道定殖以及细胞内存活有关。misL 过表达增加了鼠伤寒沙门氏菌生物膜的形成,misL缺失降低了细菌对 HeLa 细胞的黏附和侵袭能力,但不影响细菌毒力[30]。研究表明,毒力蛋白MgtC介导的磷酸转运途径是沙门氏菌正常发病机制所必需的,去除MgtC对磷酸转运能力的影响会使沙门氏菌具有高致病性[31]。
1.4 SPI-4
SPI-4大小为27 kb,包含siiABCDEF 6个基因。目前的研究集中于siiE基因,它与沙门氏菌对宿主上皮细胞的黏附和侵袭有关。目前已发现一些相关的临床应用价值,如siiE减毒缺陷型沙门氏菌可诱导特异性IgG的高持久滴度并可作为有效疫苗使用[32]。SPI-4可能携带参与毒素分泌的Ⅰ型分泌系统(Type I Secretion System,T1SS),当其缺失时,鼠伤寒沙门氏菌对肠炎小鼠的口服毒力减弱[33]。
1.5 SPI-5
SPI-5大小为7.6 kb,包含pipABCD、sopB、sig-DE等基因,它们与沙门氏菌在宿主的肠道定殖有关。最近研究发现pipA可以通过T3SS非依赖性机制诱导鼠伤寒沙门氏菌系统感染阶段的细菌传播[34]。sopB基因是SPI-5上重要的毒力基因,其编码的SopB蛋白可以特异性地阻止ASC寡聚,并抑制炎症小体的产生[35],同时介导Rho-GTPases向细菌入侵位点募集[36]。作为效应蛋白SopB的同源物,SigD可以激活原癌基因akt,从而调控沙门氏菌在宿主细胞中的增殖和存活[37]。
1.6 SPI-6、SPI-19以及T6SS
SPI-6大小为59 kb,目前对编码菌毛的saf和tcf基因的研究最多,它们有助于沙门氏菌在宿主中的成功定殖。SPI-19位于沙门氏菌染色体上,大小为45 kb,目前还没有人对SPI-19上的基因进行系统研究。另外,SPI-6和SPI-19与Ⅵ型分泌系统(typeⅥ secretion system,T6SS)密切相关,T6SS由13 个核心结构蛋白(TssABCEFGJKLM、VgrG、Hcp及ClpV)组成[38]。到目前为止,编码T6SS的5个SPI(SPI-6、SPI-19、SPI-20、SPI-21 和 SPI-22) 已经差异分布在2 600多个沙门氏菌血清型中[39]。其中,鼠伤寒沙门氏菌需要以SPI-6/T6SS依赖的方式杀死共生细菌才能在肠道中成功定殖[40],解除SPI-6/T6SS中H-NS组蛋白的沉默,将利于鼠伤寒沙门氏菌成功感染宿主[41]。此外,SPI-6 鼠伤寒沙门氏菌 VirG 样蛋白(STV)作为LTxxQ应激蛋白家族的一员通过协助病原体在巨噬细胞内存活,在沙门氏菌发病机制中发挥重要作用[42]。SPI-19多存在于鸡白痢沙门氏菌血清变种中,含有SPI-19的鸡白痢沙门氏菌在鸡肠道的定殖增多[43],这是由于SPI-19/T6SS参与介导宿主Th1和Th2免疫应答的抑制,导致该菌的持续定殖。
2 其他毒力因子
除了SPI,沙门氏菌的毒力相关基因还分布在毒力质粒、菌毛、鞭毛以及肠毒素中(表2),这些毒力基因也在宿主中发挥广泛的生理作用。
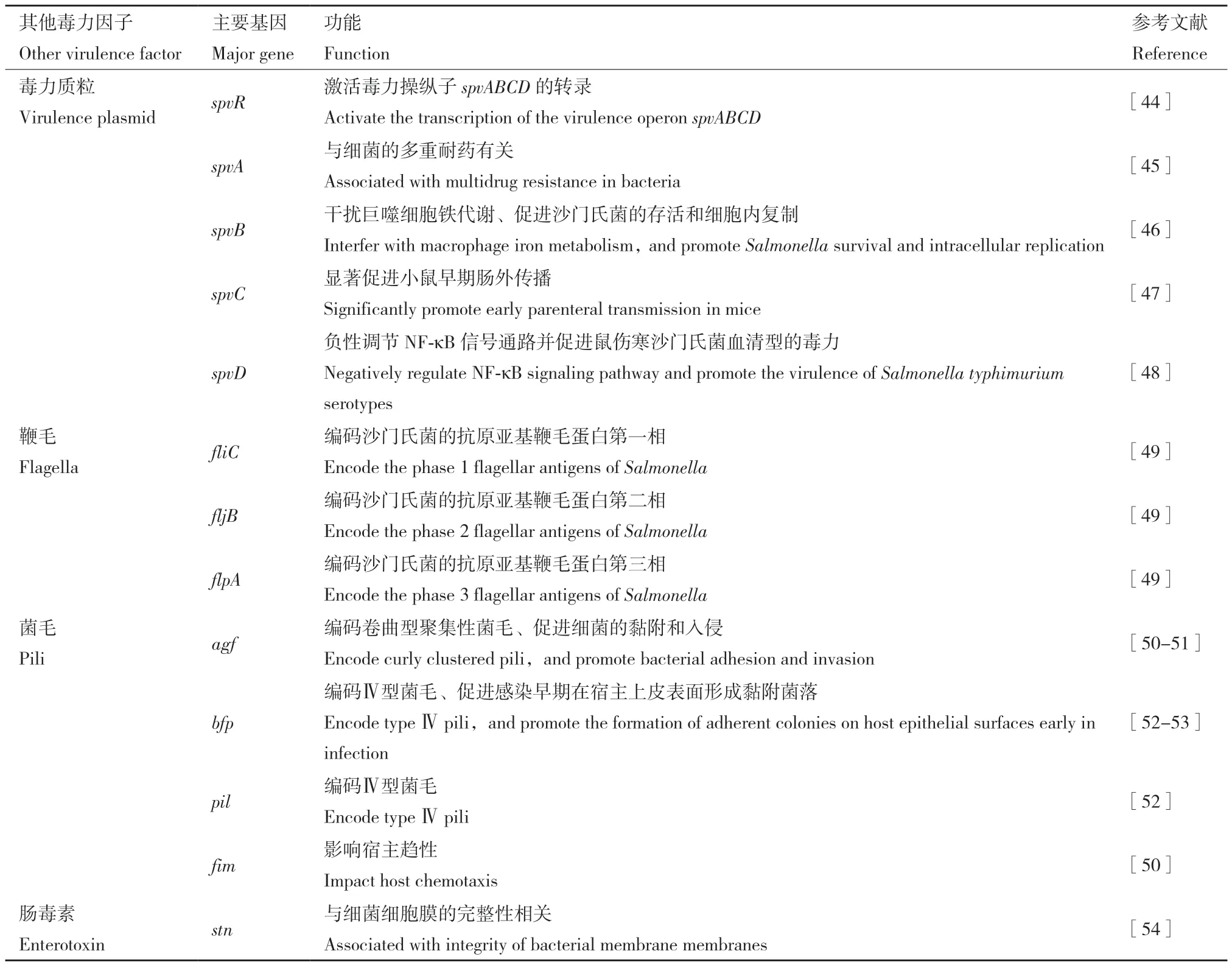
表2 沙门氏菌其他毒力因子中主要的基因及功能Table 2 Major genes and functions in other virulence factors of Salmonella
2.1 毒力质粒毒力因子
沙门氏菌毒力质粒(Salmonella virulence plasmid)spv操纵子大小为6.8 kb,广泛存在于临床重要血清型沙门氏菌中,含有spvRABCD 5 个基因,主要与血清抗性、黏附与定居、沙门氏菌在肠外组织细胞以及巨噬细胞内存活和生长等有关[55]。其中,spvB基因与沙门氏菌的致病性密切相关,可以干扰自噬和铁稳态[46],还可以通过细胞旁途径使细菌在宿主的肠上皮屏障中移位,促进沙门氏菌的系统传播[44]。
2.2 结构性毒力因子
在细菌感染过程中,菌毛对宿主的识别、定殖和生物膜的形成至关重要,被认为是介导沙门氏菌与宿主肠上皮相互作用和黏附的主要细胞器,其主要包含agf、bfp、pil、fim等基因。
在肠道沙门氏菌用来定殖宿主组织的各种菌毛结构中,Ⅰ型菌毛研究最为广泛。研究发现Ⅰ型菌毛表达水平的增加与沙门氏菌对肠上皮细胞黏附水平的提高直接相关[56],其不仅表明Ⅰ型菌毛在沙门氏菌感染初期的重要性,还明确了其在感染过程中的确切作用。
沙门氏菌的鞭毛使其能在波动环境中前行[57],其主要包含fliC、fljB、flpA等基因。Horstmann等[58]发现,鞭毛蛋白甲基化后有助于鼠伤寒沙门氏菌黏附到宿主细胞表面进而定殖肠道引发宿主感染。
值得注意的是,鞭毛、菌毛和SPI-1 T3SS在细菌感染的各个阶段是以严格定义的顺序进行表达的。沙门氏菌经口感染后,首先利用鞭毛移动到肠上皮细胞附近定殖肠腔,再利用菌毛进行细胞附着和肠黏膜定殖,最后利用SPI-1 T3SS进行入侵。
2.3 肠毒素
沙门氏菌的外毒素可分为细胞毒素和肠毒素两种类型。其中stn基因是鼠伤寒沙门菌感染机制中一个较为重要的毒力因子,它可以通过调节OmpA膜的定位来维持细菌细胞膜的组成和完整性,从而增强菌株致病性[59]。当菌株的stn基因发生突变时,小鼠的肠腔分泌能力明显比野生菌株的弱[60]。
2.4 毒力基因与毒力的关系
毒力表示病原菌致病力的强弱,其最具实用性的测定方法是半数致死量(LD50)和半数感染量(ID50)。沙门氏菌的毒力主要是由于大量毒力因子相互作用的结果,诸多研究均证明了沙门氏菌的毒力与毒力基因存在一定联系(表3)。不同国家、国内不同省份(自治区,直辖市)的不同来源的沙门氏菌毒力基因携带情况具有差异,且一般菌株的致病性越强,其携带的毒力基因的种类和/或数量越多。

表3 国内外沙门氏菌中毒力基因的流行情况及与毒力的关系Table 3 Prevalence of Salmonella virulence genes at home and abroad and their relationship with virulence
3 全基因组测序预测毒力
沙门氏菌的毒力主要是大量毒力因子相互作用的结果,由于不同的血清型在不同的位置包含不同的SPI集合,沙门氏菌基因组、血清型和毒力的高度多样性从而增加了沙门氏菌感染的复杂性[69-70]。病原体的全基因组测序(WGS)已成为一种成本更低,更易于使用的基因分型工具,提供了许多基因分析的可能性。
WGS结合其他基因组学方法在研究食源性疾病暴发中的毒力方面具有极好的潜力。Crouse等[71]用不同感染模型的细胞和组织中的沙门氏菌载量衡量毒力水平,通过结合WGS、系统发育和泛基因
组研究预测33株未知毒力沙门氏菌分离株毒力水平高低,结果与体内、外模型的结果具有较高一致性。有学者结合WGS、电子生物信息学方法以及流行病学数据,分析了775个沙门氏菌完整基因组中的129个毒力基因,对巴西沙门氏菌毒力基因的分布情况进行了研究并揭示了巴西沙门氏菌中耶尔森氏菌高致病性岛(HPI)的存在[72]。基于高通量测序(NGS)生成的75个与人类沙门氏菌病相关的血清型的80个全基因组,Gao等[73]开发了一种靶向AmpliSeq程序,可用于沙门氏菌各种血清型的致病性和食源性沙门氏菌病的风险评估。WGS 可在数小时至数天内捕获整个基因组,有可能区分密切相关的暴发毒株,鉴定毒力/耐药基因。这些研究表明了WGS方法应用于沙门氏菌食品安全实践和疫情预测的可行性。
5 总结与展望
目前的研究已涉及到沙门氏菌的24个毒力岛及4个分泌系统。其中,T3SS主要与SPI-1和SPI-2相关,T1SS可能存在于SPI-4中,T6SS目前多与SPI-6 和SPI-19联系,由于毒力岛及分泌系统会发生进化来帮助沙门氏菌适应不同的生活方式和环境条件,是否存在其他潜在毒力岛以及分泌系统仍是我们关注的问题。已有学者总结了沙门氏菌的24个毒力岛在血清型中的分布情况[2],但不同血清型间优势毒力岛差异性以及毒力机制还需要进一步研究。近期研究表明,全基因组测序(WGS)可用于沙门氏菌毒力预测具有较高的准确率。
另外,人和动物源沙门氏菌的耐药性呈上升趋势,并且人源沙门氏菌和动物源沙门氏菌存在一定的相关性[74]。对其耐药性的机制已有诸多研究[75-76]。以往的研究表明沙门氏菌不同血清型具有不同耐药特征[77-78],且部分毒力基因与细菌耐药性产生存在一定联系[79],但具体机制仍需要进一步的研究。
鉴于畜禽产品药物残留和多重耐药基因介导耐药菌株不断增加,沙门氏菌的全球负担仍然是一个令人担忧的问题。正在开发的沙门氏菌疫苗方法是一个有希望的迹象,同时疫苗的免疫防控是发展研究的热点。目前针对沙门氏菌研究的疫苗主要有减毒活疫苗、灭活疫苗、亚单位疫苗、活载体疫苗和DNA疫苗。传统灭活苗能起到一定的免疫保护,但其具有免疫效果差、接种免疫次数较多、免疫途径复杂和生产成本较高的问题。而减毒活疫苗及亚单位疫苗具有灭毒不充分、免疫保护性低等缺点。所以研发一种新型的疫苗策略已迫在眉睫。疫苗的开发受到能够引起感染的多种血清之间的抗原多样性的阻碍。所以选择合适的蛋白抗原是关键。值得注意的是,沙门氏菌也是表达异源抗原的理想载体,可以为开发针对其他病原体的疫苗提供一个灵活的平台。

