CLSI、EUCAST和中国耐药判定标准概述
阮紫涵 黄安雄 王秀娟 黄玲利 郝海红,3,4
(1. 华中农业大学 国家兽药残留基准实验室,武汉 430070;2. 华中农业大学 农业农村部畜禽产品质量安全风险评估实验室,武汉 430070;3. 华中农业大学深圳营养与健康研究院,深圳 518000;4. 中国农业科学院深圳农业基因组研究所 岭南现代农业科学与技术广东省实验室深圳分中心,深圳 518000)
众所周知,抗菌药物耐药性对人类健康和农业生产已经产生了不利影响,细菌耐药性问题也受到了全世界的关注。各国逐渐认识到加强监测兽用抗菌药物使用的重要性,积极开展了一系列动物源性病原菌的耐药性监控,包括相关的流行病学研究,为评估细菌耐药风险提供了一些基础数据。自20世纪以来,部分发达国家便开始设立了本国的动物源性细菌耐药性监测系统,如挪威、英国、法国、加拿大[1]、荷兰[2]、德国[3]以及日本[4]等国家。目前全球公认的最具权威的两大机构分别是美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)和欧盟药敏试验标准委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)。CLSI是一个综合性的非营利性国际标准方法开发和教育组织,它的许多临床试验标准和实践被认为是黄金标准。EUCAST主要致力于协调欧洲药敏试验方法和耐药性判定标准的开发过程,使其能够规范适用于尽可能多的国家[5]。
由于耐药性研究起步较晚,导致缺乏对细菌耐药性的早期认识,加剧了抗菌药物的滥用[6]。而不同国家对于抗菌药物的耐药判定标准是不同的,这与不同国家习惯使用抗菌药物的种类和用量有关,这就启示我们必须要建立起符合我国抗菌药物耐药情况的耐药判定标准[7]。近年来,我国在耐药判定标准的制定上进行不断的努力,成立了耐药监测机构,制定了许多符合我国抗菌药物的耐药判定标准,为临床合理使用抗菌药物、指导规范用药提供了依据。此外,2017年,我国经欧洲临床微生物学和感染病学会(European Society for Clinical Microbiology and Infectious Diseases,ESCMID)欧洲药敏试验委员会(EUCAST)批准成立了华人抗菌药物敏感性试验委员会(Chinese Committee on Antimicrobial Susceptibility Testing,ChiCAST)[8], 这 将 有 利 于我国临床微生物学研究所和临床细菌学家更好地了解和遵守药物敏感性测试的国际标准。本文比较了CLSI和EUCAST两大组织在耐药判定标准制定过程中的差异,并对中国在兽用抗菌药物耐药判定标准制定方面中取得的成绩进行了总结,以期为兽用抗菌药物制定耐药判定标准提供可靠的理论数据。
1 耐药判定标准的定义和意义
确定耐药性的标准,称为折点,是指最小抑菌浓度(minimum inhibitory concentration,MIC)或抗菌药物抑菌圈的直径[9],用来评估病原体对抗菌药物是否具有抗性,或仍然保持敏感的依据。当使用推荐治疗剂量就能使MIC低于或等于折点或抑菌圈直径等于或大于折点,表现可能的临床疗效时,结果报告为敏感;反之,可能存在特定的微生物耐药机制,药物没有表现出分离株的临床疗效,结果报告为耐药;当使用标准剂量药物可以在感染部位大量蓄积,并且治愈疾病,或者药物虽不能在感染部位蓄积,但在安全剂量内增加剂量可以治疗疾病时,报告结果为中介[10]。如果只用体外药敏试验来确定折点值,根据折点值可将细菌分为两类:如果MIC值低于折点,则将它们定义为易感细菌;如果不是,它们被定义为耐药菌株[11]。
制定耐药判定标准需要3个参数[12]:(1)野生型临界值(wild-type cut-off,COWT)/流行病学临界值(epidemiological cut-off,ECOFF);(2)药效学临界值(pharmacodynamic cut-off,COPD);(3)临床临界值(clinical cut-off,COCL)。CLSI和 EUCAST 使用不同的折点制定方法,但在制定过程方面是相似的,都需要确定这3种临界值,用于临床实验室的最终报告[13]。由于临床治疗高度依赖抗菌药物的使用,耐药性是一个动态的过程,即使确定耐药性的标准,也会随着实际情况的变化(例如相关政策发布和更新)及时更新[14]。
耐药性标准的重要性在于开发新药时,首先要进行体外研究以确认其活性,并进行临床试验以确定药物、疗效和MIC之间的关系。收集的临床分离病原体的药敏数据可用于得出病原体易感程度的结论,并根据感染部位和感染程度选择合适的治疗方案。如果分离鉴定出病原菌并获得其药敏试验结果,就可以预测药物的治疗情况。如果已经采取了一些治疗仍未治愈,可以结合折点数据来分析和确定是否有耐药性或其他因素的存在。综上所述,建立耐药性标准对于指导临床治疗、协助临床治疗和控制细菌耐药性的出现都具有重要作用。
2 CLSI耐药判定标准
2.1 CLSI的概况
CLSI是世界卫生组织认可的“临床和实验室标准研究所”,我国常用的许多药敏试验都是参考其制定的标准。CLSI是一个制定临床试验标准和操作规范的组织,其目标是在医学领域建立统一的标准和指南,以解决关键的临床诊断和治疗问题。CLSI整合来自多个来源的研究数据,以开发抗菌药物敏感性测试方法、结果解释和质量控制参数。CLSI敏感性测试委员会由3个委员会组成:抗菌药物敏感性测试委员会、抗真菌药敏试验委员会和兽医抗菌药物敏感试验委员会(表1)。

表1 CLSI主要委员会信息Table 1 CLSI main committee information
CLSI折点的可用性体现在多个方面。首先,CLSI是美国国家标准协会(American National Standards Institute,ANSI)指定的国际标准化组织(International Organization for Standardization,ISO)技术委员会212(ISO/TC 212)临床实验室检测和体外诊断系统秘书处,ISO/TC 212负责制定实验室医学和体外诊断检测系统领域的国际标准和指南,显示出CLSI的专业性。其次,CLSI每年发布一次的M100《抗菌药物敏感性试验性能标准》[15],其内容包括代表药物选择、抗菌药物敏感性试验判读和质量控制(quality control,QC)的最新信息,显示出其实用性。M100中提供的数据在全世界范围内被实验者、传染病从业者和抗菌药物药敏试验(AST)委员会广泛使用,其软件应用的算法基于M100的信息,显示出其广泛性。此外,CLSI文件M23《体外药敏试验标准和质量控制参数》的开发支持引入和变更M100中发布的判读标准,为申办方提交给监管机构的数据提供指导,并详细说明CLSI药敏试验小组委员会遵循的标准发布或修订QC范围和药敏试验判读标准。
2.2 CLSI-VAST的概况
CLSI兽医抗菌药物敏感性测试(CLSI veterinary antimicrobial susceptibility testing,CLSI-VAST)小组委员会致力于制定和促进从动物体内分离的细菌的体外抗菌药物敏感性测试的性能标准、折点和解释类别;并且通过开发新的或修订的方法、折点、解释类别和质量参数来不断完善标准,促进使用这些方法的用户进行对话。CLSI-VAST的目标是建立兽医特定折点,以减少对人类折点的依赖。当某些抗菌药物和生物体对所有动物种属均无可用的兽医折点时,将考虑参考人用折点。
目前CLSI已经制定的文件中,VET01和VET03分别是从陆生生物和水生生物中分离的细菌的敏感性试验方法文件[16-17],VET02描述了确立折点所需数据、ECOFF、QC参数以及如何提供数据进行评价的详细信息[18]。
3 EUCAST耐药判定标准
3.1 EUCAST概述
EUCAST于1997年在ESCMID的支持下成立,于2001-2002年进行了重建,并于2002年开始运行。EUCAST目前的职责是协调现有欧洲药物的临床折点、定义新药的临床折点、设置ECOFF并根据需要修改折点、统一抗菌药敏感性测试方法,并开发网站(https://www.eucast.org/),提供有关各种抗菌药物的抗菌MIC和面积直径分布的免费信息。
EUCAST提供了关于原理和标准操作程序的文件。前者总结了EUCAST可持续性评估标准的基础信息;后者主要包括设置新的抗菌药物折点、协调现有的折点、审查和修订折点、建立区域直径折点的程序和新药的QC标准、MIC分配和ECOFF值设置的步骤。
3.2 VET-CAST的概况
抗菌药物敏感性测试兽医委员会(Veterinary Committee on Antimicrobial Susceptibility Testing,Vet-CAST)是EUCAST的一个小组委员会,成立于2015年。VET-CAST的主要功能是处理涵盖动物细菌病原体的各个方面和动物源性细菌药敏试验。同时致力于发布免费的标准、指南、ECOFF、PK/PD折点、临床折点(clinical breakpoints,CBPs)和其他有关AST实施的相关信息,为科研工作者参考利用(https://www.eucast.org/ast_of_veterinary_pathogens/)。
到目前为止,VET-CAST制定了大多数兽用抗菌药物的药敏试验折点,但仍有很多抗菌药物缺少对所有病原菌的折点,或是缺乏一些动物特异性折点(表2)。这些抗菌药物可能由于没有合适的给药方案造成滥用,导致治疗人类感染的重要抗菌药物耐药性升高从而治疗失败。

表2 尚未制定出动物特异性折点的抗菌药物Table 2 Antibiotics while no animal-specific breakpoints have been established
4 CLSI和EUCAST耐药判定标准的差异
自1993年CLSI版本在中国推出以来,每个版本都由专家翻译。该标准引进历史悠久,修订及时,与临床紧密结合,是中国卫生部颁布的标准。EUCAST成立于1997年,欧洲标准于2002年统一,但国内对其研究和应用较少,然而EUCAST的专家规则和ECOFF为折点的制定提供了较为合理的标准,可作为CLSI的补充。
在功能方面,CLSI的业务涵盖了临床检验医学的各个方面。折点主要由微生物学委员会下属的抗菌药物敏感性实验分会完成,相对比较稳定;相比之下,EUCAST业务范围较窄,主要专注于药物敏感性试验标准以及协调统一欧洲各个国家或地区的折点。
4.1 折点值及表达形式
CLSI文件中,仅规定运用折点来区分敏感、中介和耐药,而EUCAST在此基础上,提出ECOFF的定义,ECOFF是用来区分野生型菌株和非野生型菌株的MIC值,其不考虑临床效力,单纯考察细菌对药物的敏感性情况,所以该值相对稳定,在一定时期内通常不会随样本来源及地区不同而产生差异,在全世界范围内具有广泛应用[19]。CLSI设置的耐药判定标准通常低于EUCAST所设定的(表3)。此外,值得我们注意的有:(1)EUCAST对葡萄球菌属中不同的细菌对氟喹诺酮类药物制定了不同的折点,而CLSI则对所有的葡萄球菌属对氟喹诺酮类药物制定了相同的折点;(2)CLSI对所有的厌氧菌采用同样的折点,相反EUCAST对不同的厌氧菌分别制定了折点,能够更好地解释药敏试验结果,且CLSI只制定了适用于厌氧菌的最小抑菌浓度的折点值,并未制定抑菌圈直径的折点值;(3)并且EUCAST文件还在最后注明每种药物的PK/PD的折点值。

表3 CLSI和EUCAST制定的部分折点的比较Table 3 Comparison of partial breakpoints established by CLSI and EUCAST
EUCAST 设置折点的过程(EUCAST SOP 1.4)[20]与 CLSI[21]类似,均需要确定 COWT/ECOFFs、COPD和COCL。不同之处在于EUCAST建立的耐药性折点(resistance,R)是基于抗菌药物的最高推荐剂量,缺乏明确的中介值(intermediate,I),MIC结果的表达方式为 :S≤ X μg/mL,R>Y μg/mL;CLSI则是通过稀释法药敏试验结果与纸片法结果进行平行比较,经过统计分析,得到I值和耐药性折点值,其MIC结果判定的表达方式为:S≤X μg/mL,I=Y μg/mL,R ≥ Z μg/mL。
4.2 药敏试验操作规程细节的差异
CLSI和EUCAST在药敏试验程序细节上的差异主要体现在培养基选择、接种物制备、质控菌种选择、孵育时间等方面(表4)。

表4 CLSI和EUCAST建立耐药判定标准的药敏试验方法比较Table 4 Comparison of susceptibility test methods for development of susceptibility breakpoints by CLSI and EUCAST
4.2.1 培养基的选择 除了表中常见细菌CLSI和EUCAST在培养基选择上的差异外,一方面EUCAST使用MH-F(MH琼脂/肉汤+5%脱纤维马血+20 mg/L β-NAD)琼脂和肉汤对难以培养的细菌进行药敏试验,而CLSI有更详细的规定:如葡萄球菌肉汤的稀释,除了需要阳离子调节的MHB(cation-adjusted mueller-hinton broth,CAMHB)外,还需要添加2%NaCl或50 μg/mL钙;对于淋病奈瑟菌的药敏试验需要使用GC琼脂和1%的生长补充剂,相比之下,EUCAST还未确定淋病奈瑟菌的药敏试验纸片扩散标准。
4.2.2 接种物的制备 CLSI和EUCAST规定接种物必须满足0.5麦氏浊度标准,但是CLSI声明接种物可以通过肉汤培养或菌悬液制备,而EUCAST声明推荐使用菌悬液法。此外,EUCAST文件中,丝状真菌的接种浓度为(2-5)×105CFU/mL,用血细胞计数器计数;CLSI文件中则要求丝状真菌接种浓度为(0.4-5)×104CFU/mL,采用分光光度计计数。
4.2.3 质控菌株的选择 CLSI推荐的质控菌株均为美国微生物保藏中心采集的ATCC菌株。除上述菌株外,EUCAST还可能使用其他国家收集的菌株作为质控菌株。
4.2.4 孵育时间 在CLSI中,常规培养细菌的孵育时间通常为16-20 h,但对难培养的细菌则规定了其他孵育时间。例如,葡萄球菌、巴氏杆菌和溶血性曼氏杆菌需要孵育18-24 h;睡眠嗜血杆菌、胸膜肺炎放线杆菌、链球菌与李斯特菌需要孵育20-24 h,而空肠弯曲杆菌最特殊,需要在36-37℃的环境中孵育48 h或42℃环境孵育24 h。EUCAST除空肠弯曲杆菌在42℃孵育24 h外,其余细菌孵育均为18-20 h。
5 我国在耐药判定标准方面的研究
抗菌药在控制传染病、保持动物健康和食源性产品的安全,对维持公共卫生安全方面至关重要。虽然有CLSI和EUCAST两大组织制定的折点,但是不同国家之间的病原菌对抗菌药物规定的给药方案存在差异,如果完全按照这两大组织制定的折点可能导致意想不到耐药性的发生。
5.1 我国在耐药性监测方面的成就
2005年,卫生部建立了“全国抗菌药物临床应用监测网”(Center for Antibacterial Surveillance,CAS,http://y.chinadtc.org.cn/login)和全国细菌耐药监测网络(China Antimicrobial Resistance Surveillance System,CARSS,http://www.carss.cn/),后者是覆盖全国基本细菌耐药监测的网络,也是构成世界卫生组织(World Health Organization,WHO)全球监测细菌耐药性工作的一部分[22]。但动物源细菌耐药性研究监测起步较晚,2008年农业部才建立了动物源性细菌耐药性监测制度[23],以更好地实施动物源性细菌耐药性监测计划。据统计,直到2022年已经有23个耐药性监测实验室单位加入到我国动物源细菌耐药性监测网络,这些监测单位执行农业部动物细菌耐药监测计划的采样要求,开展药敏试验。目前监测的细菌包括大肠杆菌、沙门菌、金黄色葡萄球菌、弯曲杆菌(包括空肠和结肠弯曲杆菌)、肠球菌(包括粪肠球菌和屎肠球菌)、魏氏梭菌、猪链球菌、副猪嗜血杆菌和巴氏杆菌等[24-25]。此外,通过对上述细菌在中国不同时期、不同地区和不同动物的耐药性及发展趋势进行分析总结,了解中国动物源耐药性的现状、产生原因及耐药趋势,为我国采取有效措施控制动物源性细菌耐药性提供了依据[26]。
5.2 我国在耐药判定标准制定方面的研究
在折点的制定方面,我国的科研者做了许多努力并制定出符合我国耐药性情况的折点值(表5)。从表中可以看出,对产气荚膜梭菌、大肠杆菌、副猪嗜血杆菌、沙门菌和巴氏杆菌的耐药判定标准研究较多,与我国动物源细菌耐药性检测系统监测的细菌重合,对耐药性监测工作具有一定帮助;并且监测的药物大多是CLSI和EUCAST尚未制定出折点的抗菌药物[27],可为我国临床用药提供一些理论依据。其中,田二杰[28]和傅嘉莉[29]制定的达氟沙星对鸡源大肠杆菌的野生型临界值差距较大(约32倍),发生这种情况的可能原因有:(1)采集样品的范围不同。田二杰采集的样品涉及全国各地并且包括多所农业高校赠送的鸡源大肠杆菌,而傅嘉莉仅在广东省几个地区进行了采样;(2)采集样品的时间不同。与傅嘉莉相比,田二杰采集样品的时间更长且包含4个季节;(3)样本量的差异。田二杰进行测定的鸡源大肠杆菌高达1 412株,远超过CLSI规定的100株。相比之下,傅嘉莉只有363株的鸡呼吸道大肠杆菌,样本的丰富度和多样性都较差。因此,以4 μg/mL作为我国达氟沙星对鸡源大肠杆菌的野生型临界值最为合适。李佳瑞[30]制定的安普霉素对猪源大肠杆菌的野生型临界值为32 μg/mL,是丹麦测定 ECOFFs(16 μg/mL)的两倍,这可能与两国使用抗菌药物的情况有关。同样的情况可以在庆大霉素、链霉素和奇霉素对副猪嗜血杆菌的野生型临界值研究中观察到,出现这种情况最可能的原因是我国抗菌药物的过度使用[31-32]。部分研究还通过PK/PD模型等制定了一些临床治疗的推荐剂量,如分别用马波沙星和头孢喹肟治疗副猪嗜血杆菌的最佳推荐给药剂量分别为16 mg/kg b.w.[33]和 4 mg/kg b.w.[34];陶梦婷[35]预测用沃尼妙林治疗兔源产气荚膜梭菌的有效剂量为2.33 mg/kg b.w.,与EUCAST推荐的剂量(3 mg/kg b.w.)相近,具有一定的临床指导意义;Lei等[36]首次提出大环内酯类药物替地罗辛对猪多杀性巴氏杆菌的敏感性折点为4 mg/kg,并且证明之前的推荐剂量4 mg/kg不能够达到理想的杀菌作用,预测12.17 mg/kg b.w.才是充分有效的治疗剂量。从表5中可以看出,大多数研究人员只进行了野生型和/或药效临界值研究,而对COCL的研究几乎没有可用的数据,且在获得临床相关数据方面的难度大,使得COCL在制定过程中常常受阻。这提示国家层面上应该多多促进科研人员与养殖人员的交流与合作,共同努力以获得相关的临床数据[27]。
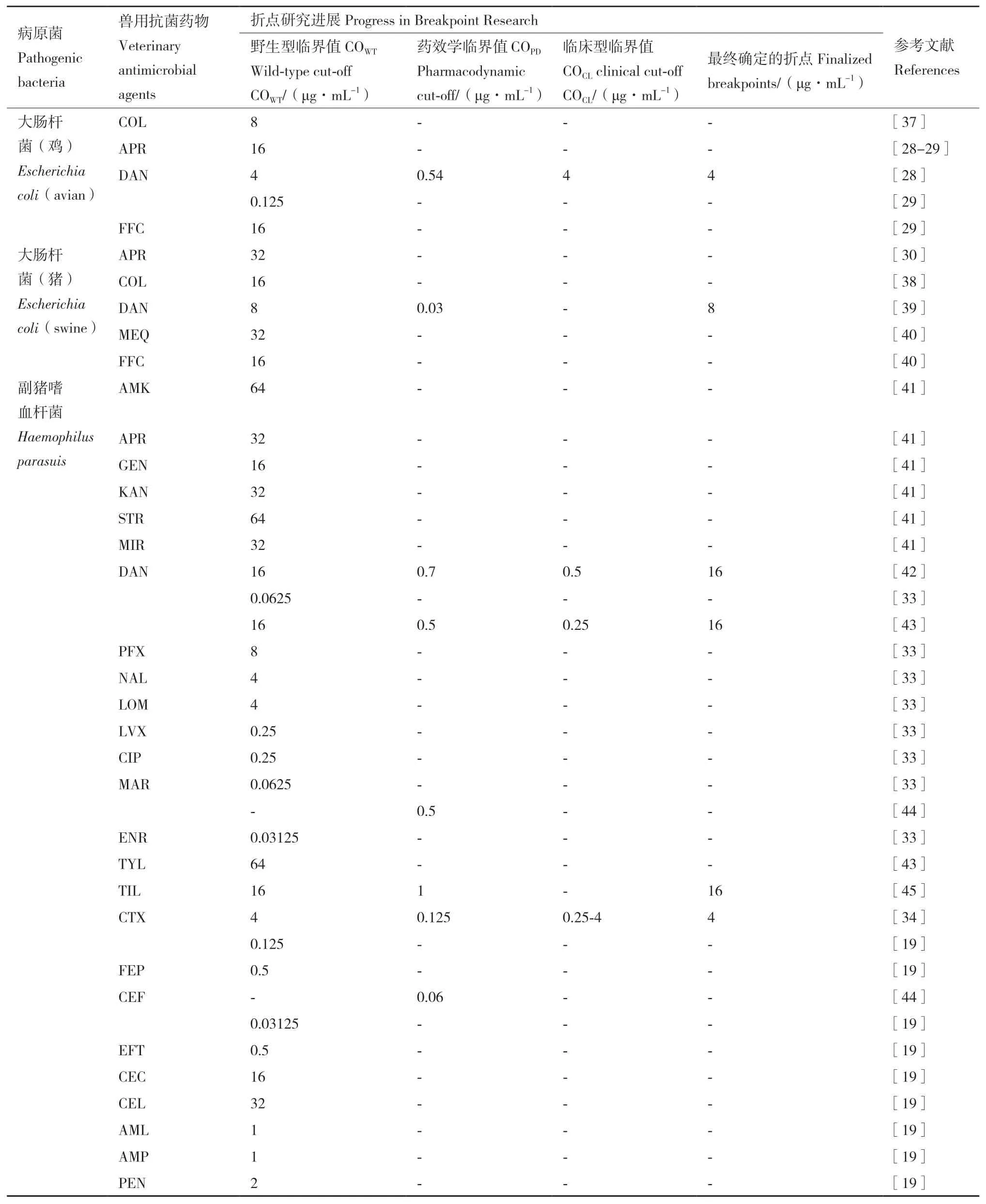
表5 我国在动物源性病原菌耐药判定标准方面情况进展Table 5 Progress in standard for susceptibility breakpoints of animal-borne pathogens in China

续表(Contitnued)
6 展望
抗菌药物耐药性是一场全球公共卫生危机,具有威胁成功治疗细菌感染的能力[50]。世界卫生组织在2017年发布了关于在食源性动物中使用医学上重要的抗菌药物的指南,建议停止常规使用抗菌药物来促进健康动物的生长和预防疾病[51]。这一指南希望通过减少抗菌药物在动物中使用来维持抗菌药物在人类医学方面的有效性[52]。控制耐药性的一个关键是制定出符合本地区的耐药判定标准,以用于指导临床用药,防止用药过多造成抗菌药物压力环境,或用药不足而导致的治疗失败。
虽然近年来我国在动物源细菌的监测和耐药判定标准的制定上已经取得了一些研究进展,但是有些耐药判定标准只能反映部分地区的耐药性情况,并不适合应用于全国,所以还未形成完备的指南。这就需要广大科研工作者努力探索出更加快速、简便和准确的方法来制定出全国适用的兽用耐药判定标准,以指导临床合理使用抗菌药物、推进新兽药的开发和细菌耐药检测工作。同时,未来我国需要继续加强对兽用抗菌药物使用的监管和监督,督促各兽药使用者按照推荐的给药剂量对动物进行细菌感染的预防和治疗,为实现兽用抗菌药物高疗效、控制耐药性的发展作出应有贡献。

