IRAK1/4抑制剂对结肠炎小鼠肠道屏障功能的影响
严 博 李湘杰 乔雨晴 周林香 彭 帅 沈 磊
炎症性肠病(inflammatory bowel disease,IBD)分为溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD),是一种慢性复发性肠道炎症。UC 在病理上主要表现为结肠黏膜损伤,持续且弥漫性的炎症改变,是一个涉及多因素的过程,通常在直肠和乙状结肠首先发病,甚至逐渐发展为全结肠炎性病变[1,2]。 研究表明,白细胞介素-1 受体相关激酶(interleukin receptor-associated kinase,IRAKs)与多种疾病密切相关[3~5]。 其中,IRAK1/4 是Toll 样受体(toll-like receptors, TLRs)介导的炎性信号通路中的两个关键激酶,抑制IRAK1/4 活性可以减轻炎症活动,减少组织损伤[6,7]。 炎症活动常伴随肠屏障的破坏,肠道屏障完整性受损被认为是导致IBD 的原因之一[8]。 肠上皮细胞(intestinal epithelial cells,IECs)、黏液层和紧密连接蛋白(tight junctions,TJs)是肠道屏障功能结构的重要组成成分,有助于维持和调节肠道屏障[9,10]。 目前鲜有研究表明IRAK1/4 抑制剂在小鼠急性结肠炎中的作用,故本研究旨在探讨IRAK1/4 抑制剂对小鼠结肠炎及其肠道屏障功能的调节保护作用。
材料与方法
1.实验动物与材料:实验采用30 只雄性小鼠(C57BL/6,6 ~8 周龄,体质量约20g),购自北京华阜康生物科技有限公司。 DSS 购自美国MP Biomedicals 公司;IRAK1/4 抑制剂购自美国Med Chem Express 公司;ELISA 试剂盒购自武汉伊莱瑞特生物科技股份有限公司;PCR 反转录试剂盒购自美国Sigma公司;兔多抗(ZO-1、occludin、claudin-1、JAM-A)购自武汉三鹰生物技术有限公司,实验动物使用符合《武汉大学人民医院动物伦理委员会准则》,伦理批准号:WDRM20200901,实验动物许可证号:SYXK(鄂)2020 ~0027。
2.实验分组:正式实验开始前,将小鼠于标准实验室环境中(温度21 ±2℃,湿度50% ±5%,12h/12h交替光照与黑暗)适应性饲养7 天。 小鼠分为3 组:空白组:每天给予正常清洁饮水, 同时腹腔注射0.3ml 0.9%氯化钠溶液;DSS 组:每天自由饮用质量浓度为30g/L 的DSS 溶液,同时腹腔注射0.3ml 0.9%氯化钠溶液;IRAK1/4 抑制剂组:在自由饮用DSS 溶液的同时,给予腹腔注射0.3ml IRAK1/4 抑制剂(10μmol/L,给药浓度参考文献[11, 12])。 依照上述分组及给药模式连续造模7 天。
3.取材:实验7 天后(最后一次给药24 h 后),各组小鼠均未出现死亡。 将小鼠处死(颈椎脱臼法),行乙醇消毒后迅速解剖,取小鼠结直肠及回盲部,观察肠道充血水肿和缩短情况,测量结肠长度;取病变明显处结肠组织(通常为直肠和乙状结肠)标本(约5mm × 10 mm),用多聚甲醛固定(质量浓度为40g/L),石蜡包埋后切片并行HE 染色,另将部分新鲜结肠组织冻存于-80℃冰箱以备后续检测。
4.疾病活动度评分:每天观察记录各组小鼠体质量、粪便性状及便血情况(隐血实验及肉眼血便),计算疾病活动指数(disease activity index,DAI) 评分(表1)。

表1 DAI 评分
5.组织病理学评分:通过HE 染色切片观察结肠黏膜形态及炎性细胞浸润情况。 根据既往研究行组织学评分(表2)。

表2 组织病理学评分
6.结肠组织炎性细胞因子ELISA 检测:选用标准的ELISA 试剂盒检测结肠组织中炎性细胞因子IL-1β、IL-6、TNF-α、IFN-γ 表达情况,利用酶标仪测定450nm 处吸光度(A)值。 所有ELISA 检测均严格按照各试剂盒说明书进行。
7.结肠组织屏障蛋白表达检测:蛋白免疫印记法检测结肠组织ZO-1、occludin、claudin-1、JAM-A蛋白表达水平。 取小鼠结肠组织进行裂解、匀浆、离心制成细胞裂解液,然后用BCA 法测定蛋白浓度。采用PVDF 转膜,再用含有5% 脱脂奶粉的TBST 室温封闭2h,加入一抗ZO-1(1 ∶800)、occludin(1 ∶800)、claudin-1(1∶800)、JAM-A(1∶1000),在4℃恒温下孵育过夜,TBST 充分洗涤5 ~6 次,每次5min。 加入辣根过氧化物酶(HRP)偶联标记的一抗(1∶50000),37℃摇床孵育2h,TBST 充分洗涤5 ~6 次,每次5min;最后用ECL 高敏显色液显色并拍片,使用计算机Image-J 软件进行分析,测定灰度值。
8.结肠组织黏蛋白RT-PCR 检测:实时荧光定量PCR 检测小鼠结肠组织中黏蛋白mucin-1 和mucin-2 mRNA 变化。 根据试剂盒制造商的方案,应用TRIzol 试剂从结肠样本中提取总RNA。 使用反转录酶从提取的RNA 中反转录cDNA。 real-time PCR采用ABI 7500 和SYBR Green 探针。 以β-actin 为内参,引物序列详见表3。

表3 PCR 引物序列
9.统计学方法:应用GraphPad Prism 8 统计学软件对数据进行统计分析并绘制统计图。 多组间单因素分析采用方差分析。 以P<0.05 为差异有统计学意义。
结 果
1.各组小鼠生命体征及DAI 评分:实验过程中,空白组小鼠活动正常,体质量均有不同程度增加,粪便正常;DSS 组小鼠均出现明显体质量下降,饮食饮水减少甚至出现拒食现象,在实验后期出现肉眼可见的血便;IRAK1/4 抑制剂组虽有不同程度的体质量下降,出血不同程度的血便,但程度均较DSS 组轻。 综合上述情况行DAI 评分,与空白组比较,DSS 组评分明显增加(P<0.01),与DSS 组比较,IRAK1/4 抑制剂组显著减低(P<0.01,图1A)。

图1 各组DAI 评分及结肠长度
2.各组小鼠结肠长度及组织病理学评分:观察各组结肠情况,空白组小鼠结肠未见明显充血肿胀,DSS 组小鼠结肠充血肿胀,与空白组比较明显缩短(P<0.01)。 与DSS 组比较,IRAK1/4 抑制剂干预组后,结肠缩短及充血肿胀情况均有所改善(P<0.01,图1 B)。 分析结肠HE 染色切片,空白组小鼠结肠黏膜结构完整,无炎性细胞,腺体排列规则,DSS 组小鼠结肠黏膜严重破坏,腺体排列紊乱甚至消失,黏膜及黏膜下层可见大量炎性细胞浸润,与空白组比较,病理学评分显著升高(P<0.01,图2 中A、B、D);IRAK1/4 抑制剂组小鼠结肠黏膜结构及腺体排列较DSS 组相对完整,炎性细胞浸润较少,病理学评分明显降低(P<0.01,图2 中B、C、D)。

图2 结肠组织病理切片(HE 染色, ×200)
3.各组小鼠结肠炎性细胞因子IL-1β、IL-6、TNF-α、IFN-γ 表达水平:ELISA 法检测各组小鼠结肠促炎性细胞因子表达水平,与空白组比较,DSS组IL-1β、IL-6、TNF-α、IFN-γ 表达水平明显增加(P<0.01),IRAK1/4 抑制剂组较DSS 组则相对减少(P<0.01,图3)。 表明IRAK1/4 抑制剂可减轻肠道炎症。
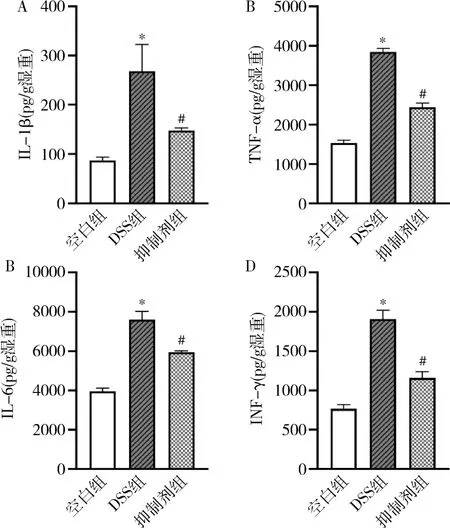
图3 结肠组织中炎性细胞因子的表达
4.蛋白免疫印记法检测结肠组织中肠道屏障功能相关蛋白(ZO-1、occludin、claudin-1、JAM-A)的表达情况。 与空白组比较,DSS 组小鼠结肠ZO-1、occludin、claudin-1、JAM-A 蛋白表达显著减少(P<0.01),而IRAK1/4 抑制剂组的上述蛋白减轻程度均较DSS 组低(P<0.01,图4A、B)。
5.RT-PCR 检测各组小鼠肠道黏蛋白(mucin-1、mucin-2)mRNA 的表达水平。 DSS 组与IRAK1/4抑制剂组的mucin-1 和mucin-2 表达水平均较空白组显著减少(P<0.01),但IRAK1/4 抑制剂组较DSS 组减少程度轻(P<0.01,图4C)。
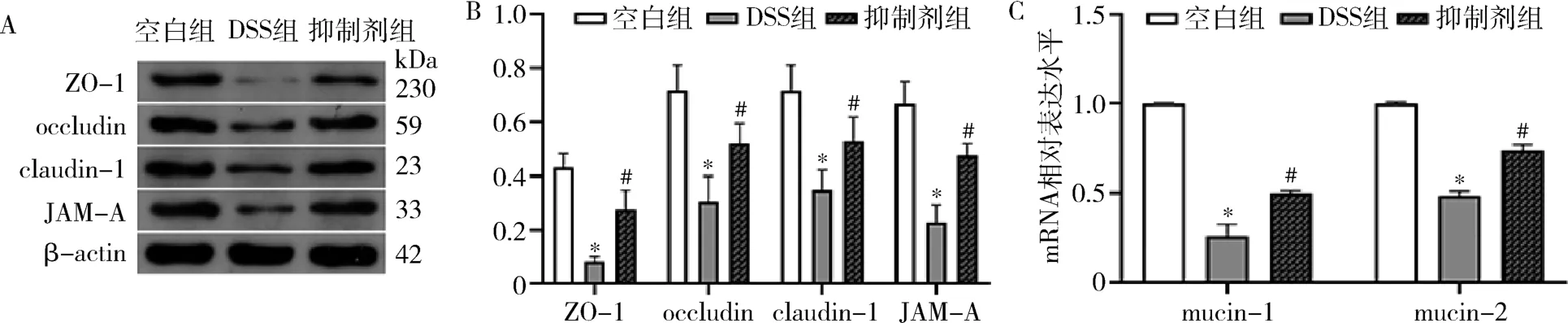
图4 各组屏障功能相关蛋白的表达
讨 论
溃疡性结肠炎是一种慢性复发性肠道炎症疾病,其发病机制尚不完全清楚,但肠道黏膜损害和免疫异常在发病过程中起着不良效应。现行的治疗多采用5-ASA、糖皮质激素和免疫抑制剂等抑制肠道炎性反应,随着对肠道黏膜屏障功能的进一步认识,维持肠道黏膜屏障完整为治疗UC 提供了新的思路[13]。
完整的肠黏膜对维持肠道功能和健康起着重要作用,在保护机体免受潜在有害致病微生物入侵的同时,维持机体的营养吸收和免疫感知功能。 肠上皮屏障由黏液层、上皮细胞和细胞间紧密连接组成,以维持肠道功能的完整和免疫稳态[8]。 上皮黏液层由上皮杯状细胞释放的黏蛋白组成,是抵御病原体入侵的第一道防线,阻止细菌直接接触上皮细胞[14]。 肠上皮细胞也表达跨膜黏蛋白,这些黏蛋白仍然附着在顶端表面,并与糖脂质一起形成糖脂屏障层[15]。 细胞间紧密连接蛋白由跨膜蛋白和细胞内膜或支架蛋白组成,是位于肠上皮细胞连接复合体顶端的细胞间复合体,在上皮细胞通透性中发挥主要作用[16~18]。
肠道黏膜屏障完整性的丧失是IBD 的一个特征。 肠道通透性增加可能是炎症性肠病发病机制中的一个初始事件,使细菌等衍生的相关低分子进入黏膜并激起不可控的炎症级联信号[8]。 TNF-α、IFN-γ和白细胞介素都在紧密连接完整性调控中起着关键作用[19]。 对于TNF-α,抗TNF-α 单抗在IBD 中所表现出的优秀临床疗效已经足以表明其在IBD 发病机制中的相关突出作用,该抗体可减轻IBD 严重程度,恢复肠道屏障功能[20]。 通过抗TNF-α 治疗恢复上皮屏障功能可能反映免疫系统受损的黏膜愈合情况; IFN-γ 被认为可改变肌动蛋白-肌球蛋白细胞骨架与紧密连接蛋白的相互作用,影响肠道屏障功能[21~23]。 无论细胞的能量水平如何,IFN-γ 也可以通过降低腺苷一磷酸活化蛋白激酶(AMPK)依赖通路中ZO-1 和occludin 的表达来诱导屏障通透性的增加[24]。 这两种细胞因子的同时存在通过紧密连接蛋白的分离对肠道完整性产生不利影响。
细胞间紧密连接的破坏可增加结肠对有害致病微生物和毒素的通透性,引起肠道炎性反应,并发展成UC[25]。 UC 患者肠道屏障功能受损,肠壁通透性增加,使得病原体和毒素等有害物质通过肠壁,进一步激活炎症系统,合成促炎性细胞因子,促进UC 的发展。 此外,产生的炎性细胞因子进一步加剧了上皮屏障功能的破坏,两者形成恶性循环,加剧肠道炎症[18,26]。 与既往研究相似,本实验中DSS 组小鼠结肠炎性细胞因子(IL-1β、IL-6、TNF-α、IFN-γ)活性表达显著增强,结肠黏膜紧密连接蛋白(ZO-1、occludin、claudin-1、JAM-A)和黏蛋白(mucin-1/2)的mRNA 表达均显著降低,表明肠道炎症发生的同时,肠道屏障功能受损。 而经过IRAK1/4 抑制剂干预后在一定程度上逆转了上述情况,说明抑制IRAK1/4 活性可在一定程度上缓解炎症,维持肠道屏障的完整性。
本研究仅对IRAK1/4 抑制剂对结肠炎小鼠IRAK1/4 活性药理抑制的基本作用进行了初步分析,探讨了IRAK1/4 活性抑制与肠道炎症和改善肠道屏障功能之间的关系。 虽然一定浓度的IRAK1/4 抑制剂可以有效缓解DSS 诱导的小鼠结肠炎,目前也有IRAK1/4 相关抑制剂在风湿性疾病和血液病中的临床试验,尚不清楚这些药物在IBD 患者中使用是否安全有效。 因此,需要进一步的实验研究将这些结果转化为UC 患者的临床应用。
综上所述,肠道屏障缺陷不仅是一种疾病表现,并增强了对肠道屏障缺失致病机制的关注和在IBD治疗管理中的研究。 笔者通过DSS 成功诱导小鼠实验性结肠炎模型,并证明IRAK1/4 抑制剂对小鼠结肠炎和肠道屏障具有保护作用,但其作用机制仍需进一步研究。

