基于质谱技术筛查儿童Graves病新环境干扰物的研究
夏 秦 陈临琪 宋浩洁 陈秀丽 谢蓉蓉 王凤云 吴海瑛 孙 辉 张丹丹 陈 婷
Graves 病(Graves' disease,GD)是由遗传和环境因素的相互作用导致免疫耐受丧失,自身免疫系统攻击甲状腺所引起的疾病。 GD 是儿童甲状腺功能亢进症最常见的原因,在儿童时期相对发生率不高,为(0.9 ~14.1)/10 万,在青春期达到高峰,女性多于男性[1~4]。 目前已报道的与GD 相关的环境因素主要包括碘、硒、辐射、吸烟、感染、维生素D、压力、雌激素、免疫调节剂和甲状腺化学干扰物等[5]。 这些环境因素主要通过直接影响甲状腺功能或引起自身免疫反应,间接破坏甲状腺组织来诱发疾病的发生[6]。
本研究采用超高效液相色谱-四极杆飞行时间质谱法(UHPLC-QTOF/MS)分析初诊未治GD 儿童血清中低分子环境干扰物水平,并与正常儿童比较,以期发现影响GD 发病风险的新环境干扰物。
对象与方法
1.研究对象:选取2017年3月~2018年10月首次就诊于苏州大学附属儿童医院的初诊GD 患儿30例作为实验组(GD 组),同时收集同期在笔者医院行健康体检,其年龄、性别与GD 组相匹配的健康儿童30 例作为对照组。 所有研究对象均长期生活在苏州市内。 GD 诊断参考《中国甲状腺疾病诊治指南——甲状腺功能亢进症》和《European Thyroid Association Guideline for the Management of Graves' Hyperthyroidism》[9,10]。 所有受试者均进行一般性体格检查和实验室评估,排除肝功能异常、心血管并发症或其他内分泌及免疫性疾病。 另外受试者均为青春期前儿童。通过Tanner 分期来评估青春期发育,只有睾丸体积<4ml的男孩和乳房发育为Tanner Ⅰ期的女孩被纳入研究[1]。 本研究通过苏州大学附属儿童医院医学伦理学委员会审批(伦理审批号:2020CS020),在研究对象签署知情同意书的基础上,进行血样本的采集。
2.一般资料及临床指标:本研究收集就诊时患儿年龄、性别、体重、甲状腺功能及甲状腺自身抗体指标。甲状腺功能及抗体均利用电化学发光免疫分析法在苏州大学附属儿童医院实验室进行检测。 于早晨8:00时抽取空腹静脉血2ml,置于-80℃保存,待集中检测。
3.质谱法检测低分子物质:采用超高效液相色谱-四极杆飞行时间质谱法(UHPLC-QTOF/MS)测定血清中的低分子代谢物水平。
4.仪器与试剂:超高效液相(1290UHPLC)购自美国Agilent 公司,;高分辨质谱(Triple TOF 6600)购自美国AB Sciex 公司;离心机(Heraeus Fresco17)购自美国Thermo Fisher Scientific 公司;天平(BSA124S-CW)购自德国Sartorius 公司;纯水仪(明澈D24 UV)购自德国Merck Millipore 公司;超声仪(PS-60AL)购自深圳市雷德邦电子有限公司;色谱柱(ACQUITY UPLC BEH Amide 1.7μm 2.1 × 100mm)购自美国Waters 公司。 实验用甲醇、乙腈、乙酸铵、氨水(来自CNW Technologies),L-2-氯苯丙氨酸购自上海恒柏生物科技有限公司,实验用水为纯水。
5.实验过程[11]:取100μl 样本,加入400μl 含有内标的提取液(甲醇∶乙腈体积比为1∶1,内标浓度为2μg/ml),涡旋混匀30s;超声5min(冰水浴);-20℃静置1h;将样本4℃,12000r/min 离心15min;取出425μl 上清于EP 管中;在真空浓缩器中干燥提取物;向干燥后的代谢物加入100μl 提取液(乙腈∶水体积比为1∶1)复溶;涡旋30s,冰水浴超声10min;将样本4℃,12000r/min 离心15min;取出60μl 上清于2ml LC/MS 进样瓶,每个样本各取10μl 混合成QC 样本,再取60μl 进行UHPLC-QTOF-MS 分析。
6.利用电感耦合等离子体质谱(ICP-MS)测定血清中的总碘,实验方法参考既往研究[12]。
7.统计学方法:两组间筛选的低分子代谢物数据利用多元变量统计分析和单变量统计分析进行联合分析,本项目使用的卡值标准为P<0.05,同时OPLS-DA 模型第一主成分的变量投影重要度(variable importance in the projection, VIP) >1.2,且该物质在该组对比两组实验间的倍数关系(fold change,FC) >1.20 或<0.83。 两组间总碘水平的对比利用SPSS 25.0 统计学软件包进行统计分析。 符合正态分布的计量资料采用t检验方法,以均数±标准差(±s)表示;不符合正态分布的计量资料均采用秩和检验,以中位数(四分位数间距)[M(Q1,Q3)]表示。 之后采用Logistic回归分析找出与GD 发病最相关的物质。差异低分子环境干扰物与GD 组临床指标之间的关系利用Spearman相关性分析,以P<0.05 为差异有统计学意义。
结 果
1.一般资料:对GD 组和对照组一般资料进行对比分析,两组间性别、年龄未见明显差异,GD 组体重明显低于对照组[24.86(20.38,28.25)kg vs 26.48(22.73,29.16)kg,P<0.001]。 另外,GD 组FT3(17.57 ± 9.24pmol/L vs 6.02 ± 0.49pmol/L,P<0.001)水平明显高于对照组,FT4(55.86 ±31.09pmol/L vs 17.67 ± 2.06pmol/L,P<0.001)水平明显高于对照组,TSH (0.0067 ± 0.0039mIU/L vs 2.6100 ±1.3100mIU/L,P<0.001)水平明显低于对照组。
2.总碘水平的差异:用非参数检验对不符合正态分布的碘离子进行统计学分析得出碘离子浓度在GD组为115.90 (78.70,143.28) μg/L,在对照组为70.02(55.18,83.25)μg/L,GD 组明显高于对照组,差异有统计学意义(P<0.01)。
3.基于非靶向代谢组学筛选GD 组与对照组间差异环境干扰物:基于非靶向代谢组学技术筛选出21 种差异低分子环境干扰物。 与正常对照组比较,有15 种低分子干扰物在GD 组升高,6 种在GD 组降低(图1)。
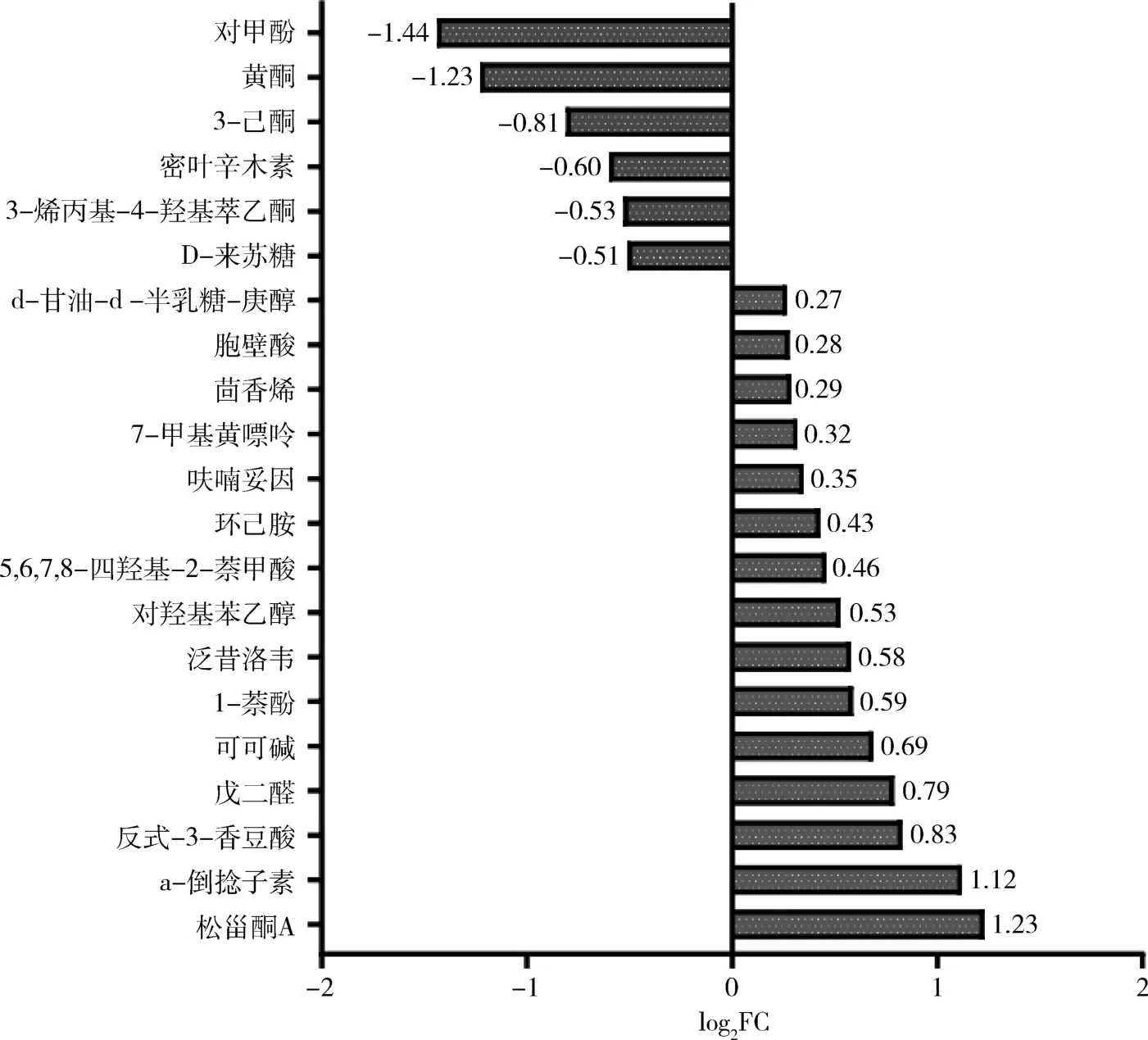
图1 两组间显著性差异低分子环境干扰物
4.GD 环境干扰物的Logistic回归分析:用单变量二元逻辑回归来分析差异低分子环境干扰物及总碘与GD 之间的相关性(表1),在排除来源不明、标准差过大或Exp(β)值接近于1 的物质后,对符合条件的6 种物质(包括黄酮、D-来苏糖、密叶辛木素、3-烯丙基-4-羟基苯乙酮、3-己酮和葡萄甾酮A)进行多因素二元Logistic逐步前进回归分析(表2)。 结果提示密叶辛木素是GD 的独立保护因素,P=0.002,Exp(β) =0.001;松甾酮A 是GD 的独立危险因素,P=0.007,Exp(β) =14.136。
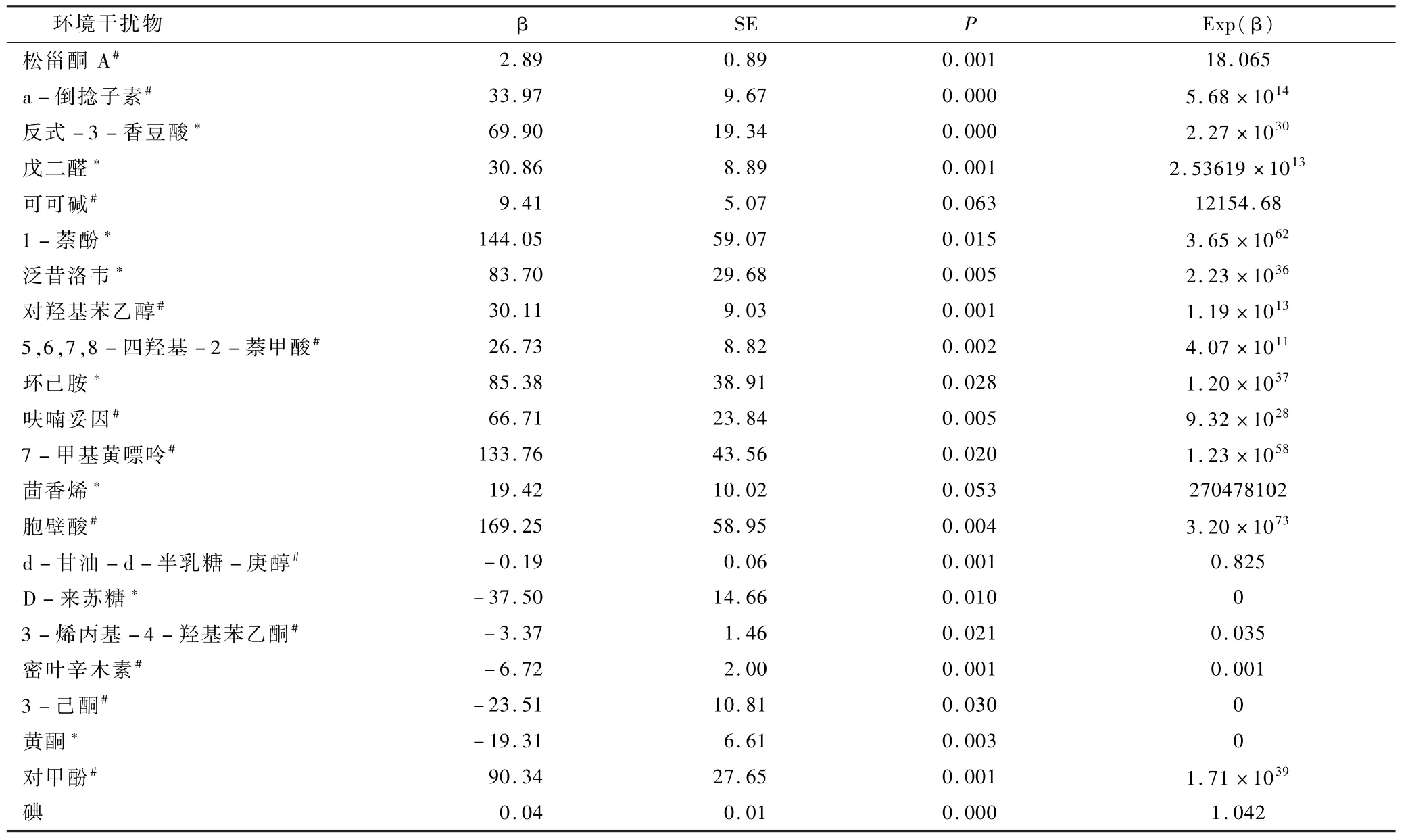
表1 环境低分子干扰物的单因素二元Logistic 回归分析
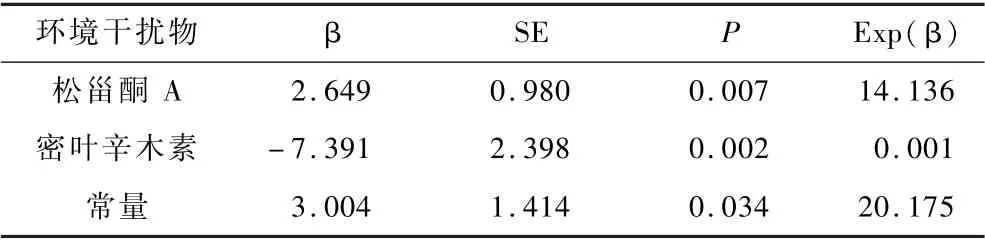
表2 GD 显著相关环境干扰物的多因素二元Logistic 逐步回归分析
5.GD 组中差异环境干扰物与甲状腺临床指标的相关性分析:用Spearman对以上两组间差异有统计学意义的环境干扰物与临床指标之间进行统相关性分析(P<0.05,图2)。 根据相关系数>0.4 进行筛选,结果表明,黄酮、1-萘酚、对甲酚、密叶辛木素和5,6,7,8-四羟基-2-萘甲酸与TPOAb呈负相关,呋喃妥因和反式-3-香豆酸与TPOAb 呈正相关。茴香烯与TRAb 呈正相关。 7-甲基黄嘌呤与TSH 和TGAb 呈负相关,泛昔洛韦与FT4呈正相关,5, 6,7,8-四羟基-2-萘甲酸与TT3、FT4、TT4呈正相关,D-来苏糖与TT3呈负相关,与FT4呈负相关,3-烯丙基-4-羟基苯乙酮与FT3、TT3呈负相关。
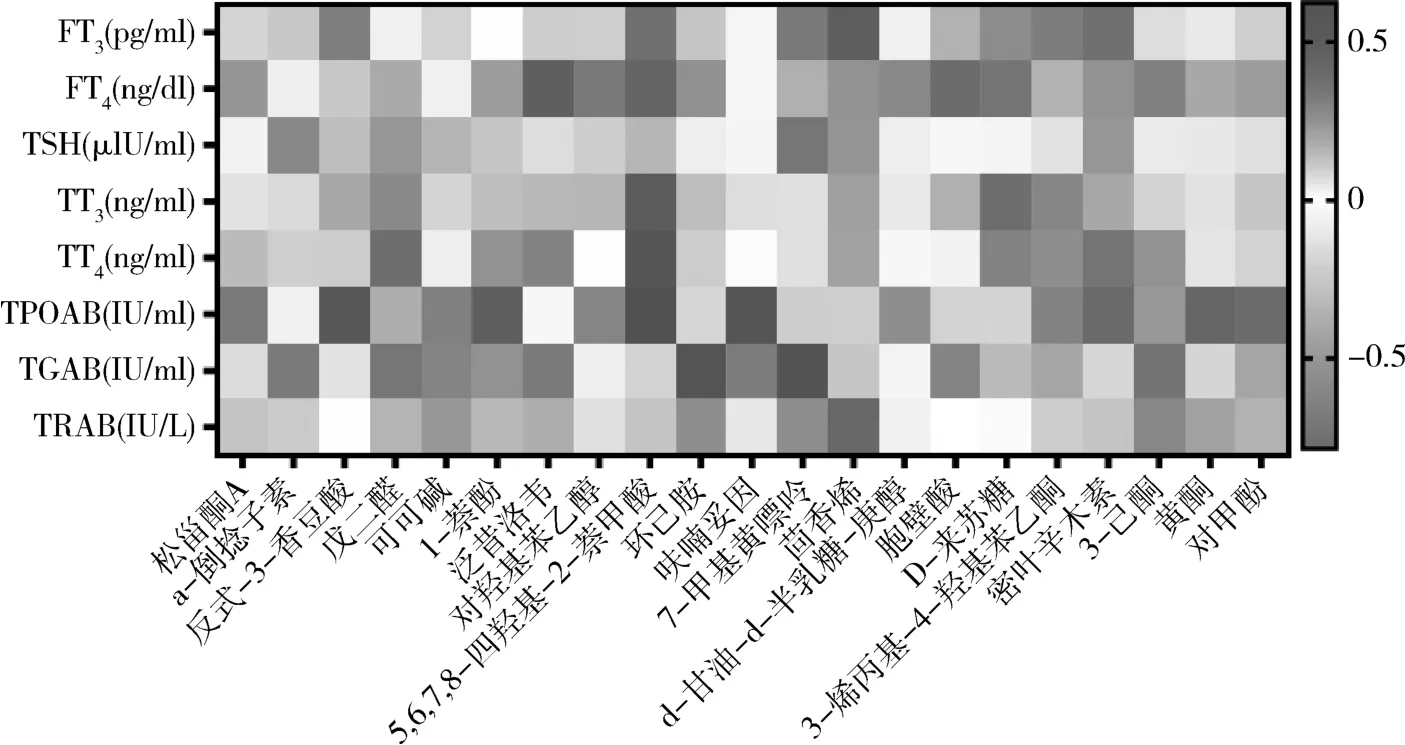
图2 GD 组差异性低分子环境干扰物与甲状腺功能及自身抗体之间的相关性分析
讨 论
GD 的发病风险和病情进展受到多种环境因素影响,有研究者认为,辐射、碘摄入和环境毒物与GD易感性最相关[5,14]。 基于UHPLC-QTOF/MS 的非靶向技术可对有机体内代谢物进行全面、系统的分析,实时揭示机体生理病理状态,并能够从广泛大量的数据中提取有用的差异数据[15]。 该技术既往在多种自身免疫性疾病,如类风湿关节炎或多发性硬化中均有应用[16,17]。 但鲜有研究将该技术应用于与儿童GD 筛查环境内分泌干扰物。
本研究结果表明,松甾酮A 在GD 组明显升高,并作为GD 的独立危险因素。 松甾酮A 属于蜕皮激素的一种,来源于罗汉松等植物及蟹等甲壳类动物[18,19]。 既往虽然尚无松甾酮A 与甲状腺疾病之间相关性的报道,但其他的水产(如剑鱼)被证明是产后甲状腺炎的危险因素[20,21]。 本研究对象均生活在苏州市,苏州市作为水乡,盛产鱼、虾、蟹,当地居民饮食中此类食物消耗较大。 因此,松甾酮A 可能是苏州市当地GD 的一个特异性危险因素,但该结论尚需更大样本量的研究证实。 本研究还发现,密叶辛木素可作为GD 独立保护因素,并与TPOAb 呈明显负相关。 密叶辛木素属于倍半萜类天然产物,植物苔类是其丰富来源[22]。 既往研究发现,密叶辛木素作为中药的成分具有抗三阴性乳腺癌作用和密叶辛木素抗菌活性[23,24]。 目前尚缺乏密叶辛木素与甲状腺之间关系的研究。 其具体机制尚需开展进一步动物研究进行验证。
黄酮类化合物包括木犀草素和芹菜素等物质,广泛存在于水果、蔬菜和坚果等食物中,与日常生活息息相关[25]。 黄酮具有多种生物活性,如抗病毒、抗炎、抗过敏、抗氧化等,并在动脉粥样硬化、糖尿病及癌症等疾病中起保护作用[26]。 研究表明,黄酮可以调节甲状腺激素(thyroid hormone,TH)的合成和分泌。 Sartelet 等[27]研究发现,黄酮与甲基硫氧嘧啶结构相似,能够抑制TPO 活性。 Panda 等[28]研究发现,在四氧嘧啶诱发的糖尿病小鼠模型中,芹菜素可以有升高TH 水平的作用,而在正常小鼠中则使TH 水平降低。 另外类异黄酮也被证明与甲状腺功能相关,一项研究发现,女性异黄酮的摄入量与TSH 升高存在相关性[29]。 此外,异黄酮作为一种植物雌激素,大量补充还可以使亚临床甲状腺功能减退症发展成为甲状腺功能减退症的概率增加[30]。 本研究发现,GD 组黄酮浓度明显较对照组降低,与既往研究结果一致,由此推测黄酮可能通过抑制TH 合成对儿童GD 起到保护作用。 此外,本研究还发现,GD 组黄酮与TPOAb 水平呈负相关,后者作为一种氧化应激的诱导因子,可反映GD 患者的OS 水平[31]。 推测TPOAb 与黄酮水平的负相关可能与黄酮的抗氧化活性有关。黄酮在GD 患者中的抗氧化作用及潜在的有益作用有待于进一步研究予以证实。
呋喃妥因是一种广谱抗生素,既往是预防尿路感染复发的一线用药,也常被置于饮用水或饲料中喂养牲畜鱼类[32]。 虽然中国已经禁止畜牧业和渔业中呋喃妥因的滥用,但呋喃妥因在水产品中超标的事件仍屡有报道。 呋喃妥因可诱发患者出现多种自身免疫性疾病,包括自身免疫性肝脏和肺疾病,ANCA 相关性血管炎以及亚临床红斑狼疮等[33~35]。 呋喃妥因作用于体液免疫和细胞免疫,使自身抗体生成增加,也可以刺激Th 细胞生成,并影响其与抑制性T 细胞之间的平衡[36,37]。 目前甲状腺疾病与呋喃妥因之间的关系尚不明确。 本研究结果表明,呋喃妥因在GD 组中水平升高,并与TPOAb 水平呈正相关。 呋喃妥因对GD 病情的影响还有待于进一步研究明确。
综上所述,GD 是一种受遗传和环境因素共同影响的复杂疾病。 除既往已报道的环境因素外,仍有很多与GD 发病风险或疾病进程相关的环境干扰物尚待发现。 在本研究中,笔者通过质谱方法筛查出几个可能参与儿童GD 发病机制的新因素,深入研究其具体的分子机制有助于为GD 的预防或治疗提供新的思路。

