环氧化酶抑制剂对压力超负荷性心肌肥厚大鼠的作用及机制研究
王静文 魏明慧 孙浩荣 蒋碧辉 薛明明
心血管疾病(cardiovascular disease,CVD)是造成我国居民死亡和疾病负担的首要病因,而血压升高是CVD 中最常见的潜在危险因素[1,2]。 压力超负荷性心肌肥厚(pressure-overload induced cardiac hypertrophy,POH)是对高血压的适应性和代偿机制,早期阶段心肌细胞增大、蛋白质合成增多、肌节增长,从而维持心室功能[3~5]。 然而,持续的压力超负荷会使心脏进入失代偿阶段,并促使心肌细胞凋亡和纤维化重构,收缩和舒张功能障碍,最终导致心力衰竭[6]。
环氧化酶(cyclooxygenase,COX)有两个异构体,COX-1 介导生理性前列腺素形成,COX-2 存在于炎症部位,受外界细胞因子刺激时大量表达[7]。 非选择性COX 抑制剂阿司匹林和特异性COX-2 抑制剂塞来昔布可通过抑制COX-2 实现解热、抗炎和镇痛作用[8,9]。 Notch 信号通路由Notch 跨膜受体、跨膜配体和细胞内效应器分子组成。 当配体与胞外结构域结合时,促进NICD 胞内释放和核移位,调节下游靶基因Hes1 的表达[10]。 有研究证实,Notch 信号通路通过Notch1 受体调节心脏对压力的反应,对心脏具有保护作用[11]。
目前关于阿司匹林和塞来昔布抗压力超负荷性心肌肥厚作用的机制报道甚少,本实验拟探究阿司匹林和塞来昔布是否通过Notch1 信号通路缓解压力超负荷介导的心肌肥厚。
材料与方法
1.实验动物及细胞株:SPF 级雄性Wistar 大鼠60只,体质量为200 ±20g,由内蒙古医科大学实验动物研究中心提供,动物合格证号:SCXK(蒙)2014-0011;大鼠H9c2(2-1)心肌细胞,购自中国科学院细胞库(上海)。
2.主要试剂与仪器:阿司匹林肠溶片购自中国辰欣药业股份有限公司;塞来昔布胶囊购自中国辉瑞制药有限公司;乙酰水杨酸购自上海易恩化学技术有限公司;塞来昔布购自美国Biovision 公司;免疫组化试剂盒、Notch1 抗体、Hes1 抗体购自北京博奥森有限公司;RNAiso Plus Total RNA 试剂盒购自宝生物工程(大连)有限公司;RevertAidTM第一链cDNA 合成试剂盒购自赛默飞世尔科技(中国) 有限公司;SYBR Green PCR 试剂盒购自日本TaKaRa 公司;ANP、Hes1蛋白抗体购自英国Abcam 公司;Notch1 蛋白抗体购自美国CST 公司。 无创尾动脉血压仪(BP-300A)购自中国四川成都泰盟科技有限公司;超声心动图检测仪(ACUSON SC2000)购自德国Siemens 公司;机械牵张装置(Mechano Culture FX2)购自美国Cellscale公司。
3.动物模型的制备和分组:大鼠随机分为假手术组、模型组、模型+阿司匹林组(简称阿司匹林组)和模型+塞来昔布组(简称塞来昔布组)。 腹主动脉缩窄术(abdominal aortic constriction,AAC)以及给药剂量参考文献[12],于第8、10、12 周观察实验指标。
4.无创血压测量:取材前进行血压测量,记录平均收缩压(arterial systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)和心率(heart rate,HR)。
5.左心室质量指数测定:称取体质量,取出心脏后预冷0.9%氯化钠溶液冲洗残余血液,滤纸吸干,迅速分离左心室,称重并计算左心室质量指数(left ventricular mass index,LVMI)。
6.超声心动图检测:取材前行超声心动图检测,采集左心室射血分数(left ventricular ejection fraction,LVEF)、左心室短轴缩短率(left ventricular fractional shortening,LVFS)、左心室舒张末期内径(left ventricular internal diameter at end-diastole,LVIDd)、左心室收缩末期内径(left ventricular internal diameter at end-systole,LVIDs)、左心室舒张末期容积(left ventricular volume at end-diastole,LVEVd)和左心室收缩末期容积(left ventricular volume at end-systole,LVEVs)。
7.免疫组织化学染色及定量:按免疫组化试剂盒说明书步骤操作。 孵育Notch1、Hes1 抗体,400 倍视野下,获得每张图像的3 个随机场。
8.qRT-PCR:提取心肌组织的总RNA,反转录cDNA 为模板进行荧光定量PCR。 各基因相对表达量用2-ΔΔCt表示。 引物序列详见表1。

表1 qRT-PCR 引物序列
9.细胞培养与分组:H9c2 细胞随机分为正常对照组、机械牵张(mechanical stretch,MS)组、MS + 阿司匹林组、MS +塞来昔布组、阿司匹林对照组和塞来昔布对照组。 20% 水平牵张力牵张细胞2h 诱导肥大,药物干预浓度分别为2mmol/L 阿司匹林和25μmol/L 塞来昔布。
10.细胞转染:Lipo8000TM介导Notch1 小干扰RNA(siRNA-Notch1)转染,转染后将细胞接种于弹性硅胶皿中,药物干预同上。 转染后分为正常对照组、MS 组、MS + 阿司匹林组、MS + 阿司匹林+ si-Notch1 组、MS + 塞来昔布组、MS + 塞来昔布+ si-Notch1 组、阿司匹林对照组、塞来昔布对照组和si-Notch1 组。
11.Western blot 法检测:BCA 法蛋白定量后SDS-PAGE 电泳、转膜、封闭、孵育一抗(1 ∶1000 稀释)和荧光二抗(1∶1000 稀释),扫描条带,ImageJ 定量分析灰度值。
12.统计学方法:应用GraphPad Prism 8.0 统计学软件对数据进行统计分析。 计量资料以均数± 标准差(±s)表示。 组间比较采用Tukey事后检验的方差单因素分析,以P<0.05 为差异有统计学意义。
结 果
1.阿司匹林和塞来昔布可减轻POH 大鼠心脏形态的变化:模型组LVMI 较假手术组升高,提示压力超负荷性心肌肥厚大鼠造模成功;给药10、12 周后LVMI 较模型组降低(P均<0.05,表2)。
表2 各组大鼠左心室质量指数(n =5,±s)

表2 各组大鼠左心室质量指数(n =5,±s)
与同时间假手术组比较,*P <0.05;与同时间模型组比较,#P <0.05
时间假手术组模型组阿司匹林组塞来昔布组8 周3.72 ±0.06 4.44 ±0.18* 4.22 ±0.194.29 ±0.14 10 周 3.84 ±0.16 4.64 ±0.10* 4.09 ±0.07# 4.21 ±0.07#12 周 3.55 ±0.06 4.69 ±0.09* 3.85 ±0.21# 3.99 ±0.07#
2.阿司匹林和塞来昔布可抑制POH 大鼠心脏功能的下降和动脉血压升高:M 型超声心动图的代表性图像(图1)。 模型组LVEF 和LVFS 较假手术组降低,LVIDd、LVIDs、LVEVd、LVEVs 较假手术组升高,给药10、12 周后LVEF、LVFS 较模型组升高,LVIDd、LVIDs、LVEVd、LVEVs 较模型组降低(P均<0.05,图2)。 取材前测量动脉血压,模型组SBP、DBP、HR 较假手术组升高,给药后这些参数趋于正常(P均<0.05,表3)。
表3 各组大鼠的血压参数(±s,n =5)

表3 各组大鼠的血压参数(±s,n =5)
与同时间假手术组比较,*P <0.05;与同时间模型组比较,#P <0.05
时间组别SBP(mmHg)DBP(mmHg)HR(次/分)假手术组92.29±3.1176.95±7.11293.20±19.16 8 周模型组119.03±4.96* 100.51±2.90* 399.80±16.76*阿司匹林组 105.17±4.96#86.57±5.41# 319.40±28.86#塞来昔布组 102.84±5.69#85.26±8.23# 310.40±27.58#10 周假手术组93.01±8.5481.90±4.76301.20±27.13模型组135.17±12.28* 107.90±10.93* 397.60±11.11*阿司匹林组 103.42±4.25#85.77±5.91# 306.00±11.75#塞来昔布组 104.29±6.05#87.68±7.39# 318.40±22.69#12 周假手术组94.80±8.0178.94±6.42307.00±21.99模型组144.37±11.14* 118.31±7.28* 405.40±18.77*阿司匹林组93.58±5.51#79.18±6.88# 310.40±11.96#塞来昔布组 100.33±7.85#83.97±9.30# 306.40±10.93#

图1 M 型超声心动图的代表性图像(实线箭头所示为LVIDd,虚线箭头所示为LVIDs)

图2 各组大鼠M 型超声检测结果(n =5,±s,*P <0.05)
3.阿司匹林和塞来昔布上调POH 大鼠的Notch1信号通路:免疫组化染色结果显示,模型组Notch1 和Hes1 蛋白表达较假手术组降低,给药后Hes1 蛋白较模型组表达升高,阿司匹林组(10、12 周)和塞来昔布组(12 周)Notch1 蛋白较模型组表达升高(P均<0.05,图3 中A 和B)。 qRT-PCR 结果显示,模型组Notch1 和Hes1mRNA 表达较假手术组降低,给药后Notch1 和Hes1mRNA 较模型组表达升高(P均<0.05,图3 中C 和D)。

图3 阿司匹林和塞来昔布对Notch1 信号通路的影响
4.阿司匹林和塞来昔布通过上调Notch1 信号通路缓解MS 诱导的细胞肥大:药物干预MS 诱导的心肌细胞48h 可降低ANP 蛋白的表达(P均<0.05,图4)。 MS 组Notch1 和Hes1 蛋白表达较正常对照组降低,药物干预后Notch1 和Hes1 蛋白表达较MS 组增加(P均<0.05,图5)。
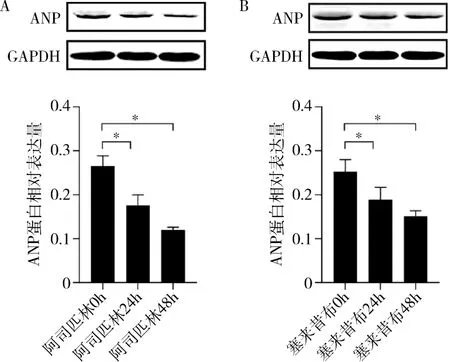
图4 Western blot 法检测阿司匹林和塞来昔布干预时间

图5 Western blot 法检测阿司匹林和塞来昔布对Notch1 信号通路的影响
5.敲低Notch1 的表达抑制了阿司匹林和塞来昔布对MS 诱导细胞肥大的保护作用以及对Notch1信号通路的影响:与MS +阿司匹林组比较,MS + 阿司匹林+si-Notch1 组ANP 蛋白显著升高,塞来昔布亦如此(P均<0.05,图6A);与MS + 阿司匹林组比较,MS + 阿司匹林+ si-Notch1 组Notch1、Hes1 蛋白显著降低,塞来昔布亦如此(P均<0.05,图6 中B 和C)。

图6 Western blot 法检测敲低Notch1 后对ANP 蛋白和Notch1 信号通路的影响
讨 论
体内实验与体外实验共同揭示了阿司匹林和塞来昔布抗压力超负荷性心肌肥厚的分子机制。 阿司匹林和塞来昔布显著减轻了AAC 诱导的大鼠心肌肥厚和MS 诱导的H9c2 心肌细胞肥大。 体内实验与体外实验结果一致,表明阿司匹林和塞来昔布上调了Notch1 及其下游靶基因Hes1 的表达。 敲低Notch1的表达显著逆转了阿司匹林和塞来昔布抗心肌肥厚的作用以及其对Notch1 信号通路的调控。
压力超负荷性心肌肥厚的发生机制尽管还没有完全明确,但主要由于高血压所造成的血液压力超负荷,从而促使心肌细胞蛋白质合成、肌节数量以及单个心肌细胞体积的增加[13]。 压力超负荷性心肌肥厚随着时间的推移,往往伴随着心脏形态、结构和功能的改变,本研究采用8、10 和12 周3 个时间点进行观察。
M 型超声心动图评价大鼠心功能,AAC 可诱导大鼠左心室肥厚和左心功能下降,具体表现为舒张末期和收缩末期LVID、LVEV 升高以及LVEF、LVFS 下降。 给药10 和12 周后上述现象可被缓解,因此阿司匹林和塞来昔布可改善AAC 诱导大鼠左心室肥厚和左心功能下降。 动脉血压与LVMI 测定结果也同样证实了这一点,且肥厚心肌形态的改变要早于结构和功能的改变。
既往研究表明,机械牵张引发的压力超负荷会促进炎性反应导致心肌肥厚[14]。 Notch1 作为机械压力感受性蛋白,它的激活可保护心肌细胞免受损伤,反之加剧心肌肥厚和纤维化[15]。 为了进一步探究Notch1 信号通路以及其是否在阿司匹林和塞来昔布的抗心肌肥厚过程中起关键作用,本实验于药物处理前后对Notch1 信号通路表达进行检测,并通过转染小干扰RNA 敲低Notch1 表达。 结果表明,在AAC 诱导的心肌肥厚大鼠和MS 诱导的肥大细胞中Notch1、Hes1 表达下调,阿司匹林和塞来昔布能够部分恢复Notch1 信号通路,而敲低Notch1 后其通路被阻断,心肌肥厚标志物ANP 的表达显著上调,反向验证了阿司匹林和塞来昔布对心肌肥厚的抑制可能是通过上调Notch1 信号通路实现的。
综上所述,阿司匹林和塞来昔布通过激活Notch1信号通路对压力超负荷性心肌肥厚发挥保护作用。 在未来研究中,环氧化酶抑制剂对机械压力感受性蛋白Notch1 表达的具体调控机制仍有待于进一步研究。

