基于转录组测序探讨锁阳提取物对线虫衰老的影响
胡梦圆,苏 磊,张昕雨,张雅丽,李玲玲,鲁 艺
(北京中医药大学中医学院,北京 100029)
衰老是机体多器官、多组织、全面的渐进性退化过程,是许多慢性病、退行性疾病(阿尔兹海默症和帕金森病等)和死亡发生的重要风险因素[1]。随着社会进步和医疗水平的不断提高,人们的寿命明显延长,老年人口( 60岁及以上)的相对数量(占总人口的百分比)和绝对数量(老龄数值)均呈现明显的增幅[2],故抗衰老的研究具有重要的社会意义。目前关于衰老的研究理论主要有自由基衰老理论[3]、线粒体学说[4]、端粒学说[5]、热量限制学说[6],其机制仍不明确,尚无有效干预药物。中药锁阳为锁阳科植物锁阳的干燥肉质茎,可以补肾阳、益精血、润肠通便,用于治疗肾阳虚衰、精血不足所导致的阳痿、遗精、滑泄、不孕、腰膝酸软、筋骨无力,也可用于治疗由血虚精亏导致的肠燥便秘[7]。现代科学研究发现,锁阳具有抗氧化[8]、保护神经系统[9]、调节激素水平[10]及糖脂代谢[11]等作用,可能具有潜在抗衰老作用。本实验观察了锁阳乙酸乙酯提取物(ECS)对秀丽隐杆线虫衰老的影响,并结合转录组测序技术预测其可能的作用机制,现将结果报道如下。
1 实验材料与方法
1.1实验动物 野生型秀丽隐杆线虫由北京中医药大学刘永刚老师课题组惠赠。
1.2实验药物及主要试剂 中药锁阳(北京同仁堂饮片有限公司)。尿嘧啶缺陷型大肠杆菌(E.coli OP50,北京中医药大学刘永刚老师课题组惠赠)。琼脂粉、蛋白胨、酵母提取物、二甲基亚砜(DMSO)、磷酸二氢钾、磷酸氢二钾、氯化钠、硫酸镁、氯化钙、胆固醇、氢氧化钠、左旋咪唑,北京拜尔迪生物技术有限公司;石油醚、乙酸乙酯、无水乙醇,北京虹湖联合化工有限公司。
1.3主要实验器材 W-CJ-2FD超净工作台,苏州净化设备有限公司;SPX-100B-Z 微电脑生化培养箱,上海博讯有限实业有限公司;Leica EZ4W体式显微镜,德国徕卡。
1.4实验方法
1.4.1ECS的制备 锁阳饮片打粉,60目过筛。中药粉的质量与70%乙醇1∶10浸泡过夜(200 g粉需要2 L 70%乙醇)。第2天收集滤液,然后加2 L 70%乙醇超声1 h,收集上清液,加1 L 70%乙醇超声45 min,收集上清液,加1 L乙醇超声30 min,收集上清液,加热旋蒸至无醇味。分别用石油醚和乙酸乙酯按照2∶1的比例萃取浓缩液的乙酸乙酯极性部分。将乙酸乙酯有机层用旋蒸仪减压浓缩后制成冻干粉备用。ECS提取率为2.36%,杂质<2%,总灰分<12%,符合药典标准。
1.4.2线虫的饲养及给药方法 E.coli OP50在37 ℃恒温培养箱中培养8 h后,滴加到NGM上,转入线虫后22 ℃恒温饲养。取0.1 g ECS冻干粉溶于100 μL DMSO,配制成1 000 mg/mL母液。将ECS母液与E.coli OP50混合成不同的浓度后,取100 μL滴加到NGM培养基上,室温培养24 h后用于正式实验。
1.4.3同步化处理 无菌条件下挑取100条处于产卵期的成虫,置于铺有E.coil 的培养基上,待产卵2~4 h后将成虫全部转移。将余下的产卵板放置于22 ℃恒温生化培养箱中,培养线虫至L4期,使其生长24 h后,作为用于实验的正式线虫。
1.4.4急性热应激实验
1.4.4.1初筛 实验分为空白组和ECS 0.1 mg/mL组、ECS 1 mg/mL组、ECS 5 mg/mL组、ECS 10 mg/mL组。将1.4.3同步化处理后的线虫转入各组培养基。22 ℃培养24 h后,在35 ℃条件下进行急性热应激实验,每板16条,实验平行重复3次。每2 h从35 ℃培养箱取出统计线虫的存活数量,直至所有线虫全部死亡,计算线虫平均生存时间和最长生存时间。线虫死亡标准为显微镜下虫体多次用picker触碰没有反应,虫体完全丧失运动能力。
1.4.4.2复筛 实验分为空白组和ECS 0.1 mg/mL组、ECS 0.4 mg/mL组、ECS 0.8 mg/mL组。将1.4.3同步化处理后的线虫转入各组培养基。22 ℃分别培养24 h、3 d、5 d,在35 ℃条件下进行急性热应激实验,每板16条,实验平行重复3次。判断标准同1.4.4.1。
1.4.5寿命实验 将1.4.3同步化处理后的线虫转入空白组、ECS 0.1 mg/mL组、ECS 0.4 mg/mL组、ECS 0.8 mg/mL组的NGM培养基上,22 ℃培养,每个浓度3个平行板,每板30条。实验过程中为防止新生幼虫影响计数,前期线虫每隔24 h更换1次含有相同药物浓度及E.coli OP50的NGM培养基,待没有新生幼虫后,每2~3 d更换1次培养基。初始时间记为第0天,每24 h统计1次线虫的死亡数和存活数,直至所有线虫死亡。所有个体的平均存活时间计为平均寿命,最长生存时间即最大寿命取每个培养基中最后存活10%个体寿命的平均值。
1.4.6生殖实验 将同步化L4期的线虫转移到空白组、ECS 0.1 mg/mL组、ECS 0.4 mg/mL组、ECS 0.8 mg/mL组的培养基中,每组12个平行培养基,每个培养基培养1条线虫,每24 h转移至新的培养基,直至线虫产卵期结束。产卵板在22 ℃的恒温生化培养箱中培养24 h后统计子代数目。每条线虫所有子代数目之和记为该线虫的产卵量。
1.4.7运动能力实验 将1.4.3同步化处理后的线虫转入空白组、ECS 0.1 mg/mL组、ECS 0.4 mg/mL组、ECS 0.8 mg/mL组的培养基中,22 ℃分别培养24 h、3 d、5 d后,测定线虫的运动能力,每组16条。
1.4.7.1头部摆动速率测定 将处理后的线虫放入未添加E.coli OP50的NGM培养基上,经过30 s恢复后,记录线虫30 s内头部摆动次数(线虫头部相对于身体长轴方向摆到一侧记为1次)。
1.4.7.2身体正弦运动速率测定 将处理后的线虫放入未添加E.coli OP50的NGM培养基上,经过30 s恢复后,滴一滴M9缓冲液,记录线虫30 s内的身体正弦运动次数(线虫相对于身体长轴1个波长的移动记为1次身体弯曲)。

1.6转录组测序
1.6.1RNA提取与检测 同步化处理的线虫培养3 d后,Trizol法提取空白组和ECS 0.4 mg/mL组线虫组织总RNA,Nanodrop分光光度计检测RNA纯度,电泳法确定RNA质量。
1.6.2测序数据处理与分析 对Illumina高通量测序的原始图像文件进行碱基识别(Base Calling),并转化为原始测序序列(Sequenced Reads),即原始测序序列构成的集合,称为Raw Data。使用fastp软件对原始数据进行过滤,删除不满足分析标准的reads,得到可用于后续比对、统计以及后续分析的clean reads。使用Fast QC (http://www.bioinformatics.babraham. ac.uk/ projects/fastqc/)在线工具对样本的测序数据质量进行可视化评估。通过一系列的质量控制筛选,得到高质量的clean data。 使用Hisat2软件将clean reads与参考基因组序列进行比对,对每个样品进行单独组装,根据组装结果对每个样品进行统计,统计主要包括组装转录本数目、组装基因数目、转录本长度等。用StringTie将所有样品组装的结果进行合并,得到一个总的转录本注释文件,并引入对应的参考基因组注释信息。使用StringTie软件进行基因和转录本重构,即组装。
1.6.3差异基因的筛选 利用limma包进行有生物学重复或配对的差异比较,利用DESeq包进行没有生物学重复的差异比较。如果项目中既有重复的分组也有单个样本的分组,则所有分组用DESeq的方法进行差异分析。差异基因筛选标准:|log2FC|≥1且p-Value≤0.05。
1.6.4差异表达基因本位数据库(GO)和Pathway显著性富集(KEGG)分析 把目标基因集合和背景基因向GO数据库(http://www.geneontology.org/) 的各个条目映射,计算每个条目的基因数目,利用超几何分布进行假设检验得到富集结果的p-value。以KEGG数据库中的Pathway为单位,应用超几何检验,找出与整个基因组背景相比在差异表达基因中显著性富集的Pathway,得到差异基因显著富集的 GO功能类群和代谢通路,筛选其中显著差异表达基因或通路进行重点分析。
2 结 果
2.1急性热应激实验 ECS 1 mg/mL组、ECS 5 mg/mL组、ECS 10 mg/mL组线虫的平均生存时间和最长生存时间均明显短于空白组(P均<0.05),分别较空白组缩短21.30%,26.56%,33.17%;ECS 0.1 mg/mL组线虫的平均生存时间和最长生存时间与空白组比较差异均无统计学意义(P均>0.05),见图1及表1。后期急性热应激实验显示,ECS各组平均生存时间与空白组比较差异均无统计学意义(P均>0.05),见表2。

表1 急性热应激初筛实验中空白组和锁阳乙酸乙酯提取物各组线虫生存时间比较

表2 急性热应激复筛实验中空白组和锁阳乙酸乙酯提取物各组线虫生存时间比较
2.2寿命实验 ECS 0.4 mg/mL组线虫的平均生存时间明显长于空白组(P<0.05),平均寿命延长了14.85%,中位数寿命延长了2 d;ECS 0.8 mg/mL组线虫的平均生存时间明显短于空白组(P<0.05),平均寿命缩短了19.68%;ECS 0.1 mg/mL组线虫的平均生存时间与空白组比较差异无统计学意义(P>0.05)。各组最长生存时间差异均无统计学意义(P均>0.05)。见图2及表3。
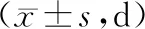
表3 寿命实验中空白组和锁阳乙酸乙酯提取物各组线虫生存时间比较
2.3生殖实验 空白组、ECS 0.1 mg/mL组、ECS 0.4 mg/mL组、ECS 0.8 mg/mL组的产卵量分别是(248.91±22.92)个、(251.70±23.59)个、(254.73±12.54)个、(246.64±23.99)个,各组间比较差异均无统计学意义(P均>0.05)。
2.4运动能力实验 培养24 h后,各组线虫头部摆动速率和身体正弦运动速率比较差异均无统计学意义(P均>0.05);培养3 d和5 d后,ECS 0.4 mg/mL组线虫的头部摆动速率和身体正弦运动速率均明显高于空白组(P均<0.05),且培养5 d提高更加明显。见图3。
2.5转录组测序结果
2.5.1原始测序结果 空白组和ECS 0.4 mg/mL组样本的总RNA浓度分别为0.452 μg/μL和0.572μg/μL,RNA总量和质量均满足测序要求。空白组和ECS 0.4 mg/mL组的原始序列条数分别为42 029 064条和42 573 756条,过滤后序列条数分别为41 435 302条和41 988 044条;过滤后的总碱基数分别为6 196 151 652个和6 279 488 372个,各占原始数据总碱基数的98.28%和98.33%;过滤后序列条数中质量值大于20的碱基数占总碱基数的比例(Q20)分别为98.39%和98.47%,过滤后序列条数中质量值大于30的碱基数占总碱基数的比例(Q30)分别为94.74%和94.97%。说明测序质量较高,能满足进行后续的生信学分析要求。
2.5.2序列比对结果 ECS 0.4 mg/mL组和空白组的序列与参考基因组的比对效率分别为99.06%和98.94%(≥70%),比对到参考基因组序列多个位置的序列分别为1.99%和1.81%(≤10%),表明测序质量及序列比对结果较好,可满足后续分析需求。见表4。

表4 空白组和ECS 0.4 mg/mL组线虫组织转录组测序序列与参考基因组比对结果 条(%)
2.5.3差异表达基因筛选结果 将空白组与ECS 0.4 mg/mL组的测序数据进行比对分析,显示共有604个基因差异表达,其中313个基因上调表达,291个基因下调表达,上调表达基因数约为下调表达基因数的1.07倍,说明摄取ECS之后的线虫有更多的基因通过上调表达来影响其生命过程。见图4。
2.5.4差异表达基因的GO功能注释分析结果 分别从分子功能(Molecular function,MF)、生物学途径(Biological process,BP)和细胞学组件(Cellular component,CC)3个部分对差异表达基因进行GO注释,共富集到1 562个条目。GO功能注释排名前20的条目中,分子功能中差异表达基因富集在4个GO条目,生物学途径中的差异基因富集在12个GO条目,细胞学组件中的差异基因富集在4个GO条目,共富集到391个基因,见图5。
2.5.5差异表达基因的KEGG分析结果 对差异表达的基因进行KEGG分析,差异表达的基因富集于166条通路中,共富集到312个差异基因。排名前20的Pathway见图6和表5,共富集到76个差异基因,22个基因上调,54个基因显示下调。富集差异性最显著的通路是线虫的长寿调节通路,包括1个超氧化物歧化酶(SOD)基因,1个硬脂酰辅酶A去饱和酶 (SCD)基因,1个褪黑素受体(MT)基因,1个脂肪酶(LIPS)基因,3个热休克蛋白(HSP)基因。其次长寿调节通路、溶酶体途径、脂肪酸代谢通路、MAPK信号通路都具有较多的基因富集(≥5)。

表5 空白组和ECS 0.4 mg/mL组线虫组织转录组测序差异表达基因的KEGG分析TOP 20
3 讨 论
秀丽隐杆线虫是第一个已知完整的基因组序列的多细胞真核生物[12],其与人类的同源基因有60%~80%[13],且老年秀丽隐杆线虫表现出许多与年龄相关的microRNA、应激反应基因以及蛋白质的变化,其遗传易处理性、寿命短和明显的年龄依赖性的生理特点,使得它成为衰老研究的一个极具价值的模型[14]。转录组测序技术是进行细胞表型和基因功能研究的重要手段,能够为基因、RNA、蛋白质和其他小分子间的相互作用的机制研究提供更加多维的分析思路[15]。
前期实验鉴定出,ECS有效部分的化学成分主要有原花青素类(B1、B3、B4、B2、B7、B8、B5、B6)、腺苷、儿茶素、水杨酸、表儿茶素、异槲皮苷、表儿茶素没食子酸酯、松苷、木犀草苷、南酸枣苷、叶绿香豆素、根皮苷等[16]。研究发现,原花青素 B2(PCB2)特有的二聚体结构使其具有很强的抗氧化活性[17],可延长线虫的寿命[18]。
本实验结果发现,与空白组相比,ECS 0.4 mg/mL组线虫的平均寿命延长了14.85%,中位数寿命延长了2 d,而高浓度的ECS则体现出一定的不利作用,或许是其药物毒性引起,有待进一步探讨。运动能力下降是衰老的保守表现[19],本实验发现,ECS0.4 mg/mL组线虫培养3 d和5 d后的头部运动能力和身体运动能力均较空白组提高,提示ECS可提高线虫的运动能力,具有抗衰老作用。生殖能力评价是药物安全性评价的关键环节[20],产卵实验显示ECS各组和空白组间产卵量比较差异无统计学意义,说明ECS对线虫产生的影响并不会牺牲其生殖能力。上述研究结果说明中药锁阳具有抗衰老的潜力。
本研究转录组测序结果显示,空白组Q30为94.74%,比对到参考基因组序列的序列效率为98.94%,比对到参考基因组序列唯一位置的序列效率为 98.19%,文献[21]报道的Q30为93.75%,比对到参考基因组序列的序列效率为96.28%,比对到参考基因组序列唯一位置的序列效率为93.66%,与之比较本研究参考基因组序列匹配度更高。KEGG分析显示,差异表达的基因富集于166条通路中,共富集到312个差异基因。在显著性排名前20的通路中,主要涉及长寿调节、脂代谢、药物代谢、激素调节、能量代谢、免疫途径等。长寿调剂通路是与线虫寿命直接相关的通路,也是富集到差异表达基因最显著的通路。其中有5条信号通路与脂代谢直接相关,而脂代谢与衰老及衰老相关疾病的发生有着重要的联系,如脂代谢异常可影响脑衰老进程[22]。卵巢发育及功能对动物的繁殖能力有重要的影响,而视黄醇在哺乳动物繁殖过程中有着重要的调节作用,视黄醇代谢通路和GnRH信号通路均可对生殖系统的功能产生重要影响[23-24]。前期实验发现,ECS有雌激素样作用,可提高去卵巢大鼠的学习记忆能力及血清E2水平[25],但是在产卵实验中并未发现明显差异,ECS对生殖的影响还需进一步探索。外源性物质可影响P450酶对其药物底物的代谢活性,从而影响药物的疗效和不良反应[26]。细胞色素P450代谢通路和黄曲霉毒素生物合成通路[27]的显著性富集或可以作为研究高浓度的ECS是否对线虫的寿命及运动能力产生持续浓度递增效应的着手点。
综上所述,ECS可能通过多途径多基因共同作用而影响秀丽隐杆线虫的寿命和运动能力,其有潜在抗衰老作用,但具体的作用机制还需要进一步进行研究。
利益冲突:所有作者均声明不存在利益冲突。

