鸡CMPK2的原核表达及其抗H9N2禽流感病毒的初步研究
李 鑫,刘炜玮,谭 磊,孙英杰,宋翠萍,廖 瑛,丁 铲,仇旭升*,徐成刚
(1.华南农业大学兽医学院,广东 广州 510642;2.中国农业科学院上海兽医研究所,上海 201100)
病毒侵入机体后经过一系列信号级联反应激活I型、II 型和III 型干扰素(IFN)与各自受体的结合进而导致信号级联的启动,诱导IFN 刺激基因(Interferon-stimulated genes,ISGs)的产生,ISGs 通过作用于病毒复制周期中不同的阶段影响病毒复制、以达到抗病毒作用[1]。胞嘧啶核苷/尿苷一磷酸激酶(Cytidine/uridine monophosphate kinase 2,CMPK2)是一种胸苷酸激酶,该蛋白由N 端未知功能的区域和C 端的胸苷酸激酶结构域组成[2]。CMPK2 在人细胞中主要分布于线粒体,在鱼类细胞中则主要分布于细胞质[3]。已有研究表明CMPK2 通过参与IFN 抗病毒反应,对人类免疫缺陷病毒I 型(HIV-I)和鲤春病毒血症病毒(SVCV)具有抗病毒活性[4-5]。然而,对鸡CMPK2 基因的序列及其功能尚无相关研究。
H9N2 禽流感病毒(AIV)属于正粘病毒科甲型流感病毒属,其属于低致病性禽流感病毒(Low pathogenic avian influenza virus,LPAIV)[6],HA 蛋白裂解位点具有多个不连续的碱性氨基酸[7]。自1992 年在广东省暴发H9N2 禽流感后,该病在全国大部分地区呈地方性流行,能够感染家禽、猪,甚至人类,是目前传播最广、破坏性最强的LPAIV[8-9],对养禽业和公共卫生安全有重要影响。然而鸡CMPK2 是否对H9N2 AIV 具有抑制作用,目前尚未见报道。
因此,本实验经PCR 扩增鸡CMPK2 基因,构建重组质粒p3xFLAG-CMV-14-CMPK2 及重组原核表达质粒pET-28a-CMPK2,获得重组CMPK2 蛋白,制备了其鼠源多克隆抗体,并检测分析了鸡CMPK2抗AIV的功能,丰富了CMPK2在宿主抗禽类病毒免疫中作用的研究。
1 材料与方法
1.1 主要实验材料鸡胚成纤维细胞系(DF-1)和H9N2 AIV[A/swine/Jiangsu/C1/2008(H9N2)]株由本实验室分离及保存;p3xFLAG-CMV-14 空载体由本实验室保存;pET-28a(+)载体购自苏州金唯智生物科技有限公司;大肠杆菌BL21、DH5α 感受态细胞购自上海昂羽生物公司;BALB/c 雌鼠购自上海杰思捷实验动物有限公司;DMEM、Opti-MEM、胎牛血清均购自Gibco 公司;限制性内切酶EcoRⅠ和BamH I 购自Vazyme 公司;质粒提取试剂盒购自QIAGEN 公司;Phanta Max Super-Fidelity DNA 聚合酶购自诺维赞公司;反转录酶购自Promega 公司;SYBR Green Mix 购自广州东盛生物科技有限公司;TRIzol 试剂、Lipofectamine 2000 购 自Invitrogen 公 司;Ni-NTA 亲 和层析介质、甲型流感病毒通用NP(Nucleoprotein)蛋白多克隆抗体购自金斯瑞生物科技有限公司;siRNA由上海吉玛制药技术有限公司合成;鼠源Flag 抗体、兔抗Actin 多克隆抗体、HRP 标记山羊抗鼠IgG(IgG-HRP)和山羊抗兔IgG-HRP 购自CST 公司;鼠源His 标签抗体购自Abmart 公司;弗氏完全佐剂和弗氏不完全佐剂购自美国Sigma 公司。
1.2 鸡CMPK2 基因的PCR 扩增及其编码氨基酸序列的同源性及遗传演化分析根据NCBI 已登录的鸡CMPK2 基因序列(XM_015284945.3),利用Oligo7 软件设计引物:5′-ATGCTGCCAGGCTGCACCTCG-3′/5′-G CTGCAACTAATTAAAAAACACTGTGCCTTGTG-3′,引物由上海生工生物工程技术服务有限公司合成。提取DF-1 细胞基因组为模板,PCR 扩增鸡CMPK2 全基因序列,经测序后采用MEGA7 的ClustalW 方法对其编码氨基酸序列经同源性比对,采用Neighbor-Joining法构建其氨基酸序列的进化树分析其与NCBI中其他物种CMPK2氨基酸序列的遗传进化关系。
1.3 鸡CMPK2 基因重组真核质粒的构建、鉴定及其瞬时表达的western blot 鉴定将获得的鸡CMPK2全基因经EcoR I/BamH I 双酶切后,克隆于p3xFLAGCMV-14 载 体,构 建p3xFLAG-CMV-14-CMPK2 重 组质粒并经EcoR I/BamH I 双酶切和测序鉴定,利用Lipofectamine 2000 转染试剂将其转染HEK293T 细胞中,对照组转染p3xFLAG-CMV-14 空载体质粒。转染24 h 后收集细胞,以鼠抗Flag 抗体(1∶1 000)为一抗,山羊抗鼠IgG-HRP(1∶10 000)为二抗,通过western blot 验证蛋白表达情况。
1.4 鸡CMPK2 重组原核表达质粒的构建及重组蛋白的表达与鉴定根据1.2中对鸡CMPK2基因分析结果,选取其保守片段经密码子优化后克隆于pET-28a(+)载体(插入位点为EcoR I/SalI),构建pET-28a-CMPK2原核表达质粒。将pET-28a-CMPK2 转化BL21 感受态细胞培养至OD600nm值为0.6~0.8时,加入终浓度1 μmol/μL的IPTG,37℃诱导18 h 后收集菌体超声破碎仪裂解,经Ni 柱纯化目的蛋白后采用BCA 蛋白浓度试剂盒测定蛋白浓度,利用鼠抗His 标签抗体(1∶1 000)为一抗,山羊抗鼠IgG-HRP(1∶10 000)为二抗,经western blot 鉴定重组蛋白的表达。
1.5 鸡CMPK2 多克隆抗体的制备及其反应性的western blot 鉴定将纯化的蛋白与弗式完全佐剂等体积混合,按照0.2 mg/只腹腔皮下多点注射6 周龄BALB/c雌鼠,3周后利用弗式不完全佐剂乳化蛋白同剂量多点皮下注射小鼠,3周后按照二免方法三免,每次加强免疫后3 d,通过眼眶采血提取血清按照1∶100、1∶500 稀释作为一抗,山羊抗鼠IgG-HRP(1∶10 000)为二抗,western blot 检测多克隆抗体的反应性。
1.6 H9N2 AIV感染DF-1细胞后鸡CMPK2基因的转录水平和蛋白水平检测将DF-1细胞铺于12孔细胞培养板中,待细胞生长至密度达到80%时,实验组加入MOI 1 H9N2 AIV,对照组加入DMEM 培养基。分别在感染后6 h 和12 h 时收获细胞,利用TRIzol 试剂提取RNA、反转录获得细胞样品cDNA,采用文献中的荧光定量PCR 方法检测细胞内鸡CMPK2 基因的转录水平[10]。同时利用2×loading buffer 裂解收集的感染细胞后以1.3制备的鼠源鸡CMPK2多克隆抗体(1∶500)为一抗,山羊抗鼠IgG-HRP(1∶10 000)为二抗,通过western blot 检测细胞内CMPK2蛋白的表达水平。
1.7 鸡CMPK2 的过表达对H9N2 AIV 复制影响的检测待12 孔细胞培养板中的DF-1 细胞生长至密度达到80%时,利用Lipofectamine 2000 脂质体转染试剂转染p3xFLAG-CMV-14-CMPK2 重组质粒,设p3xFLAG-CMV-14 空载体质粒转染的DF-1 细胞作为阴性对照。转染24 h 后以MOI 0.1 H9N2 AIV 感染细胞,感染后6 h 和12 h 时分别收获细胞,采用TRIzol提取RNA、反转录后获得细胞样品cDNA。利用引物F:CCTGCTTGTGTGTACGGACT/R:GGCTGTTTTGAA GCAGACGG,通过荧光定量PCR 方法检测细胞内H9N2 AIV NP 基因的转录水平。同时利用2×loading buffer 裂解上述收集的细胞,以鼠抗NP 多克隆抗体(1∶1 000)为一抗,山羊抗鼠IgG-HRP(1∶10 000)为二抗,通过western blot检测细胞内NP蛋白的表达水平。利用ImageJ软件进行灰度分析。实验设Actin为内参基因。
1.8 siRNA 干扰下调CMPK2 蛋白表达后对H9N2 AIV 复制影响的检测根据NCBI 中的鸡CMPK2 基因,合成针对CMPK2 基因的特异性siRNA:5′-GCAU AGCACAGCUGCUUAUTT-3′/5′-AUAAGCAGCUGUGC UAUGCTT-3′。采用Lipofectamine2000 试剂将20 pmol(1 μL)对照siRNA(NC siRNA)和CMPK2 siRNA 分别转染DF-1 细胞,36 h 后收获细胞样品。按照1.6 方法,通过荧光定量PCR 和western blot 检测siRNA 干扰CMPK2 表达的效率。干扰36 h 后,利用MOI 0.1 H9N2 AIV 感染细胞,感染12 h 后收集细胞,按照1.7中western blot 方法检测细胞内NP 蛋白的表达水平,检测下调表达CMPK2 蛋白是否影响H9N2 AIV 复制。
1.9 数据分析所有数据均利用Excel 软件进行统计学分析,并采用Graphpad Prism 8 软件作图和差异性分析。本研究所有实验均重复3 次以上。
2 结 果
2.1 鸡CMPK2基因的PCR扩增、同源性及遗传进化分析以DF1细胞cDNA作为模板,PCR扩增鸡CMPK2基因,产物经1%琼脂糖凝胶电泳检测。结果显示,在约762 bp 处出现目的条带(图1),大小与预期相符。经测序后,利用Mega 7(Megasoftware)对鸡、人以及斑马鱼3 个物种的CMPK2 ORF 进行氨基酸序列比对,结果显示鸡CMPK2 与人和斑马鱼的氨基酸序列同源性分别为63.85%和53.36%。以不同物种CMPK2 的氨基酸序列构建遗传进化树,结果显示,鸡CMPK2 与哺乳动物不属同一分支,遗传距离远,但与爬行类动物CMPK2 的遗传关系最近(图2)。根据前期研究,人CMPK2 和鱼类CMPK2 对不同种病毒的复制具有拮抗作用[2],推测鸡CMPK2 与人CMPK2具有相似的抗病毒功能。

图1 鸡CMPK2基因的PCR扩增结果Fig.1 PCR amplification of chicken CMPK2 gene

图2 鸡CMPK2氨基酸序列的遗传进化树分析(鸡源CMPK2标记为*)Fig.2 The phylogenetic tree of chicken CMPK2 amino sequence(Chicken CMPK2 was marked in*)
2.2 重组真核质粒p3xFLAG-CMV-14-CMPK2 的构建、鉴定及CMPK2 瞬时表达的鉴定将鸡CMPK2克隆于p3xFLAG-CMV-14 中,构建的重组质粒利用EcoR I/BamH I 酶切鉴定,结果显示分别在约6 300 bp和800 bp 处出现两条目的片段(图3A),大小与p3xFLAG-CMV-14空载质粒和CMPK2一致,表明正确构建了p3xFLAG-CMV-14-CMPK2重组真核表达质粒。
为了鉴定其细胞内的瞬时表达情况,将p3xFLAGCMV-14-CMPK2 质粒转染至293T 细胞后经western blot 检测,结果显示在37 ku 处出现特异性条带,与预测大小一致,而转染p3xFLAG-CMV-14 对照组无条带(图3B),表明p3xFLAG-CMV-14-CMPK2 重组质粒可以在细胞内瞬时表达。
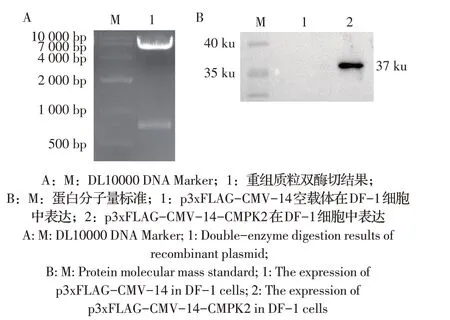
图3 p3xFLAG-CMV-14-CMPK2重组质粒的酶切(A)及蛋白表达的western blot(B)鉴定Fig.3 p3xFLAG-CMV-14-CMPK2 recombinant plasmid digestion(A)and western blot(B)identification of expressed protein
2.3 鸡CMPK2基因原核表达载体的构建及重组蛋白表达的western blot 鉴定结果经PCR 扩增获得CMPK2基因,经密码子优化后将其克隆于pET-28a(+)的EcoR I 和SalI 两个酶切位点之间,构建获得重组质粒pET-28a-CMPK2。将测序正确的重组菌经IPTG诱导表达后,SDS-PAGE 检测结果显示,表达产物大小为17 ku(图4),与理论值一致。

图4 CMPK2重组蛋白western blot鉴定结果Fig.4 The western blot result of CMPK2 recombinant protein
2.4 鸡CMPK2 多克隆抗体的制备及鉴定利用Ni柱纯化重组蛋白后BCA 试剂盒检测蛋白浓度为1.1 μg/mL。Western blot 检测结果显示,纯化蛋白能与His 标签抗体特异性结合,可见特异性单一条带,无其他杂蛋白,纯化效果较好,可用于免疫。
利用纯化蛋白免疫小鼠后收集血清,western blot检测结果显示,在35 ku 处出现目的条带,CMPK2 多克隆抗体条带与Flag 抗体条带大小一致(图5),表明CMPK2 多克隆抗体制备正确,且反应原性良好。
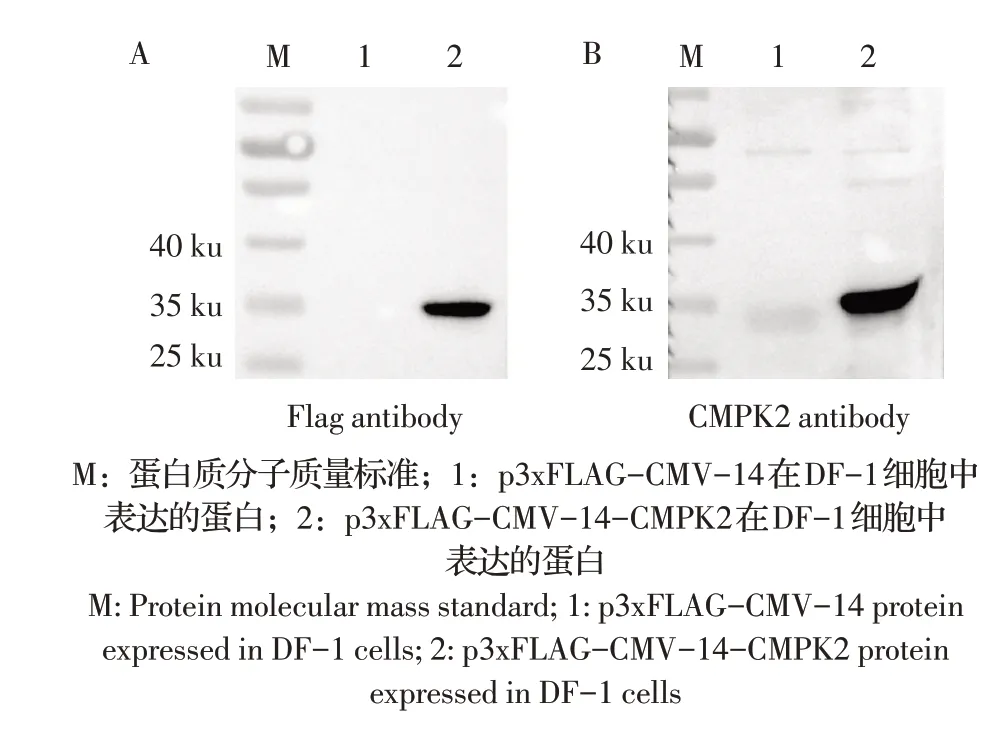
图5 CMPK2多克隆抗体的western blot鉴定结果Fig.5 Identification of CMPK2 polyclonal antibody by western blot
2.5 H9N2 AIV 感染DF-1 细胞后鸡CMPK2 基因转录水平及蛋白表达水平的检测结果为了探究病毒感染后细胞内鸡CMPK2 的变化水平,利用H9N2 AIV感染DF-1细胞,通过荧光定量PCR和western blot检测鸡CMPK2的转录及表达水平。结果显示,与不接种病的对照相比,H9N2 AIV 感染DF-1 细胞6 h、12 h 后,CMPK2 基因转录水平均极显著上调(P<0.001),但随着感染时间的延长其mRNA 水平有下降趋势(图6A);与不接种AIV 的对照相比,感染后6 h CMPK2 的蛋白表达水平显著下降(P<0.001),感染后12 h 则极显著上升(P<0.001)(图6B、6C)。表明CMPK2 参与了H9N2 AIV 感染后机体的免疫应答。

图6 H9N2 AIV感染DF-1后鸡CMPK2 mRNA的相对转录水平(A)、蛋白表达量变化(B)和灰度检测(C)Fig.6 Fold changes in the relative transcription level of chicken CMPK2 mRNA(A),chicken CMPK2 protein(B)and the grayscale analysis(C)after DF-1 infection with H9N2 AIV
2.6 过表达鸡CMPK2 对H9N2 AIV 增殖影响的检测结果为研究鸡CMPK2 对H9N2 AIV 增殖的影响,将p3xFLAG-CMV-14-CMPK2重组质粒转染DF-1细胞后2 h 感染H9N2 AIV,利用荧光定量PCR 和western blot 检测胞内H9N2 AIV NP 基因转录水平和其蛋白表达水平的变化。结果显示,与转染空载体相比在感染AIV 12 h、24 h 后转染p3xFLAG-CMV-14-CMPK2 的细胞中,H9N2 AIV NP mRNA 水平均下降,且在感染24 h 显著下降(P<0.05)(图7A);该细胞内AIV NP 蛋白水平在AIV 感染12 h、24 h 均极显著下调(P<0.001)(图7B、7C)。结果表明,过表达鸡CMPK2蛋白对H9N2 AIV增殖有抑制作用。

图7 转染p3xFLAG-CMV-14-CMPK2的DF-1细胞感染H9N2 AIV后NP mRNA转录水平(A)、病毒NP蛋白表达水平(B)及NP蛋白表达水平灰度分析(C)Fig.7 Fold changes in the relative expression of H9N2 NP mRNA(A),NP protein(B)and Gray analysis(C)of H9N2 NP protein expression level in cells after transfection of recombinant plasmid p3xFLAG-CMV-14-CMPK2 and H9N2 AIV infection
2.7 siRNA 干扰CMPK2 蛋白表达后对H9N2 AIV 复制影响的检测结果将CMPK2 特异性siRNA 和对照NC siRNA 分别转染DF-1 细胞,分别利用荧光定量PCR 和western blot 检测CMPK2 干扰效果。荧光定量PCR 结果显示,与转染对照NC siRNA 相比,转染CMPK2 特 异 性siRNA 后,DF-1 细 胞 内CMPK2 基 因转录水平显著降低(P<0.05)(图8A)。同时,CMPK2 siRNA 可以干扰DF-1 细胞内CMPK2 蛋白的表达(图8C)。以MOI 0.1 的H9N2 AIV 感染siRNA 干扰后的细胞,分别于感染后12 h、24 h 收集细胞,检测细胞内H9N2 AIV NP 蛋白水平。结果显示,siRNA 干扰CMPK2 蛋白的实验组相比于转染NC siRNA 的对照组,H9N2 AIV NP 蛋白水平极显著上升(P<0.01)(图8B、8D)。进一步表明鸡CMPK2在抑制H9N2 AIV复制作用中发挥重要作用。

图8 siRNA干扰CMPK2蛋白表达后对H9N2 AIV复制影响的检测结果Fig.8 Detection results of the effect of siRNA interference on the replication of H9N2 AIV after down-regulating the expression of CMPK2 protein in DF-1 cells
3 讨 论
先天免疫反应是防御病毒感染的第一道防线,病原体侵入细胞后,首先被MDA5、LGP2 或Toll 样受体等模式识别受体(PRR)识别,PRR 募集下游信号分子,活化干扰素调节因子3(IRF-3)或干扰素调节因子7(IRF-7)的磷酸化。随后IRF3/7 或NF-κB 的二聚体入核,结合并激活特定的启动子,诱导IFN 的分泌表达[11]。IFN分泌到胞外后,激活自身或其他细胞JAK-STAT信号通路,诱导大量ISG的表达,抑制病毒的复制[1]。
相关研究表明,CMPK2 基因是一种ISG[4],在生物体免疫反应中发挥重要功能。在Ⅰ型干扰素IFNα2b 治疗感染HIV 患者的过程中,CMPK2 在接受治疗后的患者CD4+T 细胞中表达上调,且与血浆中HIV含量下降水平呈正相关。利用siRNA干扰CMPK2表达后,IFN 对HIV 的抑制作用显著降低[12]。在鱼类细胞中,SVCV 感染后CMPK2 显著上调,过表达和RNA干扰抑制试验证明,CMPK2 抑制了SVCV 的复制[3]。
本实验通过克隆鸡CMPK2 基因,构建p3xFLAGCMV-14-CMPK2 重组质粒后经瞬时表达CMPK2,确定该基因在鸡细胞中的表达。另外,通过构建pET-28a-CMPK2 原核表达质粒,经诱导表达了CMPK2 可溶性蛋白,免疫小鼠后得到多克隆抗体,该多抗可用于检测鸡CMPK2 蛋白。本研究利用H9N2 AIV 感染DF-1 细胞后检测CMPK2 mRNA 水平,结果显示其转录水平显著上调,在感染后6 h 最高,12 h 后有下降趋势,表明H9N2 AIV 能够显著诱导鸡CMPK2 的表达。但CMPK2 蛋白水平在感染病毒后6 h 显著降低,12 h 后显著上升,推测CMPK2 基因在病毒感染后从转录到蛋白表达有所延迟,具体机制仍有待深入研究。
前期研究表明,CMPK2 通过参与IFN 介导的抗病毒免疫反应抑制了SVCV 在细胞内的转录和翻译,发挥抗SVCV 感染的作用[3]。小鼠CMPK2 在多种肿瘤中也上调表达,可促进黑色素瘤中T 细胞、粒细胞和树突状细胞的浸润,对CMPK2 基因缺陷小鼠肿瘤模型的研究发现,对CMPK2 影响了巨噬细胞的极化和肿瘤浸润T 细胞中CD4/CD8 的比例,说明CMPK2在抗肿瘤免疫反应中也有重要功能[13]。为了研究鸡CMPK2 是否有相似的抗病毒功能,本研究通过在DF-1 细胞中瞬时过表达CMPK2 蛋白后感染H9N2 AIV,检测细胞内病毒NP 的mRNA 和蛋白水平变化,结果显示鸡CMPK2 过表达后能够影响H9N2 AIV在DF-1 细胞中的增殖,为后续鸡CMPK2 抗病毒相关机制研究奠定了基础。其中在12 h时H9N2 AIV NP 的转录和翻译被显著抑制,而相比于12 h 时,24 h 后对NP 的转录和翻译抑制效果有降低趋势。在前期鱼CMPK2的抗SVCV功能研究中,过表达鱼CMPK2 24 h后在细胞中表达量达到最高,SVCV 蛋白在感染后6 h、12 h 均被显著下调,然而在24 h 无显著影响[3]。因此,推测本研究中鸡CMPK2 对H9N2 AIV 在24 h时抗病毒效果减弱存在相同因素。同时,通过siRNA 干扰试验干扰鸡CMPK2 在DF-1 细胞中的表达,进一步验证其对H9N2 AIV 增殖的影响,结果显示CMPK2 表达降低后,H9N2 AIV 复制水平显著上升,进一步证明了鸡CMPK2 参与机体抵抗AIV 的天然免疫反应。
综上所述,本研究扩增鸡CMPK2 基因,遗传进化分析显示鸡CMPK2与爬行类动物遗传关系较近。通过过表达鸡CMPK2 显示,其对H9N2 AIV 复制具有抑制效果,干扰鸡CMPK2 后对H9N2 AIV 复制的抑制作用被抑制。本研究首次将CMPK2的抗病毒作用延伸到鸡CMPK2,然而仍需进一步探究鸡CMPK2 抗H9N2 AIV 复制的机制,拓宽CMPK2 的抗病毒机理。
——一道江苏高考题的奥秘解读和拓展

