NLRC4在具核梭杆菌诱导巨噬细胞焦亡中发挥调控作用
江伟艺,邓子龙,赵望泓
南方医科大学南方医院口腔科,广东 广州510515
具核梭杆菌是一种革兰氏阴性专性厌氧菌,广泛存在于感染根管、牙周病变及其它口腔炎性病灶中[1]。近年来,因发现具核梭杆菌在全身系统中异位定植,与炎症性肠病[2]、脑膜炎[3]、心内膜炎[4]、肝脓肿[5]、类风湿关节炎[6]等口腔外的感染性疾病关系密切,而引起高度关注和广泛研究。具核梭杆菌具有较强促炎能力,可引起黏膜屏障破坏、免疫细胞功能紊乱和机体免疫系统损伤,引发或加重感染[7,8]。
细胞焦亡是一种具有高度促炎特性的细胞死亡方式[9],细胞膜完整性丧失,释放胞内容物和促炎因子[10],放大炎症级联反应,因此焦亡启动的炎症信号和细菌引起的感染密切相关。炎症小体不仅是识别微生物和多种危险信号的感受器,而且发挥调控焦亡信号的作用[11]。因此研究炎症小体对阐明细菌感染的机制以及控制下游的炎症信号有重要意义。研究证实,NLRP3炎症小体可被具核梭杆菌激活[12,13],但NLRP1、NLRC4、AIM2等其他炎症小体在具核梭杆菌感染中的作用尚未见报道。
巨噬细胞是宿主抵抗细菌感染的第一道防线,也是具核梭杆菌感染组织中募集的主要免疫细胞[14,15],发挥着联系先天性免疫和适应性免疫的桥梁作用。既往研究表明,具核梭杆菌感染巨噬细胞导致IL-1β、TNF-α等多种细胞因子和ROS等炎症介质上调,与M1向极化有关[16],但具核梭杆菌诱导巨噬细胞焦亡和炎症的关系不明。因此,本研究目的是探究具核梭杆菌感染对巨噬细胞焦亡的作用,筛选可能参与调控巨噬细胞焦亡的关键分子,为具核梭杆菌感染的致病机制研究提供新思路。
1 材料和方法
1.1 材料
具核梭杆菌(ATCC 25586,广东省微生物研究所菌种保藏中心)。小鼠巨噬细胞RAW264.7(南方医科大学口腔医学院实验室提供)。乳酸脱氢酶(LDH)细胞毒性检测试剂盒(碧云天);RIPA 裂解液、QuickBlockTMWestern 封闭液(碧云天);BCA 蛋白浓度测定试剂盒(Thermo);化学发光液(弗 徳);一 抗:anti-caspase-1(Adipogen),anti-GSDMD(Abcam),anti-β-actin(Abcam);GreenTB®Premix Ex TaqTM、PrimeScriptTMRT Master Mix(TaKaRa);Lipofectamine 3000(Thermo);Hoechst 33342/PI 双染试剂盒(索莱宝);si-RNA(吉凯)。
1.2 方法
1.2.1 构建具核梭杆菌感染巨噬细胞RAW264.7模型对数生长期的具核梭杆菌菌液在4 ℃下4000 r/min离心15 min,PBS重悬、离心,洗涤2次,将沉淀用PBS重悬,分光光度计波长为600 nm吸光度调整至0.5,此时对应的细菌浓度约为2×108CFU/mL。设置未感染组为对照,细菌感染组以不同MOI和不同时间设置梯度,将RAW264.7细胞与具核梭杆菌于37 ℃、5%CO2恒温培养箱中共培养。
1.2.2 LDH 乳酸脱氢酶试剂盒测定细胞毒性RAW264.7细胞以5×104/孔接种于96孔板中,待细胞贴壁后,更换为含1%血清的低血清培养液,设置以下分组:未经感染的对照孔,最大酶活性对照孔,不同MOI的具核梭杆菌感染孔,以及无细胞但含有相应MOI的细菌培养液孔。预定检测时间点前1 h,在最大酶活性对照孔中加入10 μL LDH释放试剂。到达预定时间点后,分别取各孔的上清液60 μL 与30 μL 新鲜配制的LDH 检测工作液(10 μL 乳酸溶液+10 μL INT 溶液+10 μL酶溶液),混匀后室温避光孵育30 min,多功能酶标仪测定490 nm处的吸光度A490nm。
1.2.3 Hoechst 33342/PI 荧光双染 RAW264.7 细胞以2×105/孔的密度接种于24 孔板,具核梭杆菌分别以MOI=20、100感染细胞24 h,使用预冷的且含有1%双抗的PBS溶液漂洗细胞5 min,尽可能去除残留的细菌;每孔分别加入配制染色工作液(染色缓冲液:Hoechst 33342:PI=200∶1∶1)300 μL,4 ℃避光孵育30 min,荧光显微镜下观察细胞染色情况并拍照。
1.2.4 Western blot检测caspase-1、GSDMD等焦亡相关蛋白的表达 收集细胞,RIPA裂解,BCA法蛋白定量,SDS-PAGE电泳,转移至PVDF膜,快速封闭液室温封闭15 min,加入一抗、二抗孵育,漂洗后化学发光法显影,ImageJ软件分析条带灰度值,以β-actin为内参,计算目的蛋白的相对表达量。
1.2.5 qRT-PCR检测炎症小体的激活情况 TRIzol法提取细胞总RNA,将RNA逆转录为cDNA,构建反应体系,用罗氏480 对多种炎症小体(NLRP3、NLRC4、AIM2和NLRP1)进行荧光实时定量分析,以β-actin 为内参,2-ΔΔct法计算mRNA的相对浓度。
1.2.6 转染siRNA敲低巨噬细胞中NLRC4的表达 实验分为3组:空白组、阴性对照(si-NC)组和NLRC4敲低(si-NLRC4)组。配制转染液:溶液A(使用Opti-Medium稀释Lipo3000)、溶液B(使用Opti-Medium稀释siRNA,siRNA的工作浓度为100 nmol/L);混合A、B溶液,室温静置15 min后加入至细胞。转染48 h后更换新的完全培养基。检测NLRC4在mRNA和蛋白水平的抑制效率。
1.3 统计学分析
使用SPSS 20.0 软件进行数据分析,定量资料以均数±标准差表示,组间比较采用单因素方差分析;进行方差齐性检验,若方差齐,多重比较采用Bonferroni检验,若方差不齐,多重比较采用Dunnett's T3矫正检验,P<0.05为差异具有统计学意义。所有实验均独立重复3次。
2 结果
2.1 具核梭杆菌感染导致RAW264.7细胞死亡
倒置显微镜下观察巨噬细胞形态出现特征性改变:细胞由圆形变为梭形或多角形,细胞体积变大,细胞膜肿胀、胞内出现大量空泡,部分细胞破碎边界不清(图1A、B)。具核梭杆菌以20、50、100和200的MOI处理细胞24 h 后,LDH 释放量分别为4.0%、13.2%、15.1%、15.1%(P<0.05,图1C)。
未感染组中PI阳性细胞数极少,低MOI组中有少量PI阳性细胞,高MOI组PI阳性率升高(图1D)。具核梭杆菌感染导致RAW264.7细胞膜受损,发生溶解性坏死,细菌浓度越高,发生溶解的细胞越多。
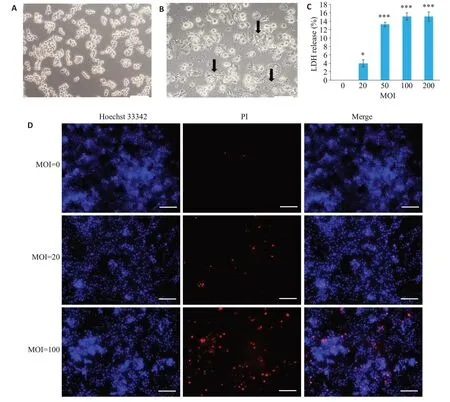
图1 具核梭杆菌感染对巨噬细胞RAW264.7细胞坏死的影响Fig.1 F.nucleatum infection induces necrosis of RAW264.7 cells.A,B:Morphological changes of the cells observed under inverted microscope.C: LDH release detected by LDH assay (*P<0.05,***P<0.001 vs uninfected group).D:Hoechst 33342/PI double staining for detecting cell necrosis(scale bar=100 μm).
2.2 具核梭杆菌诱导RAW264.7焦亡并释放炎症因子
具核梭杆菌感染不同时间后,感染组caspase-1 p20表达在6~24 h升高,GSDMD-NT表达在12~24 h升高,且均在24 h达到顶峰;同时IL-1β释放量在18~24 h明显增多(图2A)。qRT-PCR结果显示IL-1β在mRNA水平也呈时间依赖性升高(P<0.001,图2B)。
不同MOI 的具核梭杆菌感染24 h 显示,感染组GSDMD、caspase-1 表达上调;同时活化的caspase-1 p20、GSDMD-NT、IL-1β蛋白表达呈MOI依赖性升高(P<0.001),MOI=100与MOI=200组差异无统计学意义(图2C)。

图2 具核梭杆菌感染导致巨噬细胞RAW264.7焦亡Fig.2 F.nucleatum triggers pyroptosis in RAW264.7 macrophages.A,B: Western blotting for detecting pyroptosis-associated proteins and qRT-PCR for detecting IL-1β mRNA expression at different time points after infection;C,D: Western blotting for detecting pyroptosis-associated proteins and qRT-PCR for detecting IL-1β mRNA expression in the infected cells at different MOIs.***P<0.001 vs uninfected group.
2.3 不同炎症小体在具核梭杆菌感染时的激活情况
检测4 种最主要的炎症小体(NLRP3、NLRC4、NLRP1和AIM-2)的表达情况,筛选可能发挥关键调控作用的分子,结果显示:NLRC4在6 h、12 h与对照组差异无统计学意义(P>0.05),在24 h表达上调(P<0.001),且与具核梭杆菌所致的细胞焦亡出现的峰值的时间点相一致;NLRP3 在6 h 表达上调,随后立即下调(P<0.001);NLRP1在各个检测时间点的表达差异无统计学意义(P>0.05);AIM2在6 h表达无明显差异,随后出现下调(P<0.001,图3)。Western blot 进一步检测NLRC4和NLRP3蛋白表达情况,结果显示,在24 h的NLRC4较NLRP3上调更显著(图3 E)。
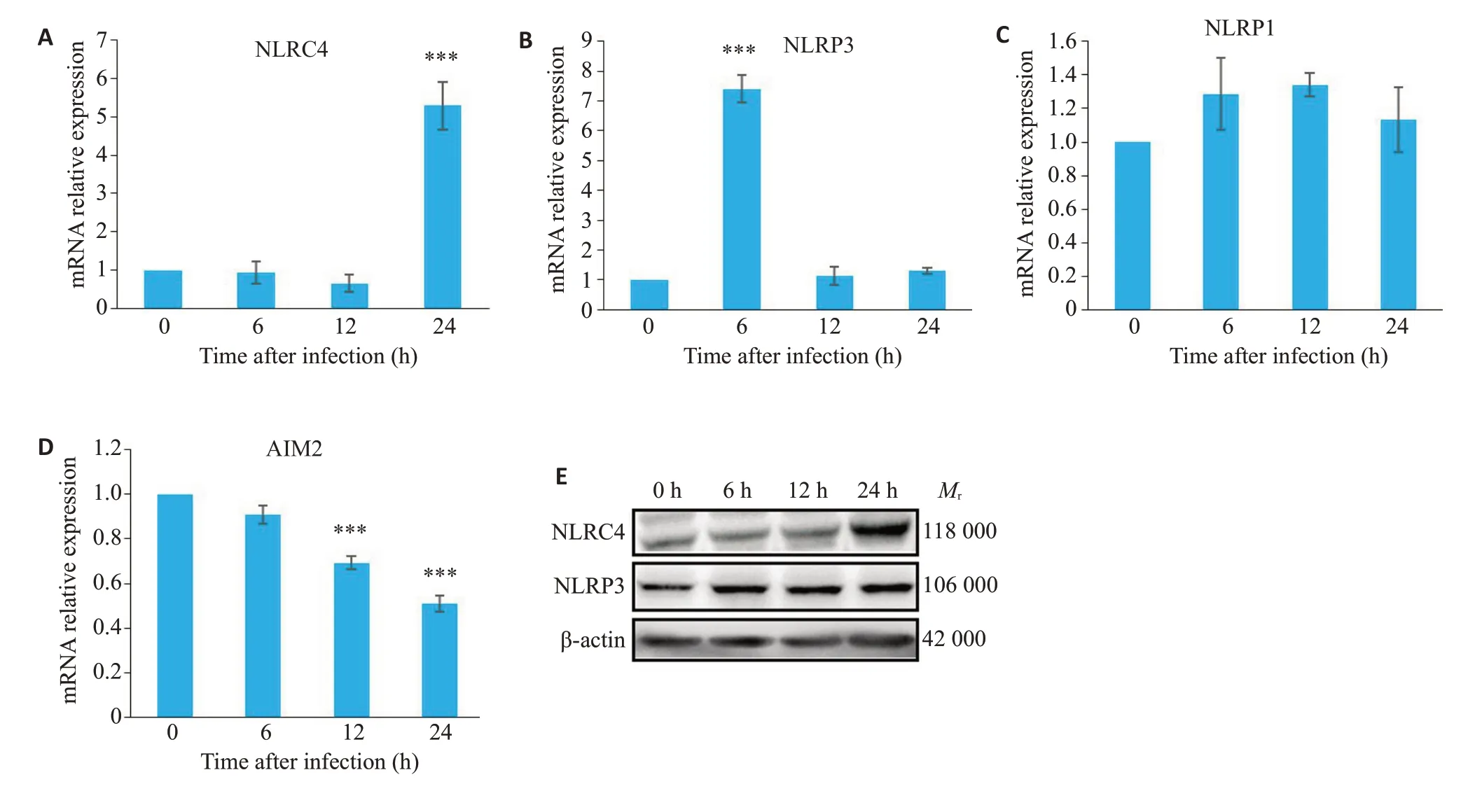
图3 不同炎症小体在具核梭杆菌感染时的激活情况Fig.3 Activation of NLRC4 (A),NLRP3 (B),NLRP1 (C) and AIM2 (D) inflammasomes in F.nucleatum-infected macrophages detected by qRT-PCR.***P<0.001 vs uninfected group;E: Expressions of NLRC4 and NLRP3 detected by Western blotting.
2.4 敲低NLRC4可抑制RAW264.7细胞焦亡
qRT-PCR验证3条siRNA的抑制效率,si-3抑制效率最高(P<0.001),用于后续实验,该siRNA在mRNA和蛋白水平均抑制RAW264.7细胞中NLRC4的表达,抑制率分别为80%和83%(图4A~D)。
敲低NLRC4 后,Western blot 检测下游信号分子caspase-1和焦亡的执行蛋白GSDMD的活化情况,结果显示(图4E),未感染组中caspase-1和GSDMD没有激活,表达量极低,在具核梭杆菌感染后,空白组和si-NC组中出现剪切体caspase-1 p20,同时伴随GSDMD-NT的升高;然而si-NLRC4 组caspase-1 p20 和GSDMDNT 的升高不明显。进一步通过LDH 实验探究敲低NLRC4对RAW264.7细胞坏死的影响,结果显示,敲低NLRC4后,具核梭杆菌感染引起细胞LDH的释放减少(图4F),细胞坏死情况得到一定程度的抑制。
通过检测敲低NLRC4对RAW264.7细胞炎症因子IL-1β的影响,结果显示未感染组IL-1β表达量低;具核梭杆菌感染后,空白组和si-NC组IL-1β升高,si-NLRC4组IL-1β的表达与未感染组比有轻微升高,但远低于空白组和si-NC组(图4E)。

图4 敲低NLRC4对RAW264.7细胞焦亡的影响Fig.4 Effect of NLRC4 knockdown on pyroptosis of F.nucleatum-infected RAW264.7 cells.A-C:Inhibition efficiency of NLRC4 at mRNA and protein levels.***P<0.001 vs si-NC,Ctrl.D: Expression of NLRC4 at 48 h after siRNA transfection and at 24 h in co-culture with F.nucleatum.E: Expressions of pyroptosis-related proteins detected by Western blotting.F: LDH release assay result.*P<0.05,**P<0.01,***P<0.001.
3 讨论
本研究通过构建具核梭杆菌感染巨噬细胞模型,证实具核梭杆菌激活NLRC4 炎症小体,活化下游caspase-1/GSDMD信号,导致巨噬细胞焦亡,伴随炎症因子IL-1β的表达与释放增加。同时,抑制巨噬细胞焦亡,可有效减少IL-1β的释放,说明具核梭杆菌诱导的巨噬细胞焦亡可能是细菌引起炎症反应的重要致病机制。细胞焦亡的发生依赖于炎症小体的激活,NLRC4炎症小体作为固有免疫的重要分子,能够识别沙门杆菌、弗氏志贺杆菌、绿脓杆菌等多种细菌[17,18],发挥免疫调控作用,但具核梭杆菌与NLRC4炎症小体的关系尚未见报道。本研究首次报道巨噬细胞中的NLRC4炎症小体能够识别具核梭杆菌感染,并进一步诱发细胞焦亡。既往研究认为NLRC4炎症小体的激动剂主要是细菌的鞭毛蛋白及T3SS蛋白(包括针状蛋白分子和杆状蛋白分子)[19,20],但具核梭杆菌感染时NLRC4的具体活化途径尚不明确,有待进一步研究。
NLRC4炎症小体在细菌感染过程中具有双重作用,一方面,取决于病原体的种类、数量,例如本研究采用的具核梭杆菌具有较强的促炎特性,在各种MOI感染下,均体现为显著的促炎作用;而沙门氏菌感染时,NLRC4在低剂量的感染中可以抑制细菌增殖,发挥抗感染作用,仅在高强度感染中导致细胞大量死亡,诱发强烈的炎症反应和损伤[21]。另一方面,取决于被感染的细胞类型。本研究中,NLRC4炎症小体促进巨噬细胞焦亡,导致细胞坏死率和IL-1β释放增加。其他学者针对多种免疫细胞研究,得到相似的结论,如绿脓杆菌[22]、金黄色葡萄球菌[23]以及细菌重组鞭毛蛋白可导致树突细胞、中性粒细胞[23]、巨噬细胞[24]中NLRC4炎症小体过度激活,加重全身炎症[25,26],这是由于免疫细胞焦亡,释放炎症介质,趋化更多的炎症细胞,造成组织的炎性损伤。然而,部分研究选取肠上皮细胞(组织)为研究对象,发现NLRC4在感染中发挥保护作用,上皮细胞具有自我更新的能力,在免疫防御中主要发挥物理屏障作用,或通过分泌的抗菌物质抑制细菌增殖,因此NLRC4炎症小体介导的上皮细胞焦亡,在不损害屏障完整性的情况下,清除受损的肠上皮细胞、实现黏膜上皮更替、维持微生物-宿主稳态[27,28]。在破骨细胞中,NLRC4敲除可能增加破骨细胞的活性,造成牙周炎小鼠的牙槽骨吸收更加显著[29]。NLRC4介导的细胞焦亡有多重作用,在具核梭杆菌感染相关疾病中的具体作用,仍需进行体内实验来证明。
综上所述,本实验通过研究具核梭杆菌感染引起巨噬细胞焦亡的作用及机制,明确了NLRC4炎症小体介导巨噬细胞焦亡在具核梭杆菌感染中发挥调节炎症因子的重要功能,为具核梭杆菌感染的致病机制研究提供新思路,NLRC4可能成为具核梭杆菌所致感染性疾病防治的潜在靶点。

