四神丸对溃疡性结肠炎大鼠IL-6/STAT3信号通路及Th1/Th2免疫轴平衡的影响
王盈蕴,王燕,朱向东,李洁,梁永林*
(1.甘肃中医药大学,甘肃兰州 730000;2.宁夏医科大学,宁夏银川 750004)
0 引言
溃疡性结肠炎(ulcerativecolitis,UC)是一种以结肠粘膜慢性特发性炎症为特征的炎症性肠病(inflammatoryboweldisease,IBD),病位起始端在直肠,并会延伸,末端可至结肠近端[1]。腹泻、腹痛、大便里急后重并出现黏液脓血便等是UC的典型表现[2]。现今,UC具体的发病机制尚不清楚,但已证实与免疫反应缺陷、肠道菌群改变、遗传易感性和环境因素等有关[3]。UC临床常用的治疗药物包括氨基水杨酸、硫唑嘌呤和皮质类固醇等[4,5],但这些药物往往会导致不同的副作用,如出现肾毒性,在长期治疗期间降低了患者的生活质量[6,7]。在此背景下,中医药在UC治疗中的作用受到广泛关注。四神丸最早记载于《陈氏小儿痘疹方论》中,由补骨脂、吴茱萸、肉豆蔻、五味子,加生姜、大枣组成[8]。越来越多的循证医学证据表明[9],四神丸治疗IBD疗效良好,204例IBD患者总有效率可达到75.98%。本实验旨在探讨在脾肾阳虚型UC大鼠模型中四神丸对白介素(IL)-6/信号传导与转录激活因子3(STAT3)信号通路及辅助性T细胞(Th)1/Th2免疫轴平衡的影响。
1 实验材料
1.1 动物
SPF级SD大鼠120只,雌雄各半,平均体质量(200±20)g,购自甘肃中医药大学科研实验动物中心,动物合格证号与许可证号分别为SCXK(甘)2020-0001、SYXK(甘)2020-0009。大鼠饲养于甘肃中医药大学动物实验中心的SPF级屏障实验室中,温度为(23±2)℃,相对湿度(55±5)%,噪声<50dB。
1.2 药品与试剂
四神丸饮片(补骨脂、吴茱萸、肉豆蔻、五味子、生姜、大枣生药量比例为4∶1∶2∶2∶2∶2)及番泻叶饮片均购自于兰州惠仁堂大药房,由甘肃中医药大学杨扶德教授鉴定为正品。美沙拉秦缓释颗粒(上海爱的发制药有限公司,规格0.5g/袋,批号200707,国药准字H20143164)。氢化可的松注射液(国药集团容生制药有限公司,规格2mL:10mg,批号2008202,国药准字H20023069);二硝基苯磺酸盐(DNBS)(德国Sigma公司,批号STBH1899);苏木素-伊红(HE)染色试剂盒(北京索莱宝科技有限公司,批号G1080);鼠IL-6 酶联免疫吸附(ELISA)试剂盒,鼠IL-10 ELISA试剂盒(江苏菲亚公司,批号分别为2105R81,2105R84);STAT3抗体,TGF-β抗体,PPARγ抗体(英国Abcam公司,批号分别为ab68153,ab215715,ab209350);p-STAT3抗体(美国CST公司,批号9145S);CD3抗体(武汉伊莱瑞特生物科技股份有限公司,批号E-ABF1228S);CD4抗体,IFN-γ抗体,IL-4抗体(美国Biolegend公司,批号分别为201505,507809,511905);反转录试剂盒,qPCR试剂盒(上海翊圣生物科技有限公司,批号分别为:H1125080,H4104620);兔SP试剂盒(中杉金桥公司,批号SP-9001)。
1.3 仪器
IX51型显微镜(日本Olympus公司);RM2245型切片机(德国LEICA公司);Arcadia H型包埋机(德国LEICA公司);C1000荧光定量PCR仪(美国Bio-Rad公司);IMARKMini Protean酶标仪(美国Bio-Rad公司)。
2 实验方法
2.1 造模与给药
将所有大鼠随机分为空白组,模型组,四神丸低、中、高剂量组及美沙拉秦组,每组10只。采用病证结合法[10],将大鼠进行番泻叶灌胃(10mL/kg),配合氢化可的松皮下注射(15mg/kg),1次/d,连续21d。21天后,禁食不禁水24小时,腹腔注射2%戊巴比妥钠(0.2 mL/100g)进行麻醉。将DNBS/乙醇溶液(100 mg/kgDNBS+1mL/kg50%乙醇)快速注入至肛门内8cm的深度,再注入约0.4mL的空气,捏紧肛门,将大鼠倒立1min,防止药液流出。造模成功后,根据人和大鼠的体表面积换算给药剂量,四神丸低、中、高剂量组灌胃量分别为含生药量6、12、24 g/kg,美沙拉秦组为0.36g/kg,灌胃体积为1mL/100g[11]。空白组和模型组灌服等体积蒸馏水。各组灌胃1次/d,连续21d。
2.2 标本采集
末次给药后,用2%戊巴比妥钠进行腹腔注射麻醉,取血后颈椎脱臼法处死大鼠。留取结肠组织,一部分结肠固定在4%的多聚甲醛中,用于HE染色和免疫组化检测;一部分结肠组织用生理盐水浸泡并立即用于流式细胞术检测;一部分组织置于冻存管中在-80℃冰箱放置,用于RT-PCR检测。
2.3 HE染色观察结肠组织病理学变化
将固定在4%多聚甲醛中的结肠组织取出,进行冲洗,乙醇脱水,二甲苯透明,石蜡包埋,切片,染色,显微镜下拍照观察结肠组织变化。
2.4 流式细胞术检测大鼠结肠组织中Th1细胞及Th2细胞比例
将结肠组织磨碎,制备单细胞悬液,放入离心机中离心,加入PBS液重悬。选择适量CD3抗体和IFN-γ抗体(Th1细胞)及适量CD4和IL-4抗体(Th2细胞),加入免疫细胞活化试剂刺激细胞,加入细胞固定破膜液,染色,设置同型对照实验,新鲜标本尽快用流式细胞仪上机检测。
2.5 ELISA检测大鼠血清中IL-6、IL-10因子的含量
使用ELISA检测血清IL-6、IL-10水平,全部操作按照试剂盒说明完成。
2.6 免疫组化法检测STAT3、p-STAT3、TGF-β1、PPARγ蛋白表达
取结肠组织切片,常规脱蜡及水化后,PBS清洗,用柠檬酸钠热修复两次,加入3%的过氧化氢孵育,滴加第一抗体(1∶200),湿盒4℃冰箱过夜后,加入相应二抗,室温孵育,DAB显色,苏木素复染,返蓝,中性树脂封片。运用使用Pannoramicviewer及Quant center软件进行观察及分析。
2.7 RT-PCR法检测STAT3、TGF-β1、PPARγmRNA基因表达
取结肠组织匀浆后提取总RNA,并按照反转录试剂盒说明书进行后续操作,运用RTPCR仪进行检测,使用2-ΔΔCT方法计算RNA相对表达量。引物序列见表1。
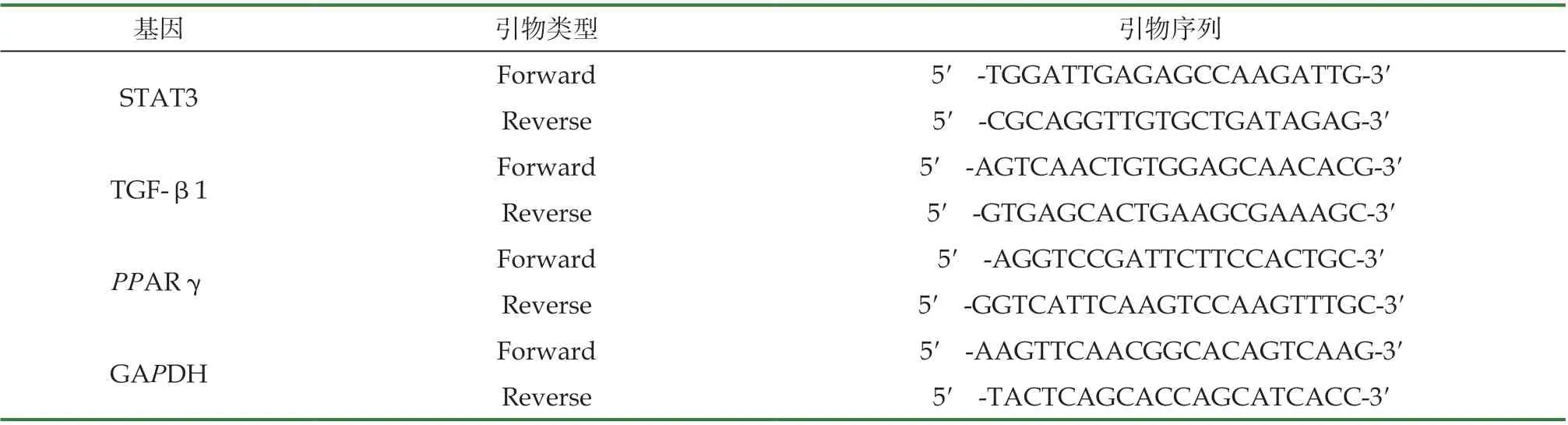
表1 引物名称及序列表
2.8 统计学方法
全部资料用SPSS23.0统计软件进行分析,计量资料以(±s)表示,若数据符合正态性和方差齐性,组间比较用单因素方差分析。方差齐时组间比较采用LSD检验方法,方差不齐时选用Tamhane'sT2检验方法。
3 结果
3.1 结肠组织病理学改变
空白组中结肠组织染色均匀,结构清晰可见,肠粘膜排列整齐,腺体分布均匀。与空白组比较,模型组结肠损伤严重,肠粘膜消失,腺体结构破坏,可见大量的炎性细胞。与模型组比较,四神丸组及美沙拉秦组结肠损伤程度、肠粘膜及腺体结构破坏程度呈剂量依赖性减轻,炎性细胞呈剂量依赖性减少,其中高剂量组和美沙拉秦组效果最好。见图1。
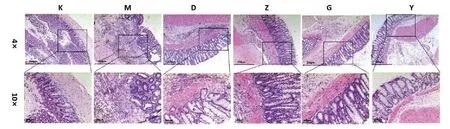
图1 各组大鼠结肠组织病理形态(×40,×100)
3.2 大鼠结肠组织中Th1细胞及Th2细胞的比例
流式细胞术检测结果显示:与空白组比较,模型组大鼠结肠组织中Th1细胞比例显著升高(P <0.01);Th2细胞比例显著降低(P <0.01)。与模型组比较,各治疗组大鼠结肠组织中Th1细胞比例显著降低(P <0.05,P <0.0 1);四神丸中、高剂量组及美沙拉秦组大鼠结肠组织中Th2细胞比例显著升高(P <0.01)。四神丸高剂量组与美沙拉秦组比较差异无统计学意义。见图2-1,2-2,表2。
表2 信息文四摘神丸对UC 大鼠结肠组织中Th1和Th2细胞比例变化的影响( ±s,n=6)
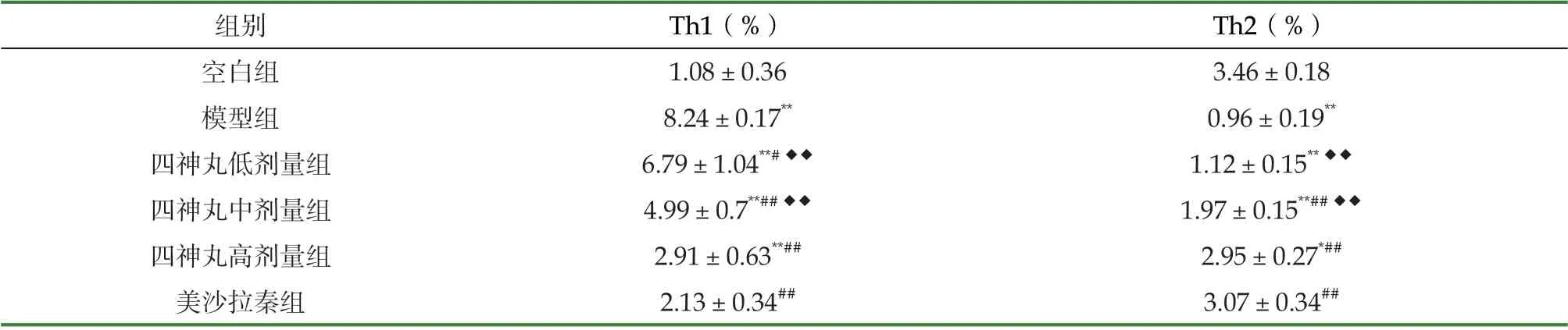
表2 信息文四摘神丸对UC 大鼠结肠组织中Th1和Th2细胞比例变化的影响( ±s,n=6)
注:与空白组比较:★P<0.05,★★P<0.01;与模型组比较:#P<0.05,##P<0.01;与美沙拉秦组比较:◆◆P<0.01,K.空白组 M.模型组 D.四神丸低剂量组 Z.四神丸中剂量组 G.四神丸高剂量组 Y.美沙拉秦组
续型电子期刊期刊之一组别Th1(%)Th2(%)空白组1.08±0.363.46±0.18模型组8.24±0.17**0.96±0.19**四神丸低剂量组6.79±1.04**#◆◆1.12±0.15**◆◆四神丸中剂量组4.99±0.7**##◆◆1.97±0.15**##◆◆四神丸高剂量组2.91±0.63**##2.95±0.27*##美沙拉秦组2.13±0.34##3.07±0.34##· 中国学术期刊综合评价数据库统计源期刊据库收录期刊情况
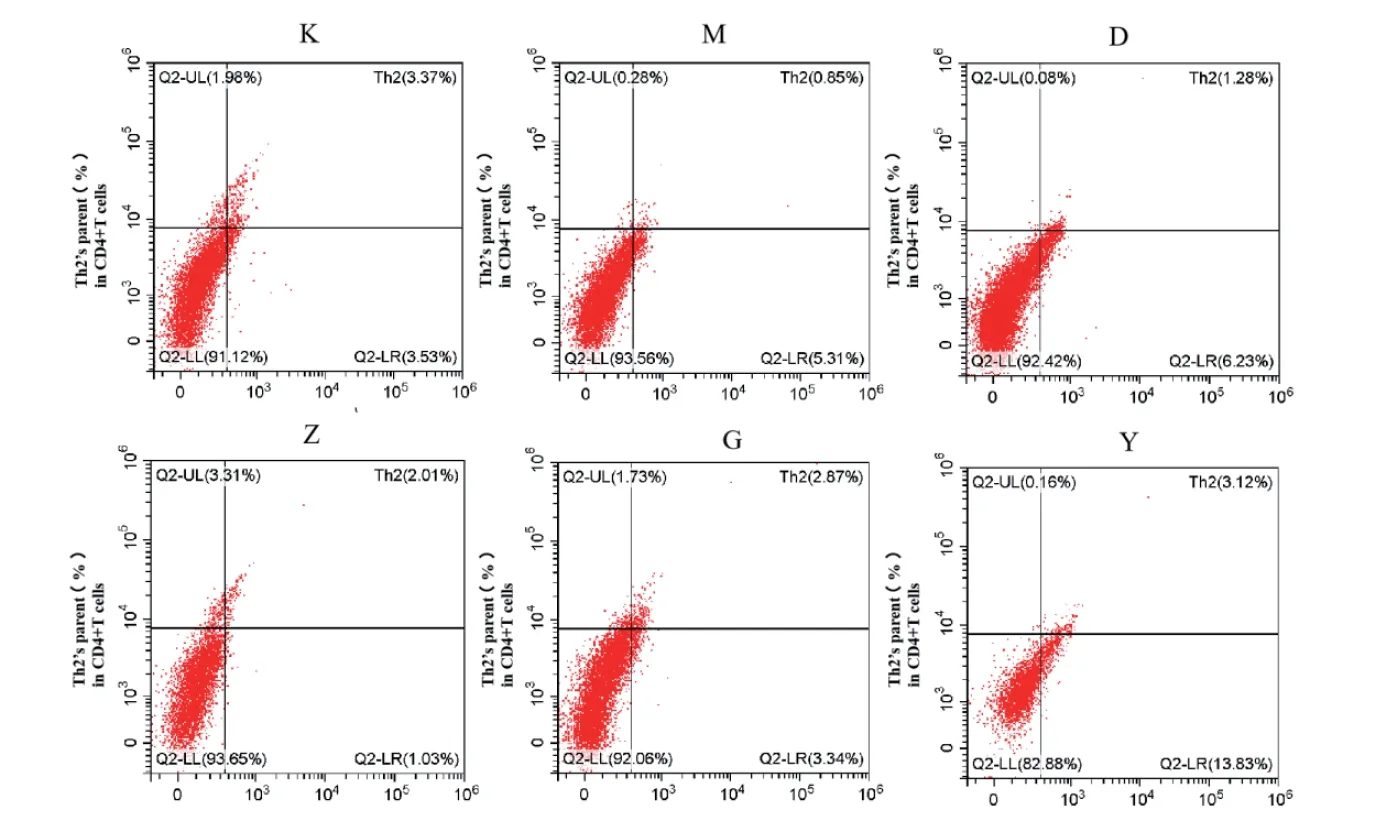
图2 -2四神丸对UC大鼠结肠组织中Th2细胞的比例的影响
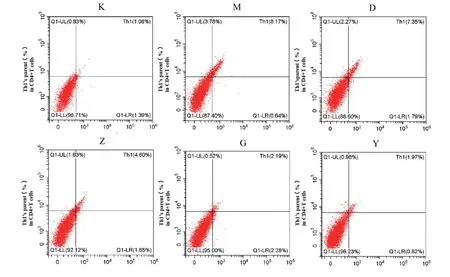
图2 -1四神丸对UC大鼠结肠组织中Th1细胞的比例的影响
3.3 大鼠血清中IL-6、IL-10含量的比较
与空白组比较,模型组大鼠血清中IL-6含量显著升高(P <0.01);IL-10含量显著降低(P <0.01)。与模型组比较,各治疗组大鼠血清中IL-6含量显著降低(P <0.01),四神丸高剂量组及美沙拉秦组血清中IL-10含量显著增加(P <0.01),且呈剂量依赖性改变,其中以四神丸高剂量组及美沙拉秦组最为显著,两组比较差异无统计学意义。见表3。
表3 四神丸对UC 大鼠血清中IL-6、IL-10因子水平的影响( ±s,n=6)
注:与空白组比较:★P<0.05,★★P<0.01;与模型组比较:#P<0.05,##P<0.01;与美沙拉秦组比较:◆◆P<0.01
组别IL-6ng/LIL-10 ng/L空白组55.62±9.302233.01±40.71模型组219.12±13.85**24.81±13.9**四神丸低剂量组181.3±11.12**##◆◆30.87±45.04**◆◆四神丸中剂量组147.11±8.11**##◆◆46.93±75.51**◆◆四神丸高剂量组101.68±13.87**##121..95±28.89**##美沙拉秦组88.86±19.32**##134.67±43.25**##
3.4 结肠组织中STAT3、p-STAT3、TGF-β1、PPARγ蛋白表达的变化
与空白组比较,模型组大鼠结肠组织中S T A T 3、p-S T A T 3 蛋白表达显著升高(P <0.01);TGF-β1、PPARγ蛋白表达显著降低(P <0.0 1)。与模型组比较,各治疗组STAT3、p-STAT3蛋白表达显著降低(P <0.0 1),四神丸组呈剂量依赖性降低;TGF-β1、PPARγ蛋白表达显著升高(P <0.05,P <0.01),四神丸组呈剂量依赖性升高。其中,以四神丸高剂量组与美沙拉秦组最为显著,两组中STAT3、TGF-β1、PPARγ蛋白表达无统计学意义。见图3,表4。
表4 各组大鼠结肠组织STAT3、p-STAT3、TGF-β1、PPARγ蛋白表达的影响(±s)

表4 各组大鼠结肠组织STAT3、p-STAT3、TGF-β1、PPARγ蛋白表达的影响(±s)
注:与空白组比较:★P<0.05,★★P<0.01;与模型组比较:#P<0.05,##P<0.01;与美沙拉秦组比较:◆◆P<0.01
STAT3p-STAT3TGF-β1PPARγ空白组1.00±0.151.00±0.161.00±0.091.00±0.08模型组 5.87±0.48**10.95±0.90**0.17±0.02**0.13±0.02**四神丸低剂量组 4.69±0.03**##◆◆8.53±0.92**##◆◆0.28±0.02**#◆◆0.29±0.05**#◆◆四神丸中剂量组 3.40±0.42**##◆◆6.75±0.70**##◆◆0.36±0.02**##◆◆0.43±0.07**##◆◆四神丸高剂量组2.03±0.27**##4.62±0.57**##◆◆0.75±0.09**##0.64±0.07**##美沙拉秦组2.03±0.18**##2.70±0.48**##0.77±0.07**##0.69±0.06**##
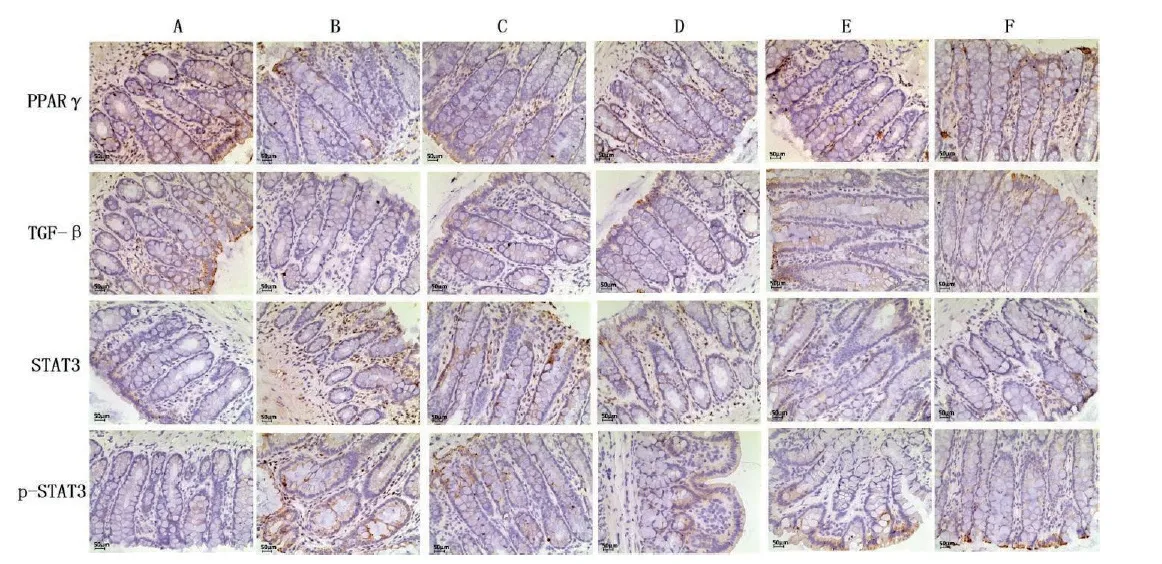
图3 各组大鼠结肠组织中相关蛋白的表达情况(×200)
3.5 结肠组织中STAT3、TGF-β、PPARγ mRNA相对表达量的变化
与空白组比较,模型组大鼠结肠组织中S T A T 3m R N A 的表达量显著升高(P <0.01),TGF-β1、PPARγmRNA的表达量显著降低(P <0.0 1)。与模型组比较,各治疗组大鼠结肠组织中STAT3mRNA的表达量显著降低(P <0.05,P <0.01);四神丸中、高剂量组和美沙拉秦组大鼠结肠组织中TGF-β1mRNA的表达量显著降低(P <0.05,P <0.01);四神丸高剂量组和美沙拉秦组中PPARγmRNA的表达量显著升高(P <0.01)。四神丸高剂量组与美沙拉秦组之间的基因表达差异无统计学意义。见表5。
表5 四神丸对UC大鼠结肠组织中STAT3、TGF-β1、PPARγ基因表达的影响(±s,n=6)

表5 四神丸对UC大鼠结肠组织中STAT3、TGF-β1、PPARγ基因表达的影响(±s,n=6)
注:与空白组比较:★P<0.05,★★P<0.01;与模型组比较:#P<0.05,##P<0.01;与美沙拉秦组比较:◆P<0.05,◆◆P<0.01
组别STAT3TGF-β1PPARγ空白组1.00±0.001.00±0.001.00±0.00模型组1.99±0.07** 0.35±0.04**0.48±0.07**四神丸低剂量组1.83±0.11**#◆◆0.47±0.07**◆0.51±0.09**◆◆四神丸中剂量组1.59±0.08**##◆0.59±0.20*#◆0.57±0.03**◆四神丸高剂量组1.41±0.05**##0.76±0.14*#0.73±0.07**##美沙拉秦组1.37±0.03**##0.79±0.07*##0.76±0.02**##
4 讨论
CD4+T细胞作为免疫系统的关键组成部分,包括调节性T细胞(Treg)和辅助性T细胞(Th)亚群[12]。Th1/Th2免疫轴控制着炎症和免疫耐受之间的微妙平衡,是维持肠道免疫稳态的关键因素,在病理状态下,Th1/Th2免疫轴会向Th1方向倾斜从而导致炎症的发生,这与UC的发生发展息息相关[13,14]。Th1主要分泌干扰素γ(IFN-γ)等,促进细胞毒性T淋巴细胞的活化以及和局部炎症有关的细胞免疫[15]。而Th2主要分泌IL-4、IL-10和IL-13等,刺激B细胞增殖并产生免疫球蛋白,与体液免疫有关[16]。结合病理切片、流式细胞术及ELISA结果发现四神丸可以减轻结肠组织炎性细胞的浸润程度,对结肠黏膜组织有一定的修复作用,还可增加Th2细胞在CD4+T细胞中的比例,同时降低Th1细胞比例,纠正Th1/Th2免疫轴失衡。
UC发生发展的潜在病理机制为信号传导与转录激活因子3(STAT3)介导的免疫功能下降和炎症浸润,STAT3激活导致促炎细胞因子和抗炎细胞因子分泌失衡,进一步加速炎症的发展[17]。STAT3在维持肠粘膜屏障中起关键作用,是结肠炎发病机制的重要转录因子,IL-6可激活STAT3使其磷酸化从而参与到炎症反应中[18-19]。转化生长因子-β(TGF-β)是重要的抗炎细胞因子,影响肠上皮细胞的稳态,主要通过下调免疫反应来抑制炎症的发生[20]。TGF-β在UC患者中代偿性上调,发挥炎症抑制的作用,并有助于诱导免疫耐受[21]。过氧化物酶体增殖物激活受体γ(PPARγ)是一种核受体,在维持肠道免疫平衡、抗炎等方面发挥重要作用,UC患者存在不同程度的PPARγ表达障碍[22]。有研究发现[23],IL-6促进STAT-3活化,而STAT-3下游分子miR-155靶向作用的PPARγ表达降低。PPARγ在结肠中的表达仅次于在脂肪组织中表达,其作为一种重要的抗炎介质,激活后可以保护小鼠免于DSS诱导的结肠炎,相反PPARγ的表达被抑制会增加结肠炎的易感性[22,24]。研究发现[25,26],PPARγ的激活可以改善炎症状态下受损的肠道屏障功能,有效促进肠道受损的组织修复。
本实验研究结果显示,经四神丸干预后,STAT3蛋白及mRNA相对表达量逐渐下降,p-STAT3蛋白表达量逐渐下降,TGF-β1和PPARγ蛋白及mRNA相对表达量逐渐增加,同时IL-6水平降低,STAT3蛋白可能通过IL-6/STAT3途径参与UC的发病。四神丸对治疗UC大鼠具有积极的作用,其上调了大鼠血清中炎性抑制因子IL-10水平及结肠组织TGF-β1、PPARγ的表达;下调了大鼠血清中炎症因子IL-6水平及结肠组织STAT3的表达;同时下调了Th1细胞占比,上调了Th2细胞占比。综上所述,四神丸对改善脾肾阳虚型UC大鼠模型结肠炎症程度有积极作用,其机制可能是通过抑制IL-6/STAT3信号通路及纠正Th1/Th2免疫轴失衡,进而降低肠道感染及炎症。

