NiTiO3 掺杂LiAl H 4 放氢性能研究
岑文龙, 魏 胜, 程日光, 徐 芬, 孙立贤
(桂林电子科技大学 材料科学与工程学院,广西 桂林 541004)
氢能具有原料来源丰富、能量密度高、燃烧产物环境友好、可再生等优点,被认为是未来替代传统化石能源的最佳选择之一[1-2]。目前氢能的储运环节是制约氢能大规模应用的关键环节之一,其中,如何将氢能安全高效作为车载能量存储载体是目前最具挑战性和商业价值的研究课题。传统的高压液态和气态储氢效率低、生产耗能高、使用安全性低,制约着车载储氢商业化使用。
固态储氢技术作为一种安全、高效的储氢方式,被认为是未来最有可能被大规模使用的一种储氢方式[3]。氢化铝锂(化学式为LiAl H4)具有w(Li-Al H4)=10.6%的理论储氢容量,被认为是最具潜力的固态储氢材料之一[4]。但放氢温度过高、放氢动力学缓慢、可逆性差等特点制约着它的使用,特别是作为车载能量存储载体的使用。研究人员通过纳米化[5-6]、多相复合[7-8]、限域[9-10]和催化掺杂[11-15]等方式改善LiAl H4的储氢性能。近年来,双金属盐被发现可以有效改善LiAl H4的储氢性能。Sulaiman等[16]将SrFe12O19掺杂到LiAl H4中发现体系的起始放氢温度降至80℃,比纯LiAl H4的降低了60℃,放氢速率也得到提升。随后Sazelee等[17-18]还发现LaFeO3、Sr TiO3也可以改善LiAl H4的放氢性能,其中Sr TiO3掺杂LiAlH4后体系起始放氢温度降至80℃,在90℃下20 min可放出w(H2)=3.0%。
基于上述报道中双金属盐可以有效改善LiAl H4的放氢性能,提出将双金属盐NiTiO3用于掺杂改善LiAl H4放氢性能的研究。
1 实验过程
1.1 NiTiO3 的制备
将钛酸丁酯和硝酸镍按摩尔比1∶1加入适量乙二醇中,对所得溶液进行磁力搅拌,溶液出现浅蓝色沉淀后继续搅拌1 h,确保反应完全;用乙醇清洗、过滤,得到沉淀;将所得沉淀在60℃真空下干燥后,在600℃煅烧1 h,得到NiTiO3。
1.2 w(NiTiO3)=x%LiAl H4 的制备
在手套箱中,用电子天平分别称取球磨样品质量分数分别为0、2%、4%、6%、8%的NiTiO3,随后和LiAl H4进行球磨,球磨转速为450 r/min,每球磨10 min后停机5 min,球磨3次,得到w(NiTiO3)=x%的LiAl H4复合材料。
1.3 放氢性能、活化能测试
在手套箱中,将适量球磨好的复合材料装进PCT样品管,取出后装到PCT 仪器中,然后试样抽真空,以2℃/min的升温速率升到300℃;等温放氢实验则用仪器内部加热装置迅速升到指定温度进行保温;活化能测试则先在手套箱中在铝坩埚装入3~5 mg样品,从手套箱取出后装入DSC仪器,分别按9、12、15、20℃/min的升温速率升到400℃。
2 实验结果与分析
将制备得到的NiTiO3进行XRD 分析,结果如图1 所示。所制备材料在24.13°、33.09°、35.66°、40.85°、49.45°、54.02°、57.46°、62.45°、64.07°、71.74°、75.15°、84.97°、88.57°出现了衍射峰,分别与NiTiO3的标准卡片33-0960中(0 1 2)、(1 0 4)、(1 1 0)、(1 1 3)、(0 2 4)、(1 1 6)、(0 1 8)、(2 1 4)、(3 0 0)、(1 0 10)、(2 1 7)、(1 3 4)、(2 2 6)晶面的衍射峰相符,表明成功制备了NiTiO3。

图1 NiTiO3 XRD结果
图2(a)为LiAl H4及不同含量NiTiO3掺杂Li-Al H4的程序升温脱氢结果。纯LiAl H4在升温到193℃开始放氢,升温到300℃能放出w(H2)=7.19%,而纯LiAl H4经球磨后起始放氢温度降至153℃,表明球磨过程有助于降低LiAl H4的放氢温度。当质量分数分别为2%、4%、6%、8%的NiTiO3掺杂LiAl H4后,起始放氢温度分别降至102、80、73、98℃,升温到300℃都放出接近w(H2)=7.0%,说明NiTiO3能有效改善LiAl H4的放氢性能,且改善效果随掺杂量的增加先增后减。可能的原因是Ni-TiO3掺杂量到一定程度后在球磨过程过于活泼,导致局部的LiAl H4反应放出热量,使LiAl H4出现团聚、长大,以至于在随后的程序升温放氢性能下降。从图2(b)所示的等温放氢结果可发现,纯LiAl H4在180℃、60 min仅放出w(H2)=0.43%,而掺杂w(NiTiO3)=6%的LiAl H4,同温度下30 min可以放出w(H2)=4.50%,60 min放出w(H2)=4.70%,甚至在90℃、60 min能够放出w(H2)=1.37%,表明NiTiO3掺杂后有效提高了LiAl H4的放氢速度。表1为近年来双金属盐掺杂LiAl H4放氢性能的研究结果。

表1 近年双金属盐掺杂LiAl H4 放氢研究

图2 w(NiTiO3)=x%LiAl H4 程序升温放氢曲线和等温放氢曲线
为进一步分析NiTiO3对LiAl H4放氢性能影响,对w(NiTiO3)=6%的LiAl H4体系进行了DSC测试。如图3(a)所示,w(NiTiO3)=6%的LiAl H4的DSC出现了3个放/吸热峰,第一个放热峰为Li-Al H4的第一步放氢反应放热的结果,第一个吸热峰为LiAl H4熔化过程吸热的结果,第二个吸热峰为Li3Al H6分解反应吸热的结果。与文献[14]的纯Li-Al H4的DSC曲线4个放/吸热峰相比,掺杂NiTiO3后LiAl H4与表面羟基相互作用的放热峰消失了,可能的原因是NiTiO3与LiAl H4在球磨过程消耗了LiAl H4表面的羟基。图3(b)是基于Kissinger方程算出的活化能,可以看到w(NiTiO3)=6%的Li-Al H4体系的前两步放氢活化能分别为71.56、122.49 kJ/mol,比文献[14]分别降低了49.59、39.51 kJ/mol,放氢活化能的下降说明NiTiO3确实促进了LiAl H4放氢速率的提升。
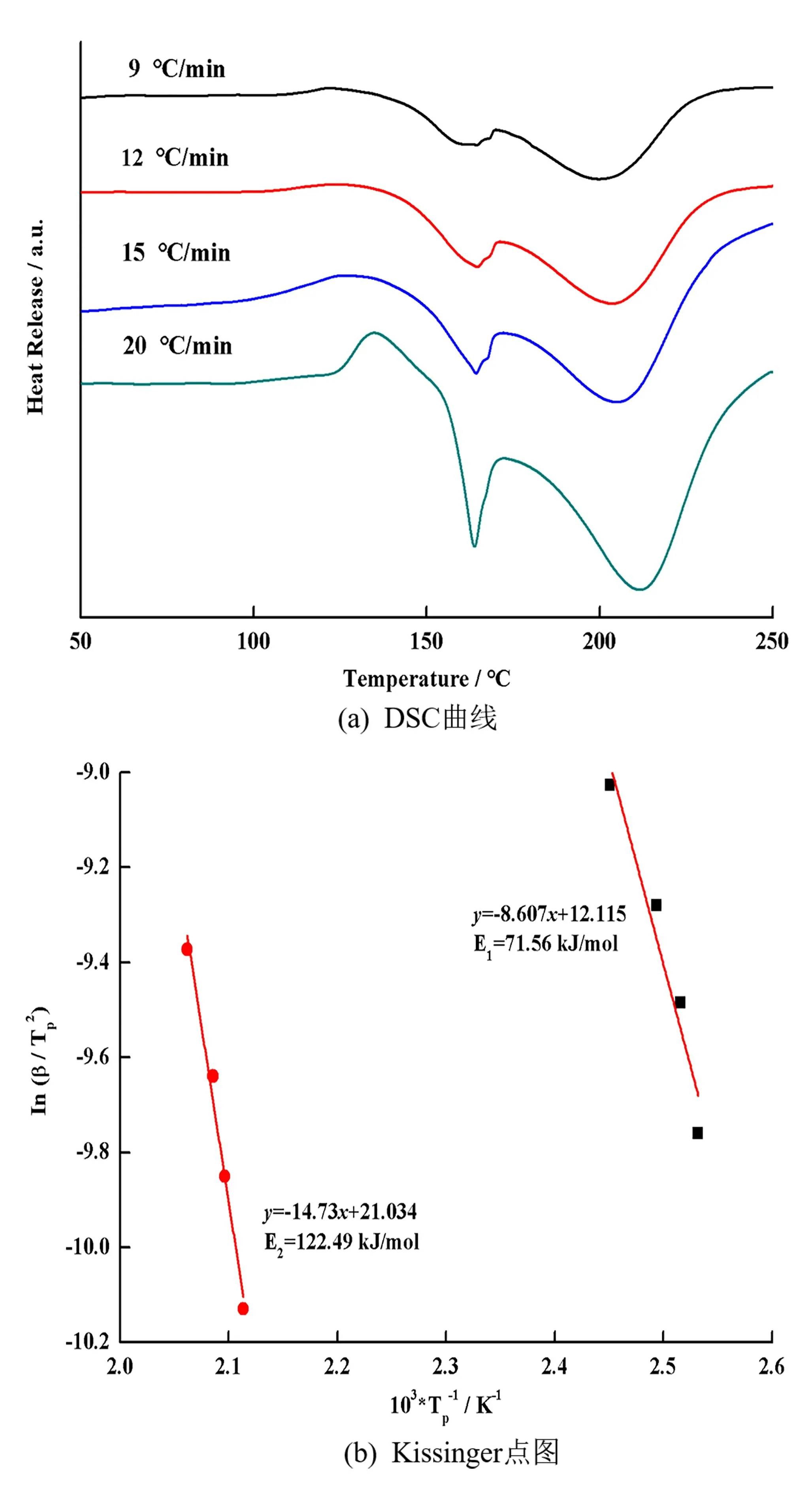
图3 w(NiTiO3)=6%LiAl H4 不同升温速率DSC曲线和Kissinger点
通过对放氢前后进行XRD 测试进一步分析了NiTiO3对LiAl H4的影响,如图4(a)所示。纯Li-Al H4的XRD 衍射峰较强,但经球磨处理后的衍射峰强度明显减弱,可能的原因是球磨过程在一定程度上破坏了LiAl H4的晶体结构,造成了一定的缺陷,这也解释了LiAl H4在球磨后放氢性能得到提升的现象。而随着NiTiO3加入LiAl H4一起球磨,Li-Al H4的XRD 衍射峰强度进一步减弱,但并未出现新的衍射峰,说明NiTiO3的加入在球磨过程中对LiAl H4的晶体结构影响不大,LiAl H4能保持其原有结构,而图中并未检测到NiTiO3的衍射特征峰,可能是球磨过程破坏了NiTiO3的稳定性,使其发生了非晶化转变。图4(b)为w(NiTiO3)=6%LiAl H4体系在程序升温到不同温度放氢后的XRD 测试结果。在90℃放氢后,LiAl H4的衍射特征峰强度有所减弱,但并未出现Li3Al H6等放氢产物的特征峰,可能的原因是放氢刚开始不久,放氢产物较少,达不到XRD仪器的检测限;在150℃放氢后,LiAl H4的衍射特征峰强度近一步减弱,并出现了Li3Al H6和Al的特征峰,说明LiAl H4发生了第一步放氢反应,生成了Li3Al H6、Al和H2;而在200℃放氢后,LiAl H4的衍射特征峰消失,Al的特征峰增强,说明LiAl H4第一步放氢反应结束,与图2(a)中w(NiTiO3)=6%LiAl H4程序升温放氢曲线相符;在250℃放氢后,Li3Al H6的衍射特征峰基本消失,说明Li3Al H6放氢也快结束,但图中未出现Li3Al H6放氢产物LiH的特征峰,可能的原因是LiH 的特征峰位置与Al的一样,二者的特征峰重合了。此外,整个过程并未检测到NiTiO3或其它物相的特征峰,因此认为Ni-TiO3在放氢过程中以非晶态存在,非晶态的NiTiO3可以为LiAl H4放氢反应提供活性位点和增加H 的扩散通道,从而改善LiAl H4的放氢性能[14]。

图4 w(NiTiO3)=x%LiAl H4 球磨后XRD及w(NiTiO3)=6%LiAl H4 不同温度放氢后XRD
3 结束语
双金属盐NiTiO3有效改善了LiAl H4的放氢性能,结果如下:
1)添加质量分数分别为2%、4%、6%、8%的Ni-TiO3都可以改善LiAl H4的放氢性能,特别是大大降低了LiAl H4的起始放氢温度,其中,掺杂的w(NiTiO3)=6%后LiAl H4的起始放氢温度降至73℃,比纯LiAl H4的降低了120℃;
2)NiTiO3的加入加快了LiAl H4的放氢速度,w(NiTiO3)=6%LiAl H4体系在180℃下60 min就能放出w(H2)=4.70%,而纯LiAl H4在180℃下60 min才放出w(H2)=0.43%,NiTiO3有效改善了LiAl H4的放氢动力学性能;
3)w(NiTiO3)=6%LiAl H4体系的前两步放氢活化能分别为为71.56、122.49 kJ/mol,比文献报道的纯LiAl H4的降低了49.59、39.51 kJ/mol,放氢活化能的降低也说明NiTiO3加速了LiAl H4的放氢。
本工作为双金属盐NiTiO3掺杂改善其它配位氢化物的研究提供借鉴,对氢能产业化具有重要意义。

