内镜下息肉勒除器冷切除术治疗大肠小息肉的效果分析*
陈斌 杨成 郭勇杭 曾威龙 袁思婵 李炳英
大肠息肉是临床常见疾病之一,目前临床上主要采用手术方式进行治疗,包括活检钳切除[1]、息肉勒除器冷圈切除[2]和电切除[3]三种手术方式。根据息肉的大小和分型,选择的手术方式也不同,包括冷/热活检钳钳除(直径≤5 mm)和圈套器电凝切除(直径≥10 mm),以及内镜下黏膜切除术(EMR)或内镜下黏膜剥离术(ESD)等技术[4],治疗方案已较为成熟。但是对于大肠小息肉(即直径6~9 mm 息肉),临床上选取何种手术尚没有定论。本研究选取150 例大肠小息肉患者,比较息肉勒除器冷切除术、活检钳术及高频电凝电切术三种手术方式在大肠小息肉(6~9 mm)中的临床效果及优缺点,为临床医师治疗该类息肉提供参考。
1 资料与方法
1.1 一般资料 选取2020 年1 月-2021 年6 月粤北人民医院消化内科收治的大肠小息肉150 例作为研究对象。纳入标准:(1)符合肠镜检查及息肉切除适应证且肠道准备合格;(2)镜检发现大肠小息肉,镜下目测直径在6~9 mm;(3)年龄20~70 岁;(4)术后病理检查提示息肉类型为隆起型息肉(即Ⅰ型肠息肉),包括3 个亚型:ⅠP 即有蒂型,ⅠSP即亚蒂型,ⅠS 即无蒂型。排除标准:肠道准备及治疗禁忌证、孕妇、有结肠癌手术史、有精神疾患史。采用随机数字表法将150 例患者分为冷圈套组、活检钳除组及电切组,每组50 例。所有患者在手术前均被告知手术的详细情况并签署知情同意书,本研究经医院伦理委员会验证通过。
1.2 方法 患者术前常规肠道准备,术前1 d 流质饮食,晚餐后禁食,术前8 h 口服聚乙二醇电解质散,可适当追加口服剂量或采取低压清洁灌肠,确保患者在手术实施前排出清水样便。(1)冷圈套组:首先调整肠镜的观察方向,将拟切除的息肉置于屏幕下方,固定镜头。助手将息肉勒除器送入肠镜内,待圈套器距离肠镜约1 cm 时打开圈套,对准息肉后向下压,同时使用套管吸引器吸引息肉及周围组织,调整圈套及吸引器的位置,将圈套套入息肉根部,助手逐渐收紧圈套器并勒除息肉,取出勒除器。勒除结束后观察手术创面并用生理盐水冲洗一次,将无菌纱布放入创面附近,用纱布包裹息肉后,经负压吸引器吸引固定后一起取出肠道外。最后,生理盐水反复冲洗创面,确定手术创面无活动性出血后退镜。如手术创面存在明显的活动性出血点,可以用钛夹夹闭创面止血。所有息肉一经取出肠道外,立即放置在平展的纱布上,测量息肉直径,并予以福尔马林液浸泡固定后进行病理学检查。(2)活检钳除组:将活检钳经钳道送入,稳定位置,对准息肉部位,分次完整钳除息肉。切除的息肉标本和创面的处理同冷圈套组。(3)电切组:准备好高频电凝电切设备,患者身上贴好负极板,治疗将息肉勒除器经钳道送入,圈套息肉后行高频电流切除息肉,必要时电切前辅以黏膜下注射肾上腺素溶液(1∶10 000),使抬举征阳性。切除的息肉标本和创面的处理同冷圈套组。
1.3 观察指标及评价标准 (1)息肉的位置、大小、数量,手术时间(取器材准备完毕到标本取出肠道的时间),治疗费用;(2)术中出血率(指操作过程中持续1 min 以上的出血),术后两周的出血率(指术后2 周后出现肠道出血),手术并发穿孔率;(3)结肠息肉的完整切除率、标本回收率(标本回收率=病理报告例数/总例数×100%,即取出的标本顺利完成病理检验)。
1.4 统计学处理 所有数据均经过SPSS 19.0 软件包进行统计学处理。计量资料采用均数±标准差()表示,组间比较采用单因素方差分析;计数资料以率(%)表示,组间比较采用χ2检验。检验水准α=0.05,P<0.05 表示差异有统计学意义。
2 结果
2.1 三组一般资料比较 三组患者性别组成,年龄,发病时间及息肉的位置、直径、数量等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。见表1。
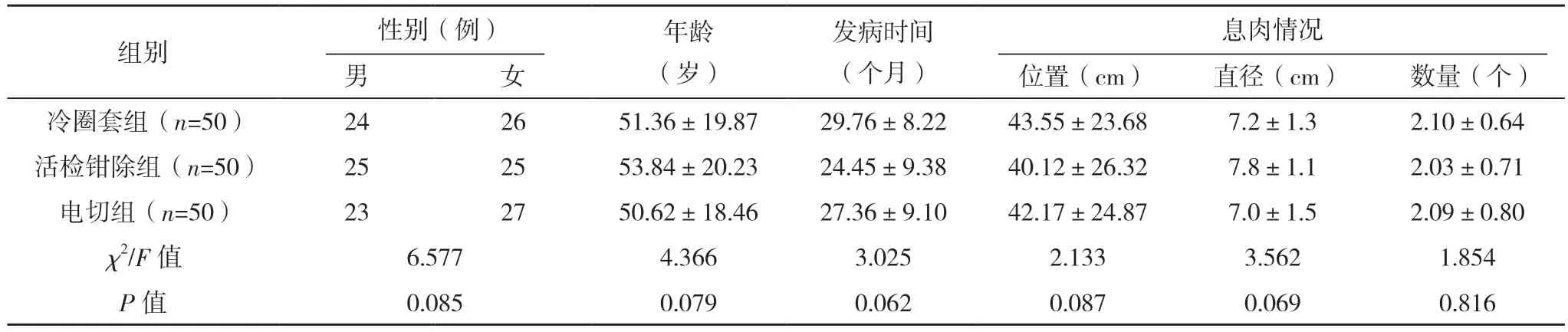
表1 三组一般资料比较
2.2 三组手术情况比较 电切组的手术时间长于冷圈套组和活检钳除组、治疗费用高于冷圈套组和活检钳除组(P<0.05);冷圈套组、活检钳除组手术时间、治疗费用相比,差异均无统计学意义(P>0.05)。见表2。
表2 三组手术情况比较()
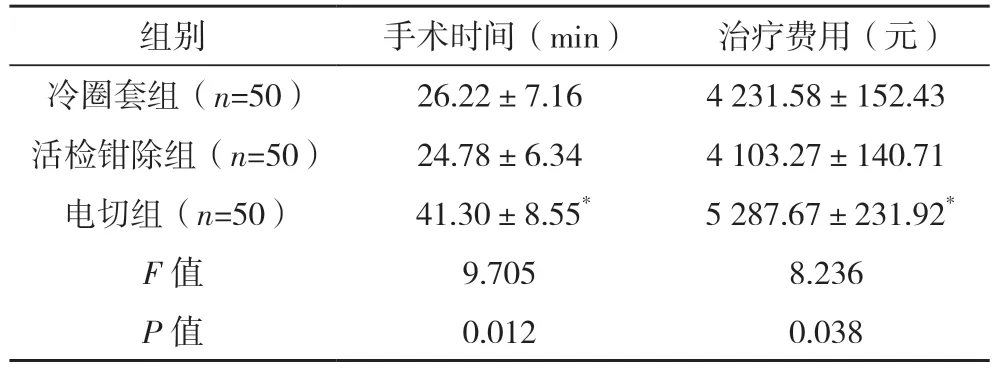
表2 三组手术情况比较()
*与冷圈套组、活检钳除组比较,P<0.05。
2.3 三组术中出血、术后两周出血及肠穿孔发生情况比较 电切组术后两周出血率高于冷圈套组和活检钳除组(P<0.05);三组术中出血率相比,差异无统计学意义(P>0.05);三组患者均未出现肠穿孔。见表3。
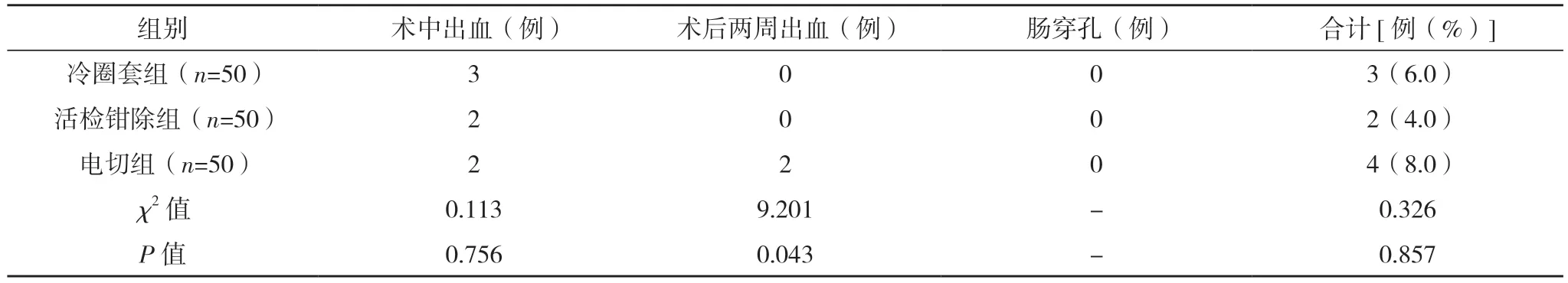
表3 三组术中出血、术后两周出血及肠穿孔发生情况比较
2.4 三组结肠息肉完整切除率及标本回收率比较 冷圈套组、电切组结肠息肉完整切除率均高于活检钳除组(P<0.05);冷圈套组和电切组相比,差异无统计学意义(P>0.05);三组标本回收率相比,差异无统计学意义(P>0.05)。见表4。
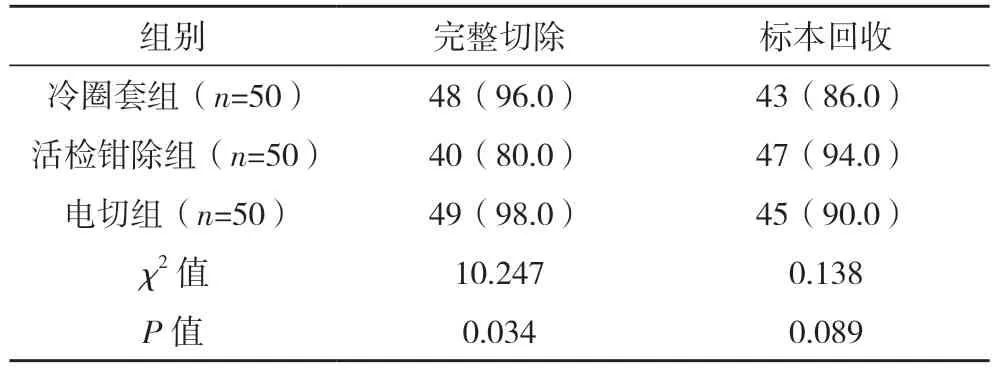
表4 三组结肠息肉完整切除率及标本回收率比较[例(%)]
3 讨论
大肠息肉(尤其是其中的腺瘤样息肉)与大肠癌的发病关系密切,以往的研究已经证实,及时的切除息肉可以有效地降低大肠癌的发病率[5]。临床结肠镜检查过程中发现,大部分结直肠息肉为直径<10 mm 的小息肉(约占90%),其中直径≤5 mm 被称为结直肠微小息肉[6]。内镜下息肉热切除术目前已广泛应用于结直肠息肉的治疗,技术也较为成熟[7]。已有多种热切方法用于结直肠小息肉的内镜下切除,如高频电凝、高频电圈套切除、激光治疗[8]、微波治疗[9]等。但息肉热切除术后可能出现出血、穿孔[10]及电凝综合征[11]等众多不良反应,这使得其应用有一定的限制。
圈套器冷切除肠道息肉是近年来兴起的一种手术方式[12],采用圈套器缓慢圈套息肉,将息肉边缘外2 mm 正常组织一并圈套,收紧圈套后完全勒除息肉,再用生理盐水冲洗创面或用钛夹止血。相比于热切除,冷圈套切除操作无高频电流,无烟雾产生[13],手术视野更加清楚,同时圈套切除息肉流程短,不需要准备电切及负压吸引设备[14],有利于术前准备和手术操作更快地完成。从试验结果来看,采用冷切除方法的活检钳除组和冷圈套组的手术时间短于电切除组(P<0.05)。在手术器械方面,活检钳除组和冷圈套组仅需要使用的活检钳或一次性息肉勒除器[15],因而费用均明显低于电切除组(P<0.05)。
从术中术后并发症看,冷圈套组和活检钳除组在术后两周出血等并发症的发生率低于电切除组(P<0.05)。电切除组切除息肉使用高频电流,灼烧肠管黏膜及黏膜下组织,甚至伤及部分肌层组织,尽管术中可以通过结痂覆盖创面来达到止血的目的,但术后结痂掉落容易导致二次出血。对于直径小于10 mm 的息肉,血流大多由毛细血管供应,这些毛细血管位于黏膜层,管径较细,直接钳除后通常可以自行凝血[16],因而三组患者在术中出血率方面相比无明显差异(P>0.05)。进一步分析数据看出,冷圈套组和活检钳除组并发出血主要为术中出血,术中出血更易发现和及时控制,避免二次操作。热圈套出现的出血大多为迟发性出血[17],增加了二次操作的风险。
不论采用何种手术方式,手术目的首先是要尽可能完整切除息肉,防止息肉残留和复发。从手术切除率看,冷圈套组、电切组的切除率较高,且均明显高于活检钳除组(P<0.05)。使用冷圈套和电切刀时,可以从息肉根部切除,确保息肉的完整切除率;而活检钳口径较小(通常小于5 mm),面对体积较大的息肉时只能从其表面逐步切除,因而容易残留,这是由不同手术器械的特点决定的。息肉切除后,标本均需要进行相关的病理学检测,以确定息肉的病例类型,决定后续的治疗方案[18]。本研究中,三种手术方法切除息肉后均存在标本丢失的情况,即未能将标本取出肠道。笔者分析原因主要有以下几点:(1)息肉切除容易回缩导致边缘圆滑,活检钳和异物钳尖端往往难以钳夹,同时回缩的息肉体积较小,圈套器圈套和电切环也不易固定。(2)有时息肉较大,无法通过操作管道内孔,只能随着器械取出[19];在随镜取出过程中息肉容易掉落至肠腔,需要再次甚至多次进镜寻找,容易丢失标本。(3)患者肠道准备的质量差。如果肠道准备质量欠佳,息肉脱落掉入肠液中,往往增加取出难度。本研究中,三种手术方式标本回收率相比无统计学差异(P>0.05),说明手术方式并不是影响标本回收的因素,采用不同的手术方式均会出现标本丢失的情况(14.0% vs 6.0% vs 10.0%)。有学者提出标本回收的主要原因是手术操作技巧[20]和围手术期准备,因而临床医师可以通过提高操作技巧,减少标本的丢失。
目前随着内镜的技术的快速发展,活检钳切除、息肉勒除器冷圈切除和热电凝切除三种息肉切除方法已逐步应用于临床。本研究结果显示,对于6~9 mm 的大肠小息肉,选择息肉勒除器冷圈切除,手术时间短、并发症较少且有利于标本的获取,不失为一种较好的手术方式,值得在各级医院推广。

