海南吊罗山热带雨林桫椤种群结构与动态特征
谢春平,王常玲,王候河,李超杰,陈 林
(1. 琼台师范学院 理学院 生物系,海南 海口 571127;2. 江苏盐城国家级珍禽自然保护区管理处,江苏 盐城 224333;3. 南京林业大学 生物与环境学院/南方现代林业协同创新中心,江苏 南京 210037)
0 引言
种群结构与动态是揭示种群现状与预测种群发展趋势的基础,是种群生态学研究的核心[1]。种群结构展现的是物种与其生长环境长期适应的结果,或是对外部环境干扰的响应[2];同时也是种内和种间关系的另一种表现方式[3]。随着时间推移,种群在不同龄级间有出生、死亡、迁入和迁出等数量变动特征[4-5]。这一数量动态的变化可通过种群数量结构、静态生命表、存活曲线、时间序列等手段进行量化分析[6],从而揭示种群的真实现状。因此,研究种群的结构与动态特征,尤其是对珍稀濒危植物具有较高的现实意义[7],为种群的保护、利用、管理等提供科学策略[8-9]。桫椤是树蕨(tree fern)的一种,当前有树蕨分布的科主要有蚌壳蕨科(Dicksoniaceae)、 蚌桫蕨科(Metaxyaceae)、 桫椤科(Cyatheaceae)等。古生物学研究表明,在侏罗纪、白垩纪等地质时期,蕨类植物多数为高大的木本植物;但随着地球环境的变化,现存蕨类植物多数为草本,而树蕨则极为罕见。因为树蕨均具有相似的生物学特性,树蕨是地球珍稀的木本蕨类植物,它在揭示植物区系起源与演化、植物系统发育、植被演化、地球气候环境变化等方面具有重要作用[10]。树蕨生态学研究备受学者的关注[11-12],在对澳大利亚墨尔本维多利亚中央高地桉树(Eucalyptusregnans)与树蕨(Dicksoniaantarctica和Cyatheaaustralis)共生的森林研究表明,当森林受到砍伐后,树蕨的多度呈急剧下降的趋势,同时也会导致其他直接依赖树蕨作为栖息地的物种数下降[13]。通过对墨西哥东马德雷山脉的美国树蕨(Dicksoniasellowiana)种群结构的调查结果表明,低龄级的个体数占有较大优势,但种群密度较低,这可能与生境破碎化有较大的关系[14]。在对乌干达西南部卡林祖中央森林保护区的树蕨(Cyatheamanniana)种群研究表明,该区域树蕨的种群大小受水分和光照强度等非生物因素的影响以及伐木等人为活动共同影响,而钟形和不规则形状的种群结构特征预示着种群更新不良,亟须进行保护[15]。
植物种群结构特征是物种保护的基础,可迅速掌握种群在时间和空间上的变化规律,及时了解种间关系及物种与环境间的相互关系,从而预测种群的变动趋势,为种群及群落的保护和管理提供有价值的参考[16]。对贝宁阿塔科拉省的乳油木(Vitellariaparadoxa)在不同土地利用模式下的种群结构分析后表明,高达92%的调查点都是以小径级个体占优,这表明该区域具有稳定的再生群体,而对幼树幼苗的管理是保证未来种群稳定的关键[17]。通过对苏丹阿布加达夫自然保护区的树木种群结构特征的研究发现,过度放牧及非法采伐是影响该区域树木种群结构的主要因素,并深刻地影响到了种群幼树及幼苗的更新,迫切需要对重要性价值指数低的物种进行保护[18]。巴基斯坦东北部地区的西藏长叶松(Pinusroxburghii)种群结构显示,低龄级个体数不足以补充至中高龄级,无法满足森林更新的需求;过度采伐及其他人为活动是影响其种群更新的关键因素[19]。
国内也对树蕨开展了相关研究,例如对峨眉山桫椤(Alsophilaspinulosa)种群研究时发现,导致该区域种群濒危的主要因素是幼树个体损失无法补充种群更新[20];四川画稿溪国家级自然保护区桫椤种群虽然具有一定的自然更新能力,但人为活动的干扰可能是限制该种群的重要因素之一[21];海南霸王岭自然保护区内的黑桫椤(Alsophilapodophylla)为低增长性的稳定种群,但仍应注意减少人为干扰和提升幼树幼苗的数量[22]。在过去的几十年里,桫椤等其他树蕨由于纤维利用和较高的观赏价值而被密集开发,导致自然种群枯竭[23]。同时,由于这些物种生长缓慢以及依附其中的特定附生植物的丧失,持续的开发可能会导致这些群体在自然界中消失[24]。综合分析,除去树蕨本身生物学特性的影响,森林采伐、人为干扰、气候变化、生境破碎化等外部因素对树蕨的生存有较大威胁。因此,加强不同区域树蕨种群生态学研究,有针对性地提出保护策略具有重要意义。
国内树蕨主要分布于热带和亚热带地区的浙江、福建、台湾、江西、广东、海南、广西、湖南、四川、贵州、云南和西藏等地[25],现均已列为国家Ⅱ级重点保护植物。根据文献及实际调查表明,海南分布有黑桫椤、大叶黑桫椤(Alsophilagigantea)、粗齿桫椤(Alsophiladenticulata)、中华桫椤(Alsophilacostularis)、阴生桫椤(Alsophilalatebrosa)、桫椤和白桫椤(Sphaeropterisbrunoniana)等树蕨[22, 26]。海南不同区域分布的树蕨受到生物与非生物因素的限制,种群结构特征表现出较大的差异,如山地雨林和低地雨林的黑桫椤平均密度及立木平均密度各自差异极显著[27]。笔者在海南热带雨林国家公园吊罗山片区进行野外科考时发现,从山脚至山顶,沿道路及河流两岸有丰富的天然桫椤属种群分布。旅游等外界因素是否会对桫椤种群结构产生影响?片区内的整体种群现状及不同区域的桫椤种群是否又有明显差别?这些具体的种群生态学问题都有待回答,为桫椤的保护提供理论基础。基于此,以吊罗山天湖附近沿河的桫椤种群为研究对象,对桫椤其种群龄级结构特征、静态生命表、存活曲线、种群动态数量、时间序列等进行分析,为该区域桫椤种群资源保护提供科学依据。
1 材料与方法
1.1 研究地概况
海南热带雨林国家公园吊罗山片区位于海南省东南部(18°43′—18°58′N,109°43′—110°03′E),全片区面积约为3.8 万hm2。该区属热带海洋季风气候,年均温24 ℃,7月最高均温28 ℃,11月最低均温15 ℃。研究区光照和热量条件优良,年降水雨量1 870~2 760 mm,年均日照时数1 676~2 150 h;相对湿度月均80%~85%,多雨月份达90%以上[28]。保护区范围的土壤类型主要为山地黄壤和山地赤红壤。在保护区内主要有热带低地雨林、热带季雨林、热带山地雨林、热带山地常绿阔叶林、山顶常绿阔叶矮林等5种植被型,种子植物近2 000种[29]。
桫椤所在群落乔木层主要以罗汉松科(Podocarpaceae)、桃金娘科(Myrtaceae)、壳斗科(Fagaceae)、山茶科(Theaceae)、樟科(Lauraceae)等植物占优,常见有陆均松(Dacrydiumpectinatum)、鸡毛松(Dacrycarpusimbricatusvar.patulus)、线枝蒲桃(Syzygiumaraiocladum)、罗浮锥(Castanopsisfabri)、黄杞(Engelhardtiaroxburghiana)、海南蕈树(Altingiaobovata)。灌木层主要有紫毛野牡丹(Melastomapenicillatum)、华南毛柃(Euryaciliata)、算盘子(Glochidionpuberum)、天堂瓜馥木(Fissistigmatientangense)、单花山矾(Symplocosovatilobata)、四角蒲桃(Syzygiumtetragonum)等;草本层植物有卷柏(Selaginellatamariscina)、新月蕨(Pronephriumgymnopteridifrons)、延龄耳草(Hedyotisparidifolia)、黎婆花(Arisaemahainanense)、海南冷水花(Pileatsiangiana)、海南山姜(Alpiniahainanensis)等。群落内除了桫椤为国家重点保护植物外,其他重点保护植物还有石碌含笑(Micheliashiluensis)、山铜材(Chuniabucklandioides)、半枫荷(Semiliquidambarcathayensis)等。因此,桫椤所在群落呈现出结构复杂、物种多样性高、特有性强、珍稀性高等特点。
1.2 研究方法
1.2.1 野外调查
于2022年5月进行野外调查,在吊罗山国家公园新安林场旧址天湖附近,沿山体河流走势,分别设置3条样线进行调查(上游、中游和下游),即上游样线、中游样线和下游样线。对样线内出现的桫椤进行每木测量,利用钢卷尺和测高器测量植株的高度、基径和冠幅,同时目测桫椤的生长状况。逐一记录群落内与桫椤共生的其他植物,对群落结构进行描述。群落环境因子及人为干扰程度等亦进行相应的记录(表1)。
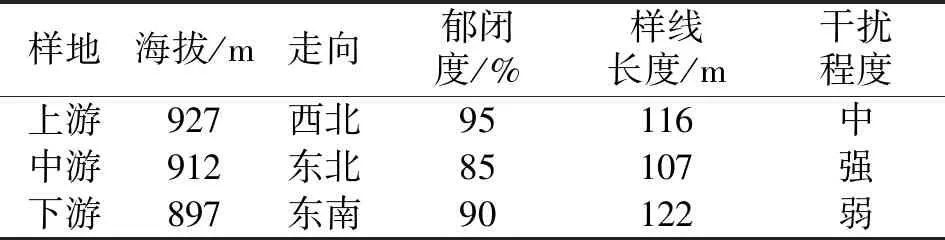
表1 吊罗山热带雨林桫椤种群调查样线基本情况Tab. 1 Physical characteristics of the three line tansect of Alsophila spinulosa in Diaoluo mountain rainforest
1.2.2 分析方法
(1)种群龄级结构划分
乔木由于形成层细胞周期性的分生,使胸径和树龄存在有规律的线性关系,可通过钻取树芯获得树木的实际年龄;因此以“空间推时间”,利用胸径大小估测树木树龄已是当前研究树木种群年龄的成熟方法[3-4]。木本蕨类植物的生物学特性决定了其在整个生命周期内的径向增长几乎恒定[21],故桫椤的龄级结构无法用胸径进行划分。研究表明,桫椤的高度结构和年龄具有显著相关性[30],因此利用高度级划分桫椤的龄级结构是可靠的[14, 31]。采用“高度级替代龄级”的方法,根据植株主茎的高度将吊罗山桫椤种群划分为5个龄级,分别为Ⅰ级(0~50 cm)、Ⅱ级(50~100 cm)、Ⅲ级(100~150 cm)、Ⅳ级(150~200 cm)、Ⅴ级(大于200 cm)。根据桫椤生物学特性及野外实际观测结果[28],将龄级Ⅰ和Ⅱ、Ⅲ和Ⅳ、Ⅴ分别定义为低龄级、中龄级和高龄级。
(2)静态生命表与存活曲线
生命表中的各项指数紧密关联,可通过实测现存个体数a0对其余各指标进行计算[6, 16-17]:
x龄级开始时标准化存活个体数:
(1)
x到x+1龄级间隔期间内标准化死亡数:
dx=lx-lx+1。
(2)
x到x+1龄级间隔期间死亡率:
(3)
x到x+1龄级间隔期间还存活的个体数:
(4)
x龄级到超过x龄级的个体总数:
(5)
x龄级个体的生命期望或平均期望寿命:
(6)
各龄级组消失率:
Kx=lnlx-lnlx+1。
(7)
(3)种群动态量化分析
①无外部干扰时的数量变化动态指数:
(8)
②随机干扰时的数量变化动态指数:
(9)
③种群对外界干扰所承担的风险概率:
(10)
其中:Sn与Sn+1分别为第n与第n+1年龄级种群个体数,min(…)表示取括符中数列极小值[33]。
(4)时间序列分析
采用一次移动平均法对桫椤各龄级结构的发展进行模拟预测:
(11)
其中:n为需要预测的时间(本文为龄级),t为龄级,“(1)”为1次平均移动,Xk为k龄级的种群大小[34]。
2 结果与分析
2.1 种群结构
调查表明,3条样线内共计有桫椤植株215株,其中上游、中游和下游的样线内所含个体数分别为67、89和59,呈现出分布不均的情况(图1)。
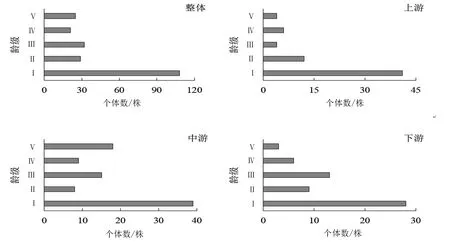
图1 吊罗山热带雨林桫椤种群桫椤种群年龄结构Fig. 1 Age structure of Alsophila spinulosa population in Diaoluo mountain rainforest
在上游样线中,Ⅰ龄级个体数最多有41株,占该样线内个体总数的61.19%;随后,各龄级个体数及所占比例逐渐减少,分别为12株(17.91%)、4株(5.97%)、6株(8.96%)和4株(5.97%)。中游样线的桫椤种群结构呈现出两头大、中间小的情况。其中Ⅰ龄级和Ⅴ龄级占有个体数最多为39株和18株,分别占样线内总体个体数的43.82%和20.22%;其中,在Ⅲ龄级出现了一次波动,个体数比临近的Ⅱ和Ⅳ龄级多,达15株。在下游样线中,个体数最多的仍出现在Ⅰ龄级为28株,占样线内个体总数的47.46%;该样线的种群结构与中游类似,亦在Ⅲ龄级出现了一个小高峰(13株,占22.03%),随后呈逐渐下降的趋势。因此,不论是将3条样线的种群个体数分开或综合整体来看,种群结构均表现出从低龄级往高龄级逐渐减小的趋势;虽然各样线种群结构不尽相同,个体数在不同龄级内出现波动,但种群结构特征表现为增长型。
2.2 静态生命表
由表2可知,吊罗山热带雨林桫椤种群各样线内的标准化存活个体数(lx)有差异,但个体数均随龄级的增加而逐渐减少,平均期望寿命(ex)亦逐渐降低。从整体看,消失率的最大值(Kx)出现在Ⅰ龄级,为1.49,随后则呈逐渐下降的趋势;在Ⅱ和Ⅳ龄级的致死率为-0.10和-0.17,出现了负值的情况;死亡率也同为负值。由于静态生命表是多个世代在特定时间内的叠加,因此负值不可避免;但负值仍具有生态学意义,即表明了种群处于波动性的发展过程中[35]。从各样线的消失率看,消失率的最大值与整体种群类似,均出现在Ⅰ龄级,分别为1.23、1.58和1.61。在上游种群中,消失率随龄级的增加呈逐渐减小的趋势,而平均期望寿命的峰值出现在Ⅲ龄级(2.50),并逐渐向两端减小。在中游种群中,平均期望寿命的峰值则在Ⅱ龄级中出现(4.63),随后的第2个峰值出现在Ⅳ龄级(2.5);消失率和死亡率则整体上为逐渐降低的趋势,但负值的情况仍有出现。在下游种群中,平均期望寿命的峰值也是出现在Ⅱ龄级中(2.78),随后则有规律地逐渐减少;同时,消失率和死亡率的负值情况也是出现在Ⅱ龄级。从上述分析可以看出,桫椤种群在Ⅰ龄级具有较高的死亡率和消失率。这主要是因为雨林内的物种多样性高,种内和种间对资源的竞争异常激烈,产生了自疏和他疏现象;但当植株进入中龄和高龄后,对环境的适应能力及竞争力增强,则种群进入了平稳期,死亡率和消失率也开始呈下降的趋势。故低龄级向中龄级的过渡阶段是桫椤种群维持的关键。

表2 吊罗山热带雨林桫椤种群静态生命表Tab. 2 Static life table of Alsophila spinulosapopulation in Diaoluo mountain rainforest
2.3 存活曲线
以龄级为横坐标和标准化存活数(lnlx)为纵坐标,绘制吊罗山热带雨林桫椤种群存活曲线(图2)。Deevey存活曲线有3种类型:Ⅰ 型(凸曲线),表现出早期死亡率低,但达到平均生理年龄时,会在短期内个体全部死亡;Ⅱ型(直线型),种群各年龄段死亡率基本相同;Ⅲ型(凹线型),前期种群个体死亡率高,但进入某一龄级死亡率低而稳定[36]。图2所示的4条存活曲线中,除上游种群的存活曲线较为直观地接近Ⅲ型,其他曲线均有波动。故采用Hett & Loucks的数学模型进行检验[37],结果如表3所示。通过R2值比较,除了下游桫椤种群为Deevey Ⅱ型外,其余均为Deevey Ⅲ型;这也与生命表的结果大致吻合,即在Ⅰ龄级存在较高的死亡率和消失率。
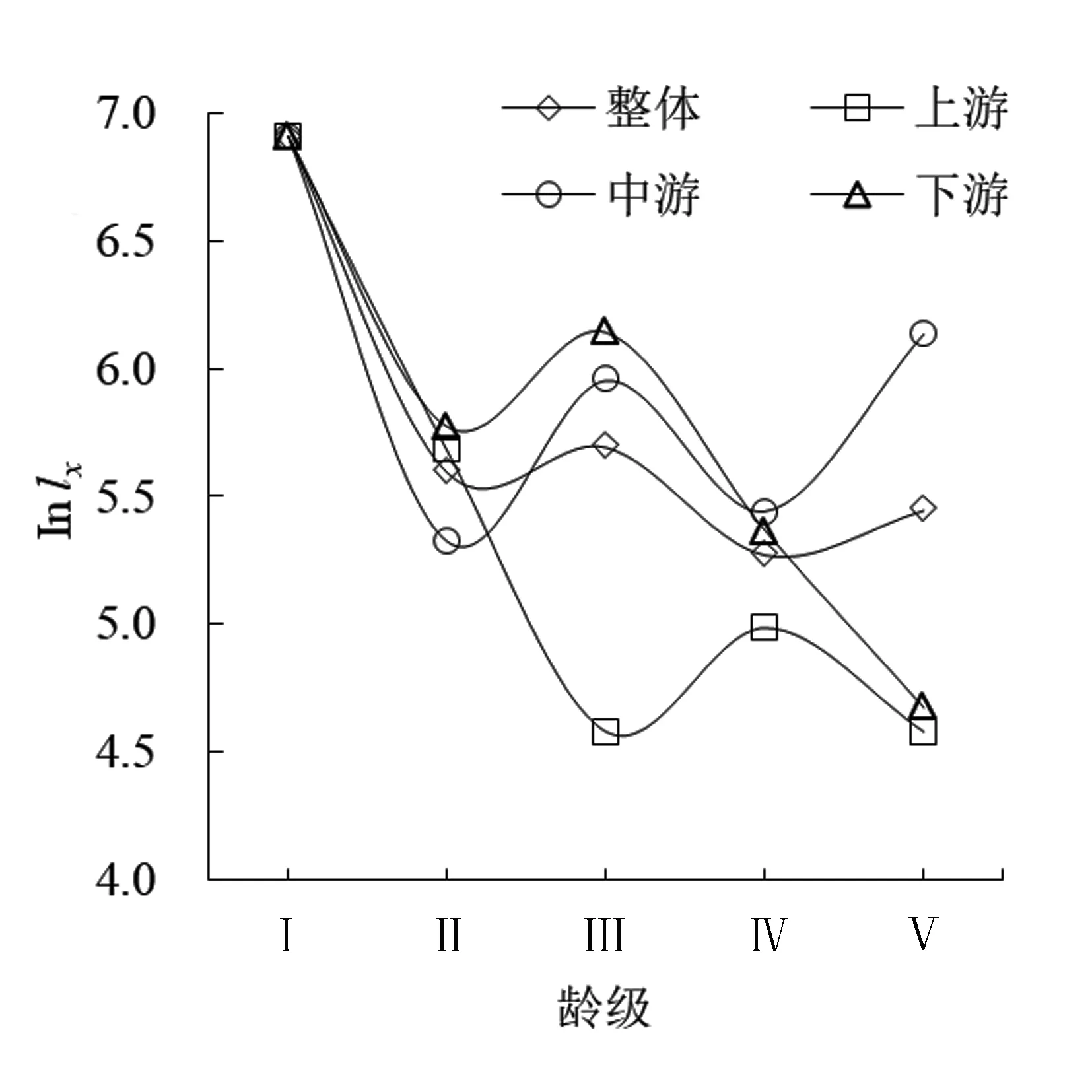
图2 吊罗山热带雨林桫椤种群存活曲线Fig. 2 Survival curve of Alsophila spinulosa population in Diaoluo mountain rainforest
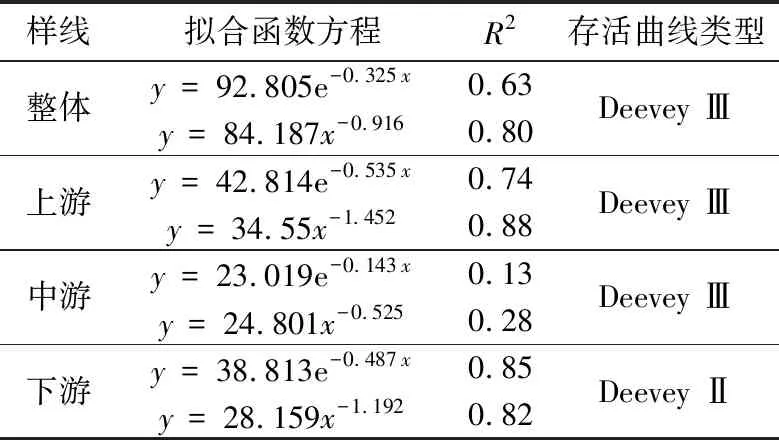
表3 吊罗山热带雨林桫椤种群存活曲线方程Tab. 3 The equation of survival curve for Alsophila spinulosa population in Diaoluo mountain rainforest
2.4 种群动态数量化
对吊罗山热带雨林桫椤种群动态量化分析的结果如表4所示。
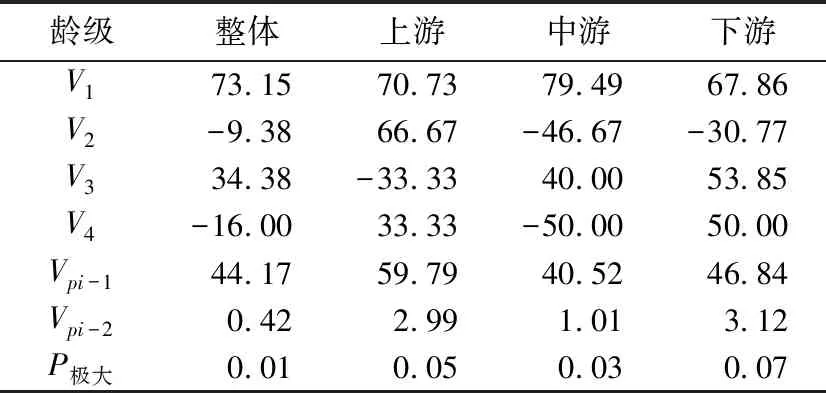
表4 吊罗山热带雨林桫椤种群动态变化指数Tab. 4 Dynamic index of Alsophila spinulosa population in Diaoluo mountain rainforest
从整体看,种群动态变化指数在V2和V4出现了负值,分别为-9.38%和-16.00%,其余均为正值。上游和下游种群的种群动态变化指数分别在V3和V2出现了负值,分别为-33.33%和-30.77%;中游种群在V2和V4出现了负值,分别为-46.67%和-50.00%。因此,各样线桫椤种群龄级间具有明显的波动性。在无外部干扰时(Vp(i-1)),种群的数量变化动态指数分别为44.17%、59.79%、40.52%和46.84%;随机干扰时(Vp(i-2)),种群的数量变化动态指数则急剧减小,分别为0.42%、2.99%、1.01%和3.12%,但偏离0的程度较低。上述的种群动态量化值为零、负数和正数时分别反映种群处于稳定、衰退和增长的状态。
因此,从整体或是从各样线看,吊罗山桫椤为增长种群,这与种群结构反映的结果一致。但种群对外界干扰所承担的风险概率(P极大)值均较小,分别为0.01、0.05、0.03和0.07,说明了吊罗山的桫椤种群对外界干扰具有较高的敏感性,抗干扰能力较低。目前,增长的种群结构在无外界干扰的环境中较为明显,但有相应的外界干扰介入,这种增长或稳定的种群结构则很容易被打破。
2.5 时间序列
以各龄级实际存活数为基数,按一次平均推移法预测各龄级在未来1、2、3个龄级后吊罗山桫椤种群的存活个体数(表5)。
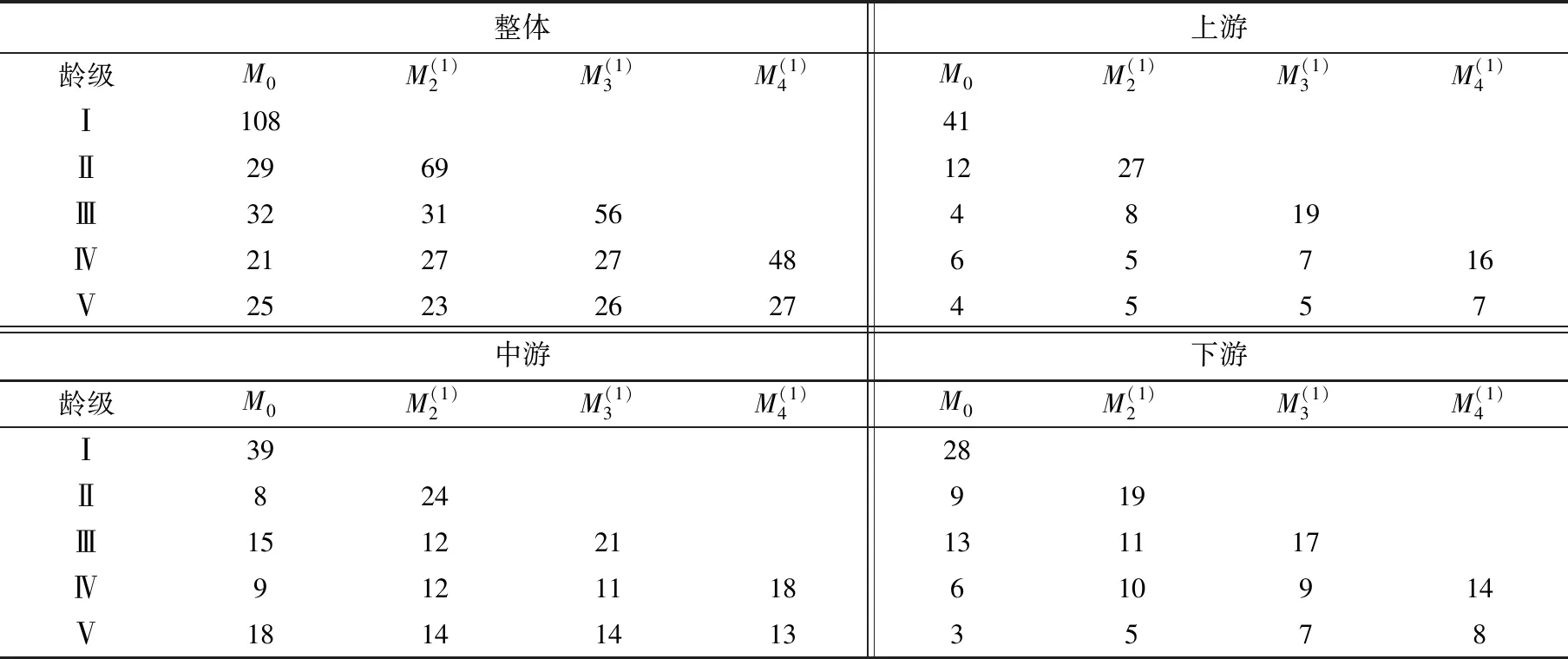
表5 吊罗山热带雨林桫椤种群数量动态时间序列预测Tab. 5 Time sequence prediction of number dynamics of Alsophila spinulosa population in Diaoluo mountain rainforest
随着时间的推移,各龄级在未来的种群数量多数呈增长状态。从整体情况来看,Ⅳ龄级在未来1、2、3个龄级后的增幅分别为28.57%、28.57%和128.57%,即表明有成倍的桫椤个体数能够进入Ⅳ龄级。类似地,中游和下游种群的Ⅳ龄级在未来1、2、3个龄级后的增幅分别为33.33%、22.22%、100%和66.66%、50.00%、133.33%。但是,在上游的种群其增幅则表现为-16.67%、16.67%和166.67%,即在早期会出现个体数波动的情况。时间序列预测的结果与种群动态量化分析的结果基本一致,均表明了当前桫椤为增长型种群。同时,各龄级个体数的变动一方面取决于低龄级个体的基数,即幼树幼苗越丰富则后期的增长潜力越大;另一方面也说明了,保证有一定数量的低龄级个体数进入中高龄级是种群延续的关键。
3 讨论
吊罗山热带雨林3条样线及整体种群结构均为金字塔型或近金字塔型,这与四川画稿溪桫椤种群结构近似[21],而不同于峨眉山种群[20]和习水自然保护区种群[38]。从龄级结构分布来看,研究区各种群的I龄级个体数均较为丰富,表明当前有较为充裕的更新苗,种群的自然更新与繁育能力良好。但从Ⅱ龄级开始,种群数量开始减少,整体种群数量在不同龄级间有明显的波动。这可能是在群落内存在自疏与他疏作用以及环境的筛选,导致一定数量的幼树幼苗被淘汰。同时,静态生命表的死亡率和消失率的峰值也基本出现在Ⅰ龄级。所以,Ⅰ龄级的幼树能否顺利进入下一龄级对种群的发展较为关键。存活曲线除了下游表现为Deevey Ⅱ型外,其余均为Deevey Ⅲ型,反映出种群前期死亡率高而后期趋于稳定的状况。热带雨林由于物种多样性高,物种个体间对资源的竞争激烈程度要强于任何一种类型的森林,因此物种越早进入群落的上层则所受的外界竞争压力越小,而林下层个体均是处于受压迫的境况[39]。此外,这种激烈的竞争似乎并不存在绝对的优胜者,只有在群落上层占据了优势,而下层更新苗又有强大抗压能力的种群才能在群落中长期存在[40]。低-中-高龄级均有一定数量的桫椤个体分布,保证了上层的优势和林下层的更新补充,因此在没有外界强烈干扰下,吊罗山热带雨林内的桫椤种群暂无生存风险。
生命表负值的出现并不符合编表设定的3个假设[41],但仍能提供有用的生态学记录,即表明种群在不同龄级间具有波动性,在发展或衰退的过程中[42];种群动态变化指数中的负值也是种群存在波动的一种反映。不同龄级间个体数量的波动性变化反映了种群的更新动态,它可通过种群基波的周期长度表现[38];因此,种群结构的波动性是种群固有的属性。在没有外界干扰的情况下,波动性主要受生物学因子限制,如物种本身的生物学特性、种内与种间竞争等;如竹类植物对桫椤的繁殖产生明显的限制性作用[21]。在有外界干扰的情况下,森林采伐、旅游、生境破碎化、气候因素等均会对桫椤种群产生影响[13-15, 21, 38]。天然种群生长环境的复杂性决定了种群在周期性波动过程中向前发展。
适度干扰是否对当前桫椤种群有较大的影响?桫椤一般喜温暖湿润,其生境以热带雨林或季雨林为主,一般年均温需在15 ℃及相对湿度80%以上,这就决定了桫椤多数分布在深沟峡谷与河流沿岸[43]。虽然成年桫椤所在的群落具有较高的郁闭度,但桫椤的繁育过程仍需活动性或间歇性的光斑投射在群落内[44]。同时,在热带地区低透光率的群落,加剧了种内与种间对资源的竞争,一定程度上限制了桫椤幼苗生长[26]。日本屋久岛的桫椤呈现出先锋树种的特性,在有中度干扰的沟谷、溪边及路边均能较好地生长[45]。研究表明,桫椤孢子囊开裂所需时间和孢子持续弹射时间与空气湿度密切相关,即湿度越低,孢子开裂和散落的时间越短[44];而湿度与光照密切相关,适度光照可促进孢子囊的发育和传播。结合本文的实际情况来看,上游、中游、下游3条样线的干扰强度分别为中、强和弱,与之相对应的种群数量则恰好为中游>上游>下游。此外,从研究区的其他地方(如沿山旅游公路,定义为有干扰区域)也能够观测到林相较好的桫椤群落。因此,避免高强度的生境破坏[13, 15, 46],轻度干扰可能利于桫椤的生长。
4 结论
桫椤作为当前吊罗山热带雨林的伴生树种,对提升群落物种多样性及维护群落稳定具有重要意义。当前整体种群及各样线小种群均属于增长型;种群动态量化分析的结果表明,各龄级间存在一定的波动,而生命表、存活曲线、时间序列分析等结果均表明,低龄级个体数对该区域桫椤种群的发展较为关键。因此,依据不同环境特征对现有种群进行有针对性的管理,整体上保持现有群落结构和生境有利于当前桫椤种群的增长。

