菟丝子中一个新的吲哚类生物碱
杜 锟,薛贵民,支燕乐,赵珍珠,司盈盈,陈 辉,马金莲
1河南中医药大学药学院,郑州 450046;2河南中医药大学第一附属医院,郑州 450000;3河南中医药大学中医药科学院,郑州 450046
组蛋白赖氨酸特异性去甲基化酶1(lysine specific demethylase 1,LSD1)是第一个被发现的组蛋白去甲基化酶,2004年由施洋课题组所报道[1]。LSD1可通过黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)催化的氧化反应,能特异性去除组蛋白赖氨酸H3K4及H3K9的单甲基和双甲基[2],从而激活或者抑制基因的转录。LSD1通过改变与肿瘤增殖和转移相关基因启动子区域组蛋白的甲基化状态,从而调节相关蛋白的表达,促进多种肿瘤细胞的生长和转移[3]。目前,LSD1已被证实是一个重要的致癌驱动因素和多种肿瘤的治疗靶点。研究已显示,多种黄酮类化合物对LSD1具有较好的抑制活性,为发现新型抗肿瘤先导化合物打下基础[4]。但是,不同的黄酮类化合物可显示较大差异的LSD1抑制活性,和其取代基的变化密切相关[4]。
菟丝子Cuscutachinensis系旋花科(Convolvulaceae)菟丝子属(Cuscuta)植物,为一年生寄生草本,广泛分布于我国东北、西北以及华北等地区,其种子为中医临床中常用的补益中药[5]。菟丝子味辛、甘、平,归肝、肾、脾经,具有补益肝肾,固精缩尿,安胎,明目,止泻等功效[6]。现代药理学研究显示菟丝子在生殖系统调节、抗衰老、免疫调节、心脑血管保护和降血糖等方面具有显著的药用价值[5]。菟丝子的化学成分主要为黄酮类化合物,此外还含有木脂素类、萜类和生物碱类等化合物[7]。因此,为进一步了解中药菟丝子的药效物质基础,提高其资源综合利用效率,本文对菟丝子的甲醇部位的化学成分进行了分离纯化和结构鉴定,并测试了其中黄酮类化合物的LSD1抑制活性,以期发现具有抗癌作用的先导化合物。
1 材料与方法
1.1 仪器与试剂
Bruker AVANCE III 500型核磁共振仪、Bruker maxis HD型飞行时间质谱(德国Bruker公司);Flexa型中压制备液相色谱仪(博纳艾杰尔,FL-H050G型半制备型高压输液泵,HP-Q-UV100型紫外检测器,检测波长:210 nm和254 nm;Agela technologies型色谱工作站)。LC52型高压制备液相色谱仪(赛谱锐思北京科技有限公司,SP-5030型半制备型高压输液泵,UV200型紫外检测器,检测波长:210 nm和254 nm;Easychrom型色谱工作站;色谱柱为YMC-Pack ODS-A,250 mm × 20 mm,5 μm)。薄层色谱硅胶GF254、柱色谱硅胶(200~300目,青岛海洋化工厂);Sephadex LH-20(Pharmacia Biotech公司);RP-C18(40~60 μm,YMC);大孔树脂Diaion HP-20(日本三菱化学);甲醇(色谱纯,天津市四友精细化学品有限公司);其他试剂均为分析级;HEPES缓冲溶液(北京索莱宝公司);H3K4me2(上海吉尔生化公司)。
1.2 植物材料
菟丝子于2019年9月购自亳州市药材市场,经河南中医药大学药学院董诚明教授鉴定为旋花科植物菟丝子CuscutachinensisLam.的干燥成熟种子。凭证样本(ID-20190920)存于河南中医药大学天然药物化学与中药化学研究室。
1.3 化合物的提取分离方法
菟丝子干燥种子2.67 kg,二氯甲烷和甲醇依次浸泡提取3次,滤过,合并提取液,减压浓缩,分别得到二氯甲烷浸膏171 g和甲醇浸膏60 g。甲醇浸膏加水混悬,依次用乙酸乙酯、正丁醇萃取,减压回收溶剂,得乙酸乙酯部位(11 g)、正丁醇部位(18 g)。乙酸乙酯部位经Sephadex LH-20凝胶柱色谱纯化(甲醇),并经硅胶薄层色谱检识,合并相同流分得到16个组分(Fr.A1~A16)。Fr.A6经硅胶柱色谱分离(二氯甲烷-甲醇5∶1),得到组分5个亚流分(Fr.A6-1~A6-5)。Fr.A6-1 经制备型HPLC制备(45%甲醇,体积流量3 mL/min)得到化合物6(3.0 mg,tR= 7.9 min)。Fr.A14 经制备型HPLC制备(65%甲醇,体积流量 3 mL/min)得到化合物4(2.5 mg,tR= 10.0 min)、5(6.6 mg,tR= 16.5 min)。正丁醇部位经Sephadex LH-20凝胶柱色谱纯化(甲醇),并经硅胶薄层色谱检识,合并相同流分得到 15个组分(Fr.B1~B15)。Fr.B2(2 g)经硅胶柱色谱分离,依次用二氯甲烷-甲醇(25∶1、15∶1、10∶1)洗脱,得到组分5个亚流分(Fr.B2-1~B2-5)。Fr.B2-3 经制备型HPLC制备(20%甲醇,体积流量3 mL/min)得到化合物1(3.0 mg,tR= 13.5 min)。Fr.B7(1.5 g)经硅胶柱色谱分离,依次用二氯甲烷-甲醇(25∶1、15∶1、10∶1)洗脱,得到组分5个亚流分(Fr.B7-1~B7-5)。Fr.B7-3 经制备型HPLC制备(55%甲醇,体积流量3 mL/min)得到化合物2(7.5 mg,tR= 8.0 min)。Fr.B7-5 经制备型HPLC制备(55%甲醇,体积流量3 mL/min)得到化合物3(3.0 mg,tR= 9.0 min)。
1.4 LSD1抑制活性试验
利用纯化好的LSD1重组蛋白,在96孔黑孔板中每孔先加入LSD1重组蛋白与不同浓度的化合物在HEPES缓冲溶液中室温孵育,后加入反应底物H3K4me2溶液于37 ℃恒温摇床孵育;分别加入Amplex Red溶液,辣根过氧化酶溶液反应显色。最后用荧光酶标仪检测荧光强度。每板同时设定空白对照孔与100%对照孔。空白孔中的样品与H3K4me2分别用DMSO与缓冲溶液替代,100%孔中的样品用1.25 μL的DMSO替代。ORY-1001作为阳性对照化合物。酶活实验重复3次,使用SPSS20和GraphPad 7.0进行数据分析。
2 实验结果
2.1 化合物结构鉴定
化合物1淡黄色油状物,易溶于甲醇;ESI-HR-MS谱给出准分子离子峰m/z241.097 3[M+H]+(calcd for C14H13O2N2,241.097 2),确定化合物1的分子式为C14H12O2N2,计算其不饱和度为10。1H NMR谱(表1)中,低场区显示有1组1,2-二取代的芳香质子信号[δH8.18(1H,d,J= 8.0 Hz,H-9),7.20(1H,dd,J= 8.5,8.0 Hz,H-10),7.50(1H,dd,J= 8.5,8.0 Hz,H-11),7.58(1H,d,J= 8.0 Hz,H-12)],2个烯烃质子信号[δH8.20(1H,d,J= 5.2 Hz,H-5)和7.91(1H,d,J= 5.2 Hz,H-6)],1个活泼质子信号[12.0(1H,br s,N-H)];高场区显示1个亚甲基质子信号δH2.68(2H,t,J= 7.1 Hz,H-15)。另外,结合1H-1H COSY谱中的δH2.68(2H,t,J= 7.1 Hz,H-15),3.32(2H,overlap,H-14)自旋偶合系统和δH2.68(2H,t,J= 7.1 Hz,H-15)的偶合常数,提示结构中还有1个与溶剂峰重叠的亚甲基质子信号3.32(2H,overlap,H-14);13C NMR及DEPT谱中显示了10个芳香碳或双键碳(6个次甲基碳δC137.2、127.6、121.5、119.0、112.6、112.0和4个季碳δC140.4、134.2、126.9、121.0)。通过分析HSQC谱中相关(H-15/δC33.7,H-14/δC29.4)和HMBC谱中远程相关(H-14/δC176.3和H-14,H-5/δC145.8),提示该结构在13C NMR谱中未出现的两个亚甲基碳(δC33.7、29.4)、一个季碳(δC145.8)和一个羰基碳(δC176.3)信号。通过对以上数据和文献对比分析,推测化合物1为一个β-卡波林类生物碱[8]。结合1H-1H COSY图谱中显示的三个自旋偶合系统(H-9/H-10/H-11/H-12,H-5/H-6和H-14/H-15)(见图1),和HMBC图谱中的关键远程相关(H-14/C-2,C-3,C-16;H-5/C-3,C-7;H-6/C-2,C-8和H-9/C-7,C-13),化合物1鉴定为如图2所示的结构,命名为菟丝子新碱A(cuscutalin A,1),是一个新化合物。化合物1的ECD谱没有Cotton效应,同时,经IC手性色谱柱无法拆分,因此未确定C-3的绝对构型。化合物1的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。

表1 化合物1的1H NMR和13C NMR数据(500和125 MHz,DMSO-d6)

图1 化合物1的关键1H-1H COSY和HMBC相关
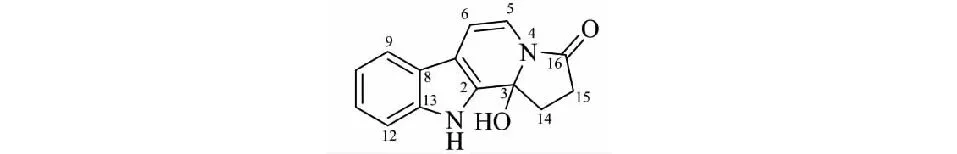
图2 化合物1的结构
化合物2淡黄色油状物,易溶于甲醇,ESI-MS:m/z463[M-H]-。1H NMR(500 MHz,DMSO-d6)δ:12.62(1H,s,5-OH),7.66(1H,dd,J= 8.5,2.0 Hz,H-6′),7.52(1H,d,J= 2.0 Hz,H-2′),6.81(1H,d,J= 8.5 Hz,H-5′),6.39(1H,s,H-8),6.19(1H,s,H-6),5.37(1H,d,J= 7.7 Hz,H-1′′),3.14~3.70(6H,m,H-2′′,3′′,4′′,5′′,6′′);13C NMR(125 MHz,DMSO-d6)δ:156.3(C-2),133.4(C-3),177.4(C-4),161.2(C-5),98.7(C-6),164.4(C-7),93.5(C-8),156.2(C-9),103.8(C-10),121.1(C-1′),115.1(C-2′),144.8(C-3′),148.5(C-4′),115.9(C-5′),122.0(C-6′),101.8(C-1′′),71.2(C-2′′),73.2(C-3′′),67.9(C-4′′),75.8(C-5′′),60.1(C-6′′)。以上数据与文献[9]报道一致,故鉴定化合物2为金丝桃苷。
化合物3淡黄色油状物,易溶于甲醇,ESI-MS:m/z597[M + H]+。1H NMR(500 MHz,DMSO-d6)δ:12.73(1H,s,5-OH),7.78(1H,dd,J= 8.5,2.1 Hz,H-6′),7.49(1H,d,J= 2.1 Hz,H-2′),6.79(1H,d,J= 8.5 Hz,H-5′),6.38(1H,s,H-8),6.18(1H,s,H-6),5.58(1H,d,J= 7.7 Hz,H-1′′),5.31(1H,d,J= 1.0 Hz,H-1′′′),3.03~3.85(11H,m,H-2′′,3′′,4′′,5′′,6′′,2′′′,4′′′,5′′′);13C NMR(125 MHz,DMSO-d6)δ:156.2(C-2),133.2(C-3),177.3(C-4),161.3(C-5),98.6(C-6),164.1(C-7),93.4(C-8),155.6(C-9),103.9(C-10),121.1(C-1′),115.5(C-2′),144.9(C-3′),148.4(C-4′),115.2(C-5′),122.4(C-6′),98.9(C-1′′),74.7(C-2′′),73.8(C-3′′),68.3(C-4′′),75.7(C-5′′),60.0(C-6′′),108.7(C-1′′′),76.1(C-2′′′),79.2(C-3′′′),73.9(C-4′′′),64.3(C-5′′′)。以上数据与文献[10]报道一致,故鉴定化合物3为槲皮素-3-O-β-D-半乳糖-(2→1)-β-D-芹糖苷。
化合物4淡黄色无定形粉末,易溶于甲醇;ESI-MS:m/z303[M + H]+。1H NMR(500 MHz,DMSO-d6)δ:12.48(1H,s,5-OH),7.67(1H,d,J= 2.1 Hz,H-2′),7.53(1H,dd,J= 8.5,2.1 Hz,H-6′),6.88(1H,d,J= 8.5 Hz,H-5′),6.39(1H,d,J= 1.5 Hz,H-8),6.17(1H,d,J= 1.5 Hz,H-6);13C NMR(125 MHz,DMSO-d6)δ:156.6(C-2),136.7(C-3),176.6(C-4),162.4(C-5),98.5(C-6),164.6(C-7),94.2(C-8),156.8(C-9),104.2(C-10),122.6(C-1′),115.5(C-2′),145.7(C-3′),147.2(C-4′),116.1(C-5′),120.8(C-6′)。以上数据与文献[11]报道一致,故鉴定化合物4为槲皮素。
化合物5淡黄色无定形粉末,易溶于甲醇;ESI-MS:m/z287[M + H]+。1H NMR(500 MHz,DMSO-d6)δ:12.48(1H,s,5-OH),8.05(2H,d,J= 8.5 Hz,H-2′,6′),6.91(2H,d,J= 8.5 Hz,H-3′,5′),6.15(1H,s,H-6),6.40(1H,s,H-6);13C NMR(125 MHz,DMSO-d6)δ:146.7(C-2),135.4(C-3),175.8(C-4),160.8(C-5),98.3(C-6),163.6(C-7),93.6(C-8),156.4(C-9),103.2(C-10),121.4(C-1′),129.3(C-2′,6′),115.1(C-3′,5′),159.2(C-4′)。以上数据与文献[12]报道一致,故鉴定化合物5为山奈酚。
化合物6无色针状结晶(MeOH),溶于甲醇;ESI-MS:m/z377[M + Na]+。1H NMR(500 MHz,DMSO-d6)δ:6.92(2H,d,J= 1.2 Hz,H-2,2′),6.86(2H,d,J= 8.0 Hz,H-5,5′),6.83(2H,d,J= 8.0,1.2 Hz,H-6,6′),5.99(4H,s,2 x OCH2O),4.64(2H,d,J= 4.1 Hz,H-7,7′),4.11(2H,dd,J= 9.0,6.8 Hz,H-9a,9′a),3.75(2H,dd,J= 9.0,3.4 Hz,H-9b,9′b),2.99(2H,m,H-8,8′)。以上数据与文献[13]报道一致,故鉴定化合物6为芝麻素。
2.2 LSD1抑制活性结果
对分离量较大的两个化合物2和5进行了LSD1抑制活性评价,分别设浓度(C)50、25、12.5、6.25、3.125、1.56、0.78、0.39 μmol/L,ORY-1001浓度设100 nmol/L。结果表明,化合物2和5对LSD1显示出较强的抑制作用,半数抑制浓度(IC50)分别为5.74 ± 0.49和3.94 ± 0.27 μmol/L(见图3),ORY-1001的抑制率为69%。

图3 化合物2和5的LSD1抑制活性
3 讨论与结论
本文从菟丝子的甲醇提取物中共分离得到6个单体化合物。其中化合物1是一个消旋体,为一个新的β-卡波林类生物碱,化合物2~5为黄酮类化合物,化合物6为一个木脂素类化合物。菟丝子总黄酮具有较好的体内外抗肝肿瘤活性,但其有效成分与作用机制尚未明确[14]。同时,菟丝子的LSD1抑制活性也尚未报道。本文首次对菟丝子中黄酮类化合物2和5进行了LSD1抑制活性评价,结果显示两个化合物均对LSD1具有较强的抑制作用,为完善黄酮类化合物LSD1抑制活性的构效关系研究打下基础。另外,菟丝子中富含黄酮类化合物,但其中生物碱类成分报道较少,本文进一步丰富了中药菟丝子中生物碱的种类,并为探究其药效物质基础和更好地开发利用菟丝子药材奠定了一定的理论基础。

