水稻花时调控机理与育种应用
苟亚军,朱薪宇,王海洋,沈荣鑫
(亚热带农业生物资源保护与利用国家重点实验室/岭南现代农业科学与技术广东省实验室/华南农业大学 生命科学学院, 广东 广州 510642)
水稻Oryza sativaL.是世界上最重要的粮食作物之一,全球超过一半的人口以水稻为主食,水稻产量的高低直接影响粮食安全[1]。20世纪50年代矮化育种和70年代杂交水稻品种的选育与推广,使我国水稻产量实现了2次重大突破[2]。但目前杂交稻多为籼稻亚种内杂交品种,杂交亲本遗传关系近,产量潜力已趋极限,导致近20年来我国水稻产量停滞不前。随着耕地面积减少和人口日益增长,不断提高水稻产量仍然是水稻育种的首要任务[3]。籼稻Indica和粳稻Japonica是亚洲栽培稻驯化过程中产生的2个明显分化的亚种,亚种间杂交具有强大的杂种优势,预计产量可较目前广泛种植的籼/籼杂交稻进一步提高20%左右,是杂交稻育种进一步发展的主要方向[4-5]。充分利用籼粳亚种间杂种优势是保障我国粮食供给安全的重要途径;但是,籼粳强杂种优势的直接利用受到籼粳杂种不育、杂种F1生育期长、F1株高偏高、粳稻柱头外露率低以及籼粳花时不遇等瓶颈因素的严重制约,导致籼粳杂交育种一直停滞不前。因此,解析上述籼粳杂种优势利用瓶颈因素的遗传基础具有重要的科学意义和应用价值。
花时是水稻重要的农艺性状,其概念包括2种:一种是指1朵颖花从开颖到闭颖的时间;另一种是指大田群体颖花在1 d中的开花时间或开花持续时间,可分为始花时(第1朵花开放的时间)、盛花时(颖花实际开放数达到当天应开花数的50%)和终花时(开花结束时间),通常指开花高峰或盛花时间[6-7]。大田群体颖花的盛花时间在水稻生产上具有重要意义,也是花时研究的主要对象。在杂交水稻生产过程中,父母本开花高峰错位的现象称为花时不遇。尤其是籼粳亚种间杂交制种时,作为父本的籼稻恢复系开花早,而作为母本的粳稻不育系开花晚,父母本花时不遇导致制种产量低,杂交种子价格高,严重阻碍了籼粳杂种优势的利用。此外,水稻颖花开放的时候对温度变化最为敏感,开花时遭遇高温会导致花药开裂不良、花粉活力降低,进而导致结实率降低[8]。因此,解析水稻花时调控的内外因素和遗传机理,对解决水稻杂交制种过程中花时不遇,以及开花期间因高温引起的田间水稻颖花不育具有重要意义。
1 水稻颖花结构和开花习性
水稻是单子叶模式植物,具有与双子叶植物不同的花序结构,小穗是水稻花序结构的基本单位[9](图1a)。典型的水稻小穗由1对副护颖、1对护颖、外稃、内稃、6枚雄蕊、1枚雌蕊和1对浆片组成,雄蕊包括花药和花丝,雌蕊包括子房和柱头[9-10](图1a、1b)。

图1 水稻颖花结构及籼、粳稻花时对比Fig. 1 The rice floret structure and the comparison of floret-opening-time between indica and japonica
水稻开花是一个非常复杂的过程,包括浆片膨大、外稃张开、花丝伸长、花药开裂、授粉受精和颖花闭合等事件[11-12]。一般而言,水稻抽穗后1~2 d就会开始开花,5~7 d全穗开完,第3天前后开花最盛[13]。大田群体颖花始花后,30~120 min盛花,75~165 min开完。有趣的是,不同水稻品种均遵循严格的颖花开放顺序:开颖时,主轴上的花先开,然后从上至下各个分枝依次开放;在一个枝梗上,顶端第1朵花最先开放,然后由基部向上顺序开放,顶端第2朵小花开放最迟,每朵花从开放到关闭约需1~2 h[14]。这种现象对判断花时性状表型具有重要的指导意义。
在水稻杂交制种过程中,由于遗传背景的差异,父母本的花时往往不一致。一般而言,恢复系(父本)开花较早且花时集中,晴天在上午10:30左右始花,11:00左右盛花,12:30左右开颖结束;而不育系开花较晚且花时分散,始花大概在11:30左右,12:00以后开花数量增加,17:00—18:00完成开颖,有些品种持续开花到晚上,没有明显的开颖高峰[6,13]。父母本花时不遇会造成异交结实率大大降低。花时不遇问题在籼粳亚种间杂交制种时更为突出,通常籼稻开花较早且持续时间长,粳稻开花相对较迟、开花分散且持续时间短。籼稻材料的盛花时间较粳稻早1~3 h[15],如图1c、1d所示。籼粳稻花时不遇限制了籼粳杂交制种的产量,是制约籼粳亚种间杂交稻强杂种优势的关键瓶颈之一[16]。
2 水稻颖花开放的结构基础
浆片是控制水稻开放和闭合最关键的器官。早在1675年,Malpighi就提出了浆片的概念,到了1881年,Häckel证实浆片在开花前快速吸水进而推开内外稃使得水稻颖花开放[17];随后学者开始对浆片的结构和功能进行研究。
浆片对称分布于内、外稃之间的子房基部,由大型薄壁细胞和分布均匀的小型维管束组成。靠近内稃部位的浆片细胞壁稍厚,壁不曲折,吸水后体积变化较小;而中部及外稃一侧的细胞壁薄而曲折,吸水后体积变化大。维管束中有一些较小的薄壁细胞,这些细胞富含线粒体,并且细胞间有胞间连丝。维管束与小穗轴相连,浆片可通过维管束从小穗轴快速吸水膨胀[18-20]。不育系浆片中的维管束数目少,缺少导管,花丝中无导管,细胞自溶慢,这可能是不育系开颖迟、闭颖慢,花丝伸长少及不易萎缩的主要原因[21]。
颖花开闭是浆片吸水膨大和失水萎缩的过程(图2a)。水稻的内外稃通过相互嵌合的钩合槽把花内器官封闭起来,浆片吸水膨胀后将外稃向外推开,同时将内稃向内压挤,使内外稃的钩合槽松开,外稃和内稃相互分开,这时雄蕊花丝急速伸长,使花药伸出颖壳并裂开,花粉散落,进行授粉(图2b、2c)。开完花之后,浆片细胞液泡膜破裂,发生细胞自溶,浆片中的水分和解体物经导管向小穗轴运输后失水,外稃在小穗轴的弹力下与内稃重逢,使得颖花重新闭合[18,20]
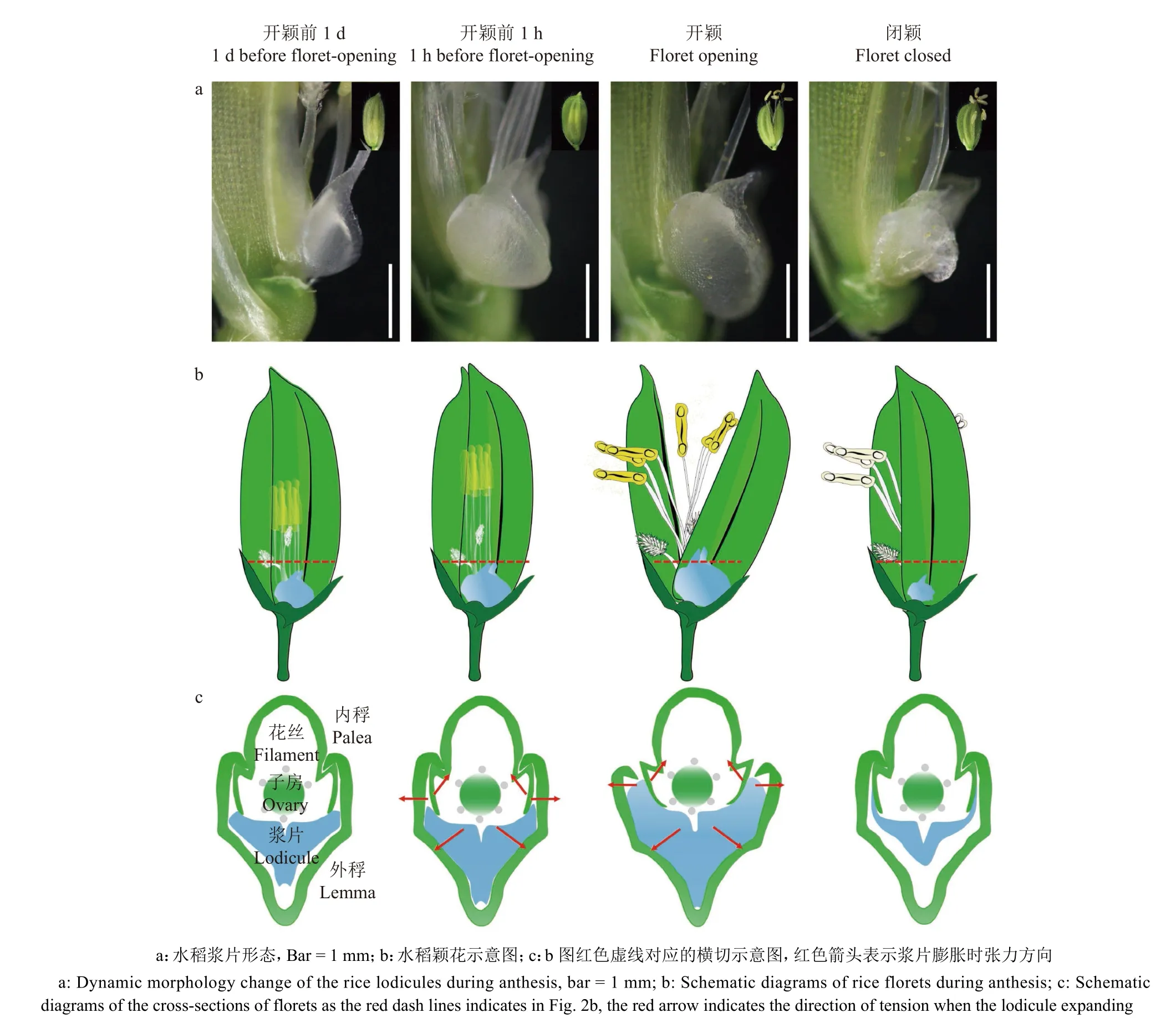
图2 水稻开花前后不同时间点浆片吸水膨胀与失水萎缩过程Fig. 2 The process of lodicule swelling and shrinking in rice before and after floret-opening
3 水稻颖花开放的生理基础
浆片能否吸水膨胀受到2方面因素的制约:一是浆片细胞的渗透势,只有渗透势低时,细胞才具有潜在的吸水能力;二是浆片细胞壁的松弛,只有细胞壁松弛,才能使细胞吸水后体积膨大[20]。其中,渗透势的变化推测主要是由于浆片内可溶性糖含量的上升引起的。王忠等[18]发现,开颖前浆片细胞中的淀粉在淀粉酶的作用下水解成可溶性糖,使细胞的渗透压增大,水势下降,但是开颖时可溶性糖的增加量远大于淀粉的减少量,说明开颖时可溶性糖的增加还包括其他多糖的水解和从其他器官的输入。薛欣艳[22]发现,临开花阶段,浆片细胞中与糖酵解有关的关键酶表达丰度显著上升,液泡酸性转化酶在临开花和开花后5~20 min出现,它催化蔗糖水解成葡萄糖和果糖,与糖酵解的各种中间产物一起降低细胞的渗透势。刘娟[23]发现1个早开花的突变体,测定浆片中可溶性糖含量,发现突变体和野生型开颖前后浆片中可溶性糖含量均有所增加,但是突变体浆片中的糖含量高于野生型,较多的可溶性糖可以增加细胞的渗透压以及提供更多的能力,进而使开花时间提前。
王忠等[18]研究测定了浆片中K+、Na+、Ca2+、Mg2+等离子在开颖前后的含量,发现这些离子在开颖前后含量并无明显变化,仅在开颖后浆片萎缩时才减少,并且用0.1 mol/L的K+、Na+、Ca2+、Mg2+等盐溶液浸穗,也没有发现明显的促进开颖作用,推测无机离子对浆片水势的变化没有明显作用。但是,也有研究支持浆片中K+、Ca2+等无机离子可能对浆片细胞渗透势的调节起着重要作用。Heslop-Harrison等[19]认为颖花开放前,浆片底部薄壁细胞中K+的积累使得渗透势降低,水分从小穗轴流入浆片。邹春梅等[24]也认为在水稻颖花开放过程中,浆片中K+含量上升。有意思的是,颖花开闭过程中浆片中Ca2+的分布和浓度呈现规律性的动态变化。在开花前,Ca2+主要集中在导管和细胞间隙中,临近开花时,浆片的薄壁细胞上富集了大量的Ca2+,而开花后Ca2+缓慢地向细胞内流动,说明浆片的膨胀也与Ca2+的流动有关[22]。Qin等[25]发现水稻颖花临近开放时,浆片中结合状态的Ca2+转变为游离状态,从细胞壁转移到细胞质中;开花后Ca2+又重新转移到细胞壁中,并转换成结合状态。利用Ca2+螯合剂EGTA固定Ca2+后,外源施加茉莉酸甲酯并不能促进水稻开花,表明Ca2+在调控水稻花时中可能起了重要的作用。探究K+、Ca2+等无机离子在水稻颖花开闭过程中的作用可为深入理解诱发该过程的原初反应和信号转导提供新视角。
在颖花开颖前1天或开颖前数小时,浆片细胞的液泡内溶质浓度很高,渗透势降低,细胞具有了很大的吸水潜力。然而,此时浆片并未充分吸水膨大,这是由于细胞壁还没有完全松弛,细胞的压力势大,限制了浆片细胞的充分吸水[20]。目前的研究提示CO2和一些细胞壁重塑相关酶在浆片细胞壁松弛过程中可能发挥重要作用。在正常情况下,一天中随着气温上升,颖花的呼吸作用增强,颖花内CO2浓度升高,浆片细胞中pH下降,细胞壁松弛[26]。另外,基因表达分析结果表明,颖花开闭过程中,许多编码葡聚糖酶、木葡聚糖转葡糖苷酶、多聚半乳糖醛酸酶、果胶酯酶等细胞壁重塑相关酶的基因表达发生显著变化,这些酶能够引起细胞壁的结构变化进而导致细胞壁松弛,细胞膨压下降[27-29]。渗透压上升和细胞壁松弛导致浆片细胞水势下降,在水通道蛋白的作用下,浆片细胞吸收水分迅速扩张,推开内外稃,颖花开放[30]。
4 水稻颖花开放调控机理
水稻花时是由多基因控制的复杂数量性状,受到各种环境因素、内部植物激素以及自身遗传基础的共同调控[12,31-32]。研究者们通过正向遗传学的方法定位到一些调控花时的数量性状基因座(Quantitative trait loci, QTLs),但目前尚未有调控花时性状的QTL被精细定位和克隆。近年来,通过多组学分析与反向遗传学相结合手段,相继克隆了一些控制水稻花时的重要基因,推动了水稻花时研究领域的发展。植物激素茉莉酸强烈诱导水稻颖花开放效应的发现,为研究水稻花时性状的内源信号调控机制提供了重要线索[32]。以下将系统总结调控水稻花时的QTLs与相关基因,重点阐述植物激素特别是茉莉酸调控水稻颖花开放的机理,并介绍水稻花时对外部环境(如温度、光照和CO2浓度等)变化的响应及其可能的机制,最后提出水稻颖花开放的调控网络。
4.1 调控水稻花时的遗传基础
4.1.1 调控花时的QTLs 自20世纪90年代起,中国科学家就开始了对水稻花时遗传机制的研究。仲维功等[15]发现籼稻品种‘NJTQ-2’的花时特性在江苏和海南表现相同;李金军等[33]对72份籼、粳不同品种在嘉兴和海南进行开花习性的比较,两地试验结果一致。这些观察表明不同水稻品种的花时特性受一定遗传基础制约且有一定的稳定性[15,33]。
为了探究调控花时的遗传机制,前人利用开花时间不同的水稻品种构建遗传群体,结合分子标记图谱,定位到一些控制花时性状的QTLs,详细信息见表1。马作斌等[7]用‘七山占’(09:30左右始花、11:00左右盛花)和‘秋光’(11:00左右始花、11:30左右盛花)2个亲本构建分离群体,定位到6个花时相关的QTLs。这2个亲本始花时间相差90 min,而盛花时间只相差30 min,因此定位到的QTLs效应都非常微小,来源于‘七山占’的qVFT-10仅能使‘秋光’的盛花时间提前10多分钟。万国等[35]采用的早花时粳稻品种‘WAB368-B-2-H2-HB’开花时间为9:30—10:00,晚花时粳稻品种‘六千辛’开花时间为11:00—11:30,亲本之间花时差异也不是特别大,因此定位到的QTLs贡献率也都比较低,这些单个的QTL都难以应用到生产实践。而Pham等[34]利用的亚洲野生稻‘W630’比粳稻‘日本晴’早开花2~3 h,定位到的QTLs效应相对较大,野生稻来源的SOTb和SOTm能够使‘日本晴’的花时提前30~60 min左右。药用稻Oryza officinalis是清晨06:00就开花的野生稻材料,O. officinalis来源的qEMF3能够使籼稻‘南京11’和‘IR24’的花时提前1.5~2.0 h[36]。

表1 花时QTLs的详细信息Table 1 The details of floret-opening-time QTLs
由此可见,亲本花时差异越大,定位到的QTLs效应也越大。亚洲栽培稻的不同品种之间虽然存在花时差异,但是大部分材料在08:00—09:00后开放,没有开花特别早的品种,且不同品种之间的花时差异最多也只有3~4 h;而不同野生稻每日开花时间差异很大,最早的05:00就开花,而最晚的22:30才开花[37-38]。因此,利用早开花的野生稻材料和晚开花的亚洲栽培稻材料构建群体,结合GWAS、转录组学、代谢组学等新技术手段,有望更快、更准确地定位到效应明显的早花时QTLs。
4.1.2 调控水稻颖花开放的基因 由于花时性状调查困难,遗传基础复杂,且受环境因素影响较大,目前从正向遗传学尚未克隆到影响花时的基因。浆片是控制水稻颖花开闭的关键器官,通过研究浆片的发育以及吸水膨胀和失水萎缩过程的调控机制,科学家们鉴定了一些调控水稻开花的基因,为深入理解水稻花时调控机理奠定了基础。浆片为特化的花器官,MADS转录因子对于花器官的发育起着重要作用。研究表明,基因OsMADS2、OsMADS4、OsMADS16参与调控水稻雄蕊和浆片的发育[39]。OsMADS16突变体又被称作superwoman1(spw1),spw1在营养生长时期与野生型无明显差异,但是在花器官发育过程中雄蕊和浆片分别转变为心皮和类似内稃的器官,最后导致颖花不能开放[40]。OsMADS2和OsMADS4在对浆片的调控中具有冗余作用,OsMADS2的RNA干扰材料浆片变小,颖花开放延迟;OsMADS4的RNA干扰材料浆片无明显变化,颖花可以正常开放;OsMADS2和OsMADS4的双RNA干扰材料表型类似于spw1,颖花不能开放[41-42]。
针对颖花开放和闭合过程中的浆片开展转录组分析,结合基因编辑技术,为快速鉴定水稻花时调控基因提供了有效的策略。付永琦等[29]以常规籼稻品种‘中早25’为材料,对水稻颖花开放前12 h和临开放前1 h的浆片进行转录组测序,通过比较2个时间点的差异表达基因的表达变化模式及其功能信息,发现参与调控碳水化合物代谢与运输、细胞能量代谢、细胞壁结构修饰以及茉莉酸等激素代谢与信号转导等生理过程的基因在颖花临开放前被强烈诱导或抑制表达,表明这些基因与浆片细胞吸水膨大调控水稻颖花开放密切相关。Wang等[43]利用开花前不同时间点的浆片转录组数据,筛选到1个在水稻浆片中高表达的基因DFOT1(Diurnal Flower Opening Time 1)。在‘中花11’中敲除DFOT1可以使开花时间提前2个多小时。DFOT1定位在细胞壁中,编码1个含DUF642结构域的蛋白,可以直接与果胶甲基酯酶(Pectin methylesterase,PME)基因家族基因PME40等相互作用,通过促进PMEs的活性降低水稻开花前浆片细胞壁中果胶的甲基酯化程度,使细胞壁变硬进而限制浆片细胞的吸水膨胀。DFOT1或PME40功能缺失则导致浆片细胞壁中果胶甲基酯酶活性下降,果胶甲基酯化程度升高,细胞壁软化,使得浆片细胞更容易吸水膨胀,促进颖花开放。Xu等[44]通过对‘宜香1B’进行EMS诱变,筛选出1个早花突变体emf1,能够使每日的开花时间提早约2.5 h,经过精细定位发现EMF1与Wang等[43]克隆的DFOT1为同一基因。EMF1能够与PMEs和葡聚糖酶(GLN2)互作从而影响浆片细胞壁中果胶和纤维素的合成。DFOT1/EMF1是首次报道直接调控水稻花时的基因,为水稻花时改良提供了很好的基因资源。这2个研究表明细胞壁结构的变化对于浆片吸水膨胀有着重要的作用,为后续水稻花时的研究提供重要借鉴。
4.2 植物激素对水稻颖花开放的调控
4.2.1 茉莉酸 植物激素对于水稻颖花的开闭具有重要作用,而茉莉酸(Jasmonic acid,JA)是目前研究最清楚且效果最为明显的激素。JA及其衍生物茉莉酸甲酯(Methyl jasmonate,MeJA)统称为茉莉酸类物质(Jasmonates,JAs),是广泛存在于植物体内的一种生长调节物质,参与植物生长发育调控、防御反应、开花时间调节及花发育进程等生物学过程[45]。关于JA的生物合成途径和信号转导目前已经有了较深入的研究(图3)[46],DAD1、AOC、AOS、OPR、LOX、ACX、JAR1等是JA生物合成中的重要基因,COI1、JAZs、MYC、MYB等是JA信号转导中的重要信号分子[47]。当植物受到外界环境刺激时,植物体内经过一系列酶促反应合成大量JA,在茉莉酸氨基酸合成酶JAR1的作用下形成具有高度生物活性的JA-Ile,JA-Ile特异性结合茉莉酸受体蛋白JAZ蛋白,JAZ的Jas结构域和ZIM结构域分别负责与上游的COI1或下游的转录因子结合,是JA途径的抑制因子[48-49]。在没有JA-Ile时,JAZ蛋白与下游转录因子互作,进而抑制转录因子对JA响应基因的激活作用;在JA-Ile含量增加时,JA-Ile与COI1结合,促进COI1与JAZ形成复合体,在E3泛素连接酶SCF-COI1复合物作用下使JAZ蛋白被泛素化标记,然后被26S蛋白酶体降解,从而解除JAZ对下游转录因子的抑制作用,启动JA响应基因的转录[50-52]。

图3 茉莉酸合成、信号转导及生物学功能[46]Fig. 3 Jasmonic acid synthesis, signal transduction and biological function
前人研究表明,外源施加MeJA/JA对水稻、小麦、黑麦等禾本科植物颖花开放有强烈的诱导作用,对雄性不育水稻的诱导效应更为明显[32,53-54]。邹春梅等[24]利用MeJA处理开花前几个小时的颖花,发现MeJA对浆片中淀粉酶活性上升、淀粉含量下降、可溶性糖和K+含量的上升具有明显的促进作用。内源JAs在水稻颖花器官中的分布具有组织和发育时期特异性,在水稻开颖前较平稳,开颖时急剧上升至峰值,闭颖后又下降[55]。水稻颖花开放前18 h,花器官中小穗梗JAs水平最高,内外稃次之,雄蕊、浆片和雌蕊极低;颖花开放时,雄蕊和浆片的JAs水平显著高于其他花器官,而小穗梗JAs含量最低。伴随颖花开放时浆片JAs水平的大幅上升,JAs生物合成相关基因OsDAD1、OsAOS1、OsAOC及OsOPR7以及JAs信号转导途径相关基因OsJAR1、OsCOI1b和13个OsJAZs的表达也明显上调[11]。水稻浆片转录组数据也显示JAs合成与信号转导基因在水稻开花过程中的浆片中均具有明显的差异表达[29]。一些参与JAs合成的基因突变后也会影响水稻颖花的开放及闭合。OsJAR1突变体开花散乱,一整天包括晚上都会零星开花,突变体的大部分花药不能正常开裂,并且开放后浆片仍然保持吸胀状态导致颖花不能正常闭合[56];OsOPR7基因突变后,突变体开花凌乱,开花后55.8%的颖花不能正常闭合[57];OsAOS1突变体颖花开放后不能正常闭合[58]。这些结果均表明JAs对于浆片的吸水膨大和失水萎缩具有至关重要的调控作用。
JAs信号可能调控籼粳稻花时差异。闫志强等[59]发现籼稻对MeJA调控的敏感性强于粳稻,籼稻不仅能够响应高浓度的MeJA(4 mmol·L-1)也能响应低浓度的MeJA(0.04 mmol·L-1),而粳稻只能响应较高浓度的MeJA(4、0.4 mmol·L-1)。籼稻对MeJA调控响应所需的时间较短,而粳稻对MeJA调控响应所需的时间较长。
JAs信号还可能参与水稻不育系花时的调控。一般而言,不育系材料比恢复系和保持系材料花时延迟,开花时间也分散,不利于水稻杂交制种[60]。Liu等[61]对比了细胞质雄性不育系‘珍汕97A’和其保持系‘珍汕97B’浆片中的JAs含量和含水量,发现不育系‘珍汕97A’由于JAs缺乏导致浆片内渗透调节物质和水分积累延缓,进而影响浆片吸水膨胀,颖花开放受到抑制,开花时间分散。通过对JAs合成途径中的重要基因进行定量分析,发现在‘珍汕97A’的浆片中JAs合成关键基因OsAOC的表达量明显低于‘珍汕97B’。至于不育系中JAs合成基因表达量下调的原因还有待进一步的研究。Yang等[8]研究发现,在光温敏核不育系面临花期高温胁迫时,通过外源施加JA和MeJA类物质进而增加浆片中JAs的浓度,可以提高浆片中过氧化氢酶和α-淀粉酶的活性以及抗坏血酸和可溶性糖的浓度,并显著降低浆片中的H2O2浓度,进而增加小穗的开颖率。上述研究进一步证明了JAs在水稻杂交育种中的重要作用。
4.2.2 其他激素 除了JAs,其他激素也能在一定程度上影响水稻花时。赤霉素类物质‘920’可以使花时提前,已经广泛用于生产实践[62],喷施油菜素内酯也可以使花时提前[63];但喷施乙烯和生长素(IAA)会延迟水稻花时[64-65]。另外,Huang等[66]发现外施IAA会抑制颖花闭合而外施脱落酸促进颖花闭合。Zhao等[67]发现IAA氧化酶基因DAO突变后不能将有活性的IAA氧化成无活性的OxIAA,破坏了体内IAA的动态平衡导致颖花不能开放且花药不开裂。进一步研究发现,在dao突变体浆片中IAA转录因子OsARF18表达上调,而OsARF2表达下调。OsARF18的过表达或OsARF2敲除材料与dao突变体的表型一样。OsARF18抑制OsARF2的表达,而OsARF2促进糖转运蛋白基因OsSUT1的表达,ARF18-ARF2-SUT1模块通过影响浆片中蔗糖的含量调控颖花开放[68]。在dao突变体的花药中JAs含量显著降低,暗示IAA和JA在调控颖花开放和花药开裂过程存在相互作用[67]。水杨酸对MeJA诱导的颖花开放具有显著的抑制作用,这种抑制可以被MeJA的再处理逆转[14]。这些研究表明JAs信号可能通过与其他植物激素信号通路之间的交叉互作共同调控水稻花时,揭示激素间如何互作调控水稻花时的信号网络将是未来水稻花时性状的研究重点。
4.3 影响水稻颖花开放的外部因素
水稻颖花的开放受到多种外部因素的调控,包括光照、CO2浓度、温度变化、机械摩擦、风力、湿度等,目前认为影响花时最主要的因素是温度,其次是光照和CO2[12,69-70]。
4.3.1 温度 水稻颖花开放时对外界温度非常敏感,温度过高或过低均会严重影响水稻生殖发育。在自然条件下,气温高时开花多且迅速,气温低时开花延迟或者不开花。早中稻一般在09:00左右开始开花,而晚稻要接近中午才开始开花。阴雨天气温度降低时开花明显延迟,而天气转晴温度升高时会有大量颖花开放[71]。这种快速响应温度变化的开花习性将更好地确保水稻成功繁殖。将稻穗先浸于冷水(0~10 ℃)后置于室温(25~30 ℃)或用温水(35~45 ℃)浸穗均能促进开颖;在42~43 ℃水中浸穗0.5~1.0 min,10 min后开颖,裂药良好,花粉活力正常。不同气温处理对开颖的效应也类似于水温的处理,0~20 ℃的低温抑制开颖,高温处理或低温处理后置于室温,只要是增温就可促进开颖[71]。Jagadish等[72]发现当环境温度从30 ℃增加至38 ℃时,水稻IR64的盛花时间约提早30 min。这些结果一致表明温度上升能够明显促进开花。温度同时也影响颖花关闭。黄友明等[60]发现35~40 ℃最适于颖花关闭,高于45 ℃或低于20 ℃对颖花关闭均不利,不同温度处理对水稻颖花关闭影响差异非常明显。另外,籼粳稻响应外界温度的变化也不一样,随着温度的上升,籼稻花时提早较粳稻明显(未发表结果)。但是,目前尚未有关于水稻花时响应温度变化调控机理的研究,籼粳稻不同温度响应特性的遗传基础也完全不清楚。
4.3.2 光照 光照强度的变化和光照时间的长短对于水稻花时也有影响。Kobayasi等[12]发现在开花前太阳辐射增强可以使花时提前。蒯建敏等[70]认为增加温度或者日照时数对籼粳稻都有提早开花的作用。Biswas等[73]利用γ射线辐射的方式得到1个光形态建成受损的水稻突变体cpm1,cpm1在白光下表现为长胚芽鞘表型,且突变体抽穗后花时零散、花丝伸长,与颖花开放不同步。有趣的是,Nishiyama等[74]发现开花前将水稻进行1 h的黑暗处理能够使花时明显提前,而对水稻进行持续的光照处理时,会导致花时紊乱、分散或整日开花。同样,顾蕴洁等[75]也发现黑暗中的稻穗受到光照处理时不会开花,而将水稻从光照条件下转移至黑暗条件下能够促进开花。这些结果说明水稻开花习性受光信号调控。植物自身节律与光照息息相关,大部分水稻在一天中特定的时间段开花,说明开花也是植物有节律性的运动之一。将开花前的水稻进行短时间的遮光处理可以明显促进开花,长时间的光照又会使得水稻开花紊乱,是否是由于光照与黑暗的变化使得水稻颖花中具有节律性表达的基因受到了影响,进而引起开花时间的变化,值得进一步的研究。
4.3.3 CO2浓度 CO2能有效诱导水稻浆片吸水、加快颖花开放,且对小麦、黑麦、燕麦、玉米等禾本科植物的开花都有明显的促进效应[76]。王忠等[26]发现体积分数≥5%的CO2气体、pH≤5.6的CO2水溶液能显著促进开颖;而N2、呼吸抑制剂NaN3和KCN等能够抑制呼吸作用,导致颖花CO2浓度降低,进而抑制颖花开放。据此,王忠等[26]认为颖花因呼吸增强而积累的CO2是促进浆片膨大的主要因素,并推测CO2可能通过降低细胞pH,促使细胞壁松弛。许祥明等[77]还发现体积分数1%左右的甲酸、乙酸、丙酸等有机酸溶液也能显著促进水稻开颖,与CO2的作用机制一样,通过降低细胞pH促使细胞壁松弛。也有研究认为CO2可能通过提高颖花温度进而促进颖花开放[78]。由于CO2处理对花丝伸长、裂药、花粉活力和柱头活力均无影响,因此,CO2调节开颖的技术可以应用于水稻杂交制种[79]。
基于以上研究结果,我们推测在水稻颖花成熟时,外界环境因素的改变、其他植物激素合成或信号转导的变化以及浆片中的JA合成基因表达量增加等因素使得浆片中的JAs含量上升,OsJAR1表达量上调促进JA信号的转导,进一步通过MYCs/MYBs转录因子激活下游JA响应基因的表达,影响浆片内碳水化合物的代谢与转运以及细胞壁的结构的变化,最终导致浆片渗透势降低、细胞壁松弛,浆片吸水膨胀,颖花开放(图4)。

图4 水稻颖花开放的调控模型Fig. 4 The regulatory model of floret opening in rice
5 展望
颖花开闭是水稻生殖发育过程中的关键生物学事件,合适的开花时间对水稻成功繁育后代至关重要[43]。为了保证最大的繁殖成功率,水稻进化出一套精密的内部调控机制以适应外部环境(温度、光照、湿度、CO2浓度等)的变化。因此,研究水稻花时性状的调控机理对于理解植物的适应性进化具有重要的理论意义。目前关于水稻花时性状的研究进展较为缓慢,仅有JA信号通路和少数基因被证实参与调控,其遗传调控网络还很不清楚。为了全面阐明水稻花时的调控网络,今后应该综合利用遗传学手段、多组学手段以及基因编辑技术等,规模化克隆花时调控基因,在此基础上,重点阐明JA与其他激素间交叉互作调控水稻花时的信号网络,以及水稻快速响应外部环境变化的开花习性的分子机理。
水稻花时对水稻生产也具有重要意义。开花时的温度>35 ℃会导致水稻小穗不育[36]。早季种植的水稻大多在6—8月份抽穗扬花,随着全球气候变暖,夏季气温越来越高,一些开花时间晚的品种开花时极易遭受高温胁迫,导致花粉不育,产量降低。让水稻提早开花能够规避高温引起的育性降低。野生稻不同品种间开花时间差异明显,是研究花时的优良材料,其中,早开花的野生稻也可作为培育早花时品种的种质资源。野生稻O. officinalis在06:00开花,Ishimaru等[80]将O.officinalis的早花时QTL(Early morning flowering,EMF)导入到栽培稻‘越光’中可以使‘越光’的花时至少提前1 h,并且在温室里进行高温模拟处理时,导入EMF的‘越光’在10:00前完成开花,不育的小穗仅有14.3%,而野生型‘越光’在处理温度最高的11:00—13:00开花,不育的小穗有49.6%。因此,提早水稻开花是应对水稻高温胁迫、提高育性的有效策略[36]。
利用籼粳亚种间杂种优势是提高水稻产量的重要手段,但由于籼粳亚种间开花习性存在较大差异,制种产量低,种子成本大幅上升,影响其推广速度与面积[81]。虽然通过一些化学调控和农艺措施可以在一定程度上促进父母本花时相遇,但是这些手段费时费力,难以应用于大田制种。通过研究籼粳稻花时的遗传规律,找到调控籼粳稻花时差异的关键基因,培育早花时的粳稻或者花时推迟的籼稻品种是解决花时不遇的根本途径。但是,目前克隆的调控花时的基因极少,对于花时遗传调控机理的解析需要研究策略上的创新。浆片是控制水稻开花的关键结构,以浆片作为研究对象可能是挖掘花时基因的一个突破口。Wang等[43]在浆片转录组基础上筛选并克隆了第1个花时基因DFOT1,在籼稻常规品种、粳稻常规品种和不育系中编辑DFOT1都可以提早开花,同时结合生产主栽品种进行单倍型分析,鉴定了籼稻早花的DFOT1单倍型,携带早花DFOT1单倍型的品种可以作为特异种质或杂交亲本应用于杂交制种。利用开花过程中籼粳稻不同时间点浆片的转录组及代谢组分析,有望鉴定出调控籼粳稻花时差异的关键基因和物质,结合遗传学、分子生物学和细胞学等手段,进一步解析调控籼粳稻花时差异的分子网络,并筛选出早花时基因的优良单倍型应用于水稻育种。

