水稻内源油菜素甾醇对施氮量的响应及其对颖花退化的调控作用
姚佳瑜 于吉祥 王志琴 刘立军 周 娟 张伟杨,*杨建昌,*
1江苏省作物遗传生理重点实验室 / 江苏省作物栽培生理重点实验室 / 扬州大学农学院, 江苏扬州225009; 2江苏省粮食作物现代产业技术协同创新中心 / 扬州大学, 江苏扬州225009
水稻是世界上最重要的粮食作物之一, 全球约有50%以上的人口以稻米为主食[1-2]。为保障粮食安全, 我国一直将提高单位面积水稻产量作为稻作技术的一个重要目标[3-4]。每穗颖花数是决定水稻产量的重要因素之一, 且具有较大的变异性和可调性。因此, 增加每穗颖花数是提高水稻产量的重要途径[5-8]。然而, 颖花退化现象在水稻生产中普遍存在,尤其是现代培育的一些大穗型品种的颖花退化率更为严重, 严重制约水稻产量潜力的发挥[7]。因此, 如何减少颖花退化既是重要的科学问题, 也是高产技术栽培实践需要经常面对的重要技术问题[7-8]。多年来, 国内外学者从农艺学、生理学和遗传学等方面对水稻颖花退化现象进行了大量研究[9-12], 但其机制仍不清楚。
油菜素甾醇(brassinosteroids, BRs)是继生长素、赤霉素、细胞分裂素、脱落酸和乙烯之后发现的第六大类植物激素, 主要由油菜素内酯(brassinolid,BL)和油菜素甾酮(castasterone, CS)及其衍生物组成,普遍存在于植物界, 广泛参与调节植物的生长发育过程[13-15]。BRs应用在农业上, 可以增加作物生长发育速度及种子活力, 促进水稻等作物分蘖、增加营养体收获量, 提高坐果率, 促进果实肥大, 提高结实率, 提高籽粒质量, 增强作物抵抗生物和非生物胁迫等[13-15]。当植物缺乏 BRs时, 会造成植株矮小、种子数减少并且大量不育、粒重变小[15-21]。水稻颖花发育状况既受基因(内因)控制, 也受营养因素等外因调节。在所有营养因素中, 氮素是影响作物产量的最重要因素之一, 合理的氮肥运筹可以减少颖花退化[6,22]。但关于水稻内源BRs是否以及如何对施氮量作出响应, 进而调控颖花退化?目前尚不清楚。
与所有需氧有机体一样, 植物在正常呼吸、光合作用、固氮和环境胁迫应激反应等代谢过程中均会产生活性氧物质(reactive oxygen species, ROS),其过量积累通常会引起氧化胁迫, 从而造成细胞受损甚至死亡, 如过氧化氢(H2O2)过量积累会破坏细胞膜完整性而导致细胞程序性死亡(programmed cell death, PCD), 该过程和水稻颖花退化和败育密切相关[9-10,23]。此外, 众多的研究表明, BRs可以激活抗氧化系统活性进而增强植物的抗逆性[10,23]。BRs是否以通过调控ROS的水平来介导施氮量对水稻颖花退化的影响?研究报道甚少。鉴此, 本研究较为系统地观察了在不同施氮量条件下水稻减数分裂期幼穗中内源BRs含量和ROS的变化特点及其与颖花退化的关系, 旨在阐明水稻内源 BRs对施氮量的响应特点及其对颖花退化的调控作用。
1 材料与方法
1.1 材料和栽培概况
试验于2015年和2016年水稻生长季(5月至10月)在扬州大学江苏省作物栽培生理重点实验室实验农场开展。供试品种为当地生产中广泛应用且颖花退化率不同的2个水稻品种: 常规籼稻品种扬稻6号(YD-6)和籼-粳杂交超级稻品种甬优 2640(YY-2640)。在当地生产中, YD-6的每穗颖花数通常在 160~190之间, YY-2640的每穗颖花数通常在250以上(全生育期施纯氮240~300 kg hm-2)。5月11日至12日大田播种育秧, 30 d秧龄移栽于盆钵(高 30 cm, 直径25 cm, 容积14.72 L), 内装过筛大田表层沙壤土, 含有机质 2.02%, 碱解氮101.5 mg kg-1, 速效磷含量为34.2 mg kg-1, 速效钾含量为68.1 mg kg-1。田间管理同当地高产栽培技术进行。各品种在8月10日至15日开始抽穗, 于10月5日至6日收获。
1.2 实验设计
每个品种分别设置 3个施氮水平: 每盆施尿素低氮2 g (low amount of nitrogen application, LN)、中氮4 g (moderate amount of nitrogen application, MN)和高氮6 g (high amount of nitrogen application, HN),按照基肥(移栽前1 d) 40%: 分蘖肥(移栽后7 d) 20%:促花肥(穗分化始期) 20%: 保花肥(颖花分化期)20%施用。播种前一次性施过磷酸钙(含P2O513.5%)折合纯磷0.42 g每盆和氯化钾(含K2O 52%)折合纯钾0.42 g每盆。每个处理80盆。根据剑叶与倒二叶的叶耳间距和幼穗镜检相结合的方法来判断幼穗的分化阶段[24-25]。
1.3 取样与测定
在分蘖早期每个处理选择长势一致的主茎 400个, 挂上纸牌。于花粉母细胞减数分裂盛期(剑叶与倒二叶的叶耳间距为零时[24-25]) (颖花退化主要发生在该时期[6,10]), 取各处理 50个长势一致的, 挂牌主茎幼穗并逐一检查穗分化阶段, 用于测定幼穗中氮含量、BRs含量、H2O2含量和总抗氧化能力(T-AOC)水平。当90%的穗抽出时, 各处理取100个, 挂牌主茎穗考查每穗颖花现存数和退化数(白化萎缩的颖花为退化颖花)。颖花分化数为其现存数和退化数的总和。
颖花退化率(%) = 颖花退化数/颖花分化数×100
成熟期收获完整的10盆, 考查每盆穗数、每穗颖花数、结实率和千粒重; 另外, 收获完整的10盆用于考查实产。
1.4 稻穗含氮量测定
将在花粉母细胞减数分裂期盛期所取的稻穗烘干后粉碎过筛, 用FOSS公司的Kjeltec 8400全自动凯氏定氮仪测定稻穗含氮量。
1.5 油菜素甾醇(BRs)的提取与测定
稻穗中内源 BRs的提取与纯化参照 Ding等[26]的方法, 略作改进: 4~6 g鲜样组织用液氮冷冻, 用研钵磨成细粉, 0.5~0.8 g粉末转移到一个10 mL离心管内, 加乙腈(5 mL g-1)提取, -20°C冰箱中保存一夜待用。乙腈提取的样品在4°C, 10,000 r min-1下离心10 min。收集上清液, 剩余残渣用1 mL乙腈再次提取, 合并两部分上清液, 在温和的氮气流中蒸干浓缩备用。根据Chen等[27]报道的方法, 进行萃取、脱水和双层固相萃取(DL/SPE), 收集萃取液并在温和的氮气流中蒸干浓缩。采用液质联用仪(LC-MS/MS, TSQ Vantage, Thermo Fisher Scientific,Waltham, MA, USA)的多级反应模式(MRM)下进行测定与分析。前人报道, 24-表油菜素甾酮(24-epicastasterone, 24-epiCS)和 28-高油菜素内酯(28-homobrassinolide, 28-homoBL)是水稻体内高生物活性且重要的 BRs[6,10,28], 因此本研究主要测定 24-epiCS和28-homoBL, 以pmol g-1DW (干重)表示其含量。
1.6 总抗氧化能力(T-AOC)和过氧化氢(H2O2)含量的测定
稻穗中T-AOC水平的测定, 参照T-AOC试剂盒生产商(苏州科铭生物技术有限公司)制定的方法进行测定与分析, 单位以U g-1DW表示。H2O2含量测定采用Rao等[29]报道的方法, 单位以μmol g-1DW表示。
1.7 化学调控物质处理
供试品种为扬稻6号和甬优2640, 栽培方法与生长条件同MN处理(2016年), 120盆重复。在分蘖早期将所有主茎挂上纸牌, 在花粉母细胞减数分裂前期(剑叶的叶耳低于倒二叶的叶耳5 cm时)用1 mL注射器(针孔直径0.33 mm, 美国BD公司生产)往长势一致的主茎幼穗中分别注射10 nmol L-124-epiCS(T1), 10 nmol L-128-homoBL (T2), 10 nmol L-1brassinazole (BRZ, 芸薹素唑, BRs合成抑制剂) (T3),10 nmol L-124-epiCS + 10 nmol L-1BRZ (T4)。喷施的所有溶液中均含有0.1% (v/v)的乙醇和0.01% (v/v)Tween 20作为展开剂, 用含有 0.1% (v/v)的乙醇和0.01% (v/v) Tween 20的清水作为对照(CK)。每茎注射0.5 mL, 每处理120茎。为保证注射效果, 连续处理4 d, 注射操作对幼穗未见明显伤害。在花粉母细胞减数分裂盛期, 每处理取40个幼穗并逐一检查穗分化阶段, 用于测定 BRs含量、T-AOC水平和H2O2含量; 抽穗期取 40个稻穗考察颖花分化与退化状况; 成熟期取 40个稻穗考察单穗产量构成因素, 测定方法同上述。
1.8 数据处理与计算方法
数据用Microsoft Excel 2010、SPSS 16.0和SAS(version 9.2, SAS Institute), 进行统计分析, 用P=0.05最小显著极差法(LSD0.05)进行平均数显著性检验。
2 结果与分析
2.1 颖花发育与产量
施氮量对颖花发育与产量的影响因品种而异。随着施氮量的增加, 甬优2640的颖花分化数和每穗颖花数显著增加, 颖花退化率显著降低。扬稻 6号在LN处理下颖花分化数和每穗颖花数最少, 在MN处理下最多; 颖花退化率在MN处理下最低, 在HN处理下最高(表1)。两品种的产量在处理间的变化均表现为: MN处理的最高, LN处理的最低; HN处理的产量低于MN处理的重要原因是结实率和千粒重的降低。2年结果趋势相同(表1)。
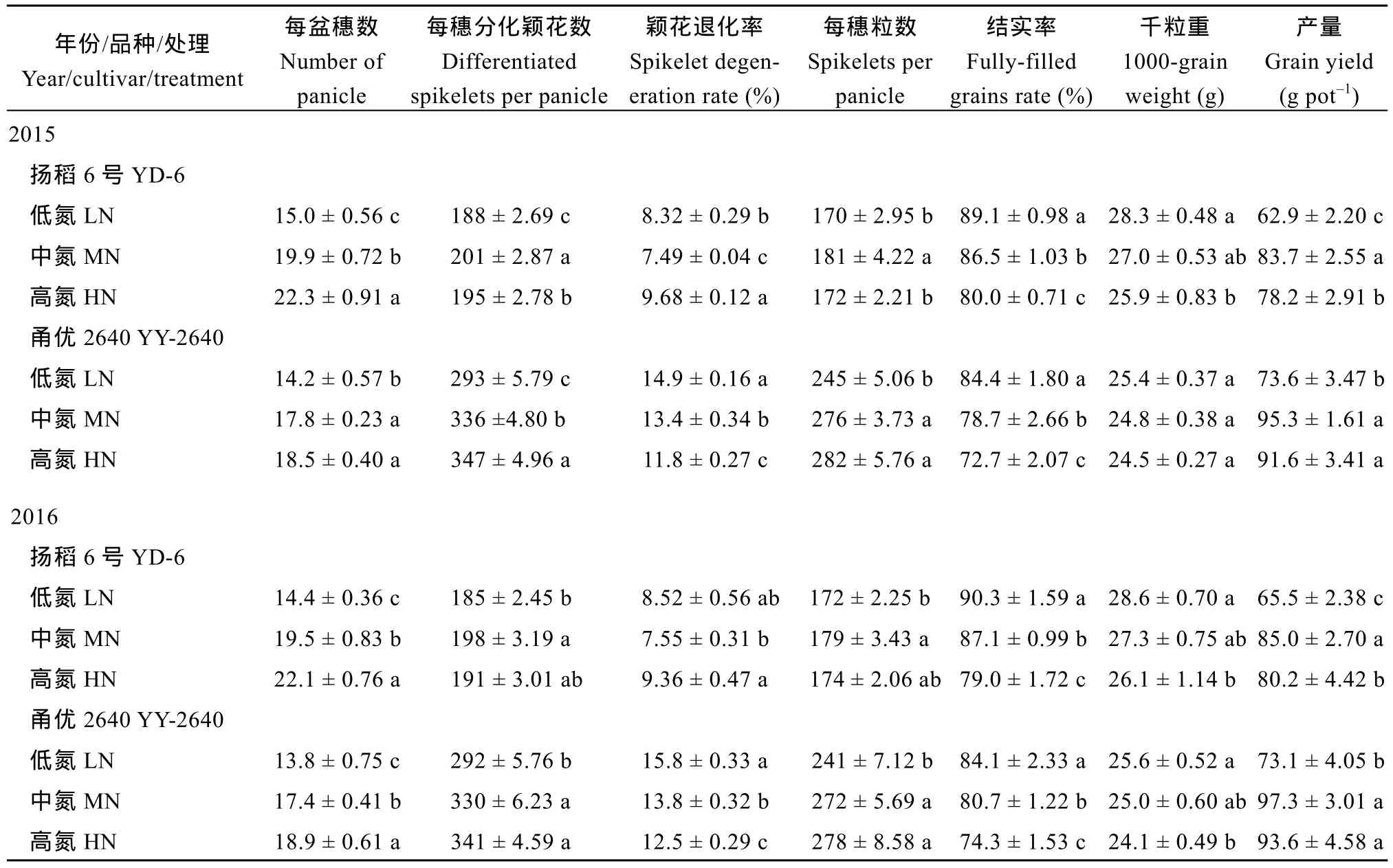
表1 不同施氮量处理对水稻颖花发育、产量和产量构成因素的影响Table 1 Effects of different nitrogen rates on spikelet development, grain yield and yield components in rice
2.2 稻穗含氮量和BRs含量
2个品种减数分裂期稻穗含氮量均随着施氮量的增加明显增加(图1-A, B)。减数分裂期稻穗中BRs(24-epiCS和 28-homoBL)的含量在处理间的变化因施氮量和品种的不同而异。甬优 2640幼穗中24-epiCS和28-homoBL的含量随施氮量的提高而显著增加。扬稻6号幼穗中的24-epiCS和28-homoBL含量均在HN处理下最低, 在MN处理下最高(图2-A~D)。相同氮处理下, 扬稻 6号的稻穗含氮量和 BRs含量均明显高于甬优2640 (图1-A, B和图2-A~D)。
2.3 稻穗中T-AOC水平和H2O2含量
减数分裂期稻穗中T-AOC水平在处理间的变化与BRs (24-epiCS和28-homoBL)的含量变化一致。扬稻6号幼穗中的T-AOC水平在HN处理下最低,在MN处理下最高, 甬优2640幼穗中的T-AOC水平随施氮量的增加而显著提高(图3-A, B)。与之相反的是, 扬稻6号幼穗中的H2O2含量在MN处理下最低, HN处理下最高(图3-C, D), 而甬优2640幼穗中的H2O2含量随施氮量的增加而显著降低(图3-C, D)。相同氮处理下, 扬稻6号的稻穗中T-AOC水平显著高于甬优2640稻穗中的含量, 而扬稻6号的稻穗中H2O2含量显著低于甬优2640稻穗中的含量(图3-A~D)。
2.4 相关分析
减数分裂期稻穗中 BRs (24-epiCS和28-homoBL)含量和 T-AOC水平均与稻穗含氮量呈开口向下的二次曲线函数关系:C=-59.5+152x-62.1x2, B = -146+338x-137x2和T=-137+332x-138x2(C代表24-epiCS含量,B代表28-homoBL含量,T代表T-AOC,x代表稻穗含氮量;R2= 0.666*~0.758**) (图4-A~C)。稻穗中 H2O2含量和颖花退化率均与稻穗含氮量呈开口向上的二次曲线函数H= 59.7-83.9x+34.3x2和S= 41.5-52.4x+20.6x2(H代表H2O2含量,S代表颖花退化率;R2=0.746**~0.831**) (图4-D, E)。此外, 稻穗中 T-AOC水平与BRs (24-epiCS和28-homoBL)含量显著正相关(r= 0.974**~0.982**), 而稻穗中H2O2含量和颖花退化率均与BRs (24-epiCS和28-homoBL)含量显著负相关(r= -0.956**~ -0.978**) (图5-A~F)。
2.5 外源化学调控物质对颖花退化的影响
与对照(CK)相比, 在减数分裂前期对稻穗施用外源BRs (24-epiCS或28-homoBL)处理, 可显著增加幼穗中内源BRs (24-epiCS或28-homoBL)含量和T-AOC水平, 显著减少幼穗中H2O2含量, 使颖花退化率显著降低, 每穗颖花数和结实率均显著增加。施用BRZ (BRs合成抑制剂)则效果相反, 即幼穗中内源BRs (24-epiCS或28-homoBL)含量和T-AOC水平显著降低, 幼穗中 H2O2含量大幅增加, 颖花退化率显著增加, 每穗颖花数和结实率均显著降低。当BRZ联合 24-epiCS一起施用, 则可有效解除 BRZ对颖花发育与产量形成的抑制作用。外源化学调控物质处理对粒重影响较小(表2和表3)。
3 讨论
通常认为, 水稻每穗粒数与穗发育期植株含氮量呈线性正相关; 在水稻穗发育期施用氮肥能够显著影响颖花发育, 有效增加每穗颖花数[22,31-32]。因此,在水稻生产中通过施用氮素穗肥, 以增加每穗颖花数进而提高产量[33-34]。本研究观察到, 施氮量对降低颖花退化率的作用因水稻品种的类型差异而不同。对于每穗颖花分化数较少的品种扬稻6号而言,与LN或MN处理相比, HN处理下会显著增加颖花退化率, 而对于每穗颖花分化数较多的品种甬优2640而言, 与LN或MN处理相比, HN处理下能有效降低颖花退化率(表1)。这些结果表明, 颖花分化数较多的水稻品种可能比每穗颖花数较少的品种需要更高的氮素供应, 以减少颖花退化, 但施氮量过高, 特别是对颖花分化数较少的品种, 可能会增加水稻颖花退化。
不同穗型的水稻品种的颖花退化率对施氮量响应差异的机制尚不清楚。已有研究表明, BRs在增加水稻颖花数量方面起着重要作用[6,10,35]。本研究观察到, 不同施氮量可以调控减数分裂期稻穗中 BRs(24-epiCS和28-homoBL)含量, 且BRs (24-epiCS和28-homoBL)含量与颖花退化率显著负相关(图2-A~D 和图5-E, F)。当外源 BRs (24-epiCS或28-homoBL)施用于减数分裂期时期的稻穗, 可显著增加稻穗内源BRs (24-epiCS和28-homoBL)含量、有效减少颖花退化率, 显著提高每穗粒数和产量。当施用BRZ (BRs合成抑制剂)则效果相反, 且施用外源24-epiCS可有效解除 BRZ对颖花发育与产量形成的抑制作用(表2和表3)。这些结果表明, 在水稻幼穗发育期合理施用氮肥可有效提高稻穗中 BRs含量, 进而显著减少水稻颖花退化。
本研究观察到颖花退化率和稻穗中 BRs(24-epiCS和 28-homoBL)含量显著负相关, 且它们均与稻穗含氮量呈二次多项式关系, 说明减数分裂期穗中 BRs含量越高, 颖花退化率越低; 当减数分裂期稻穗的含氮量为1.25%时, BRs含量最高, 颖花退化率最低(图4-A, B, E; 图5-E, F)。这在一定程度上解释了为什么与LN或MN相比, HN处理会使每穗颖花数较少的品种扬稻6号的颖花退化率明显增加, 主要因为幼穗中过高的氮含量可能会降低 BRs(24-epiCS或 28-homoBL)含量; 但大穗型水稻品种甬优 2640相对较大的生物量会对植株的氮素含量起稀释作用, 因而在 HN条件下稻穗中的氮含量仍然相对适宜, 进而增加稻穗 BRs含量, 减少颖花退化。这些结果表明, 水稻减数分裂期1.25%的稻穗含氮量可作为氮肥施用的一个重要标准, 可有效提高幼穗 BRs水平, 减少颖花退化, 进而提高水稻库容与产量潜力。
关于BRs调控水稻颖花退化的机制, 以往的相关研究甚少。前人报道, 发育稻穗中产生或积累过多的 H2O2可以通过激发水稻幼穗中细胞凋亡相关基因的表达来诱导PCD, 进而导致颖花退化[10,23,36-37]。本研究观察到, 稻穗中的 H2O2含量与BRs (24-epiCS和 28-homoBL)含量显著负相关, 与颖花退化率显著正相关, 而幼穗中 T-AOC水平与H2O2含量变化趋势相反(图5-A~F)。对减数分裂期的稻穗外源施用BRs (24-epiCS或28-homoBL)可显著提高稻穗中T-AOC水平, 降低H2O2含量, 进而降低颖花退化率, 增加每穗颖花数, 而施用 BRs合成抑制剂的效果则相反(表2和表3)。这些结果表明,适量施用氮肥或使减数分裂期稻穗含氮量为 1.25%时, 可以有效提高稻穗中 BRs含量, 增强抗氧化能力, 减轻减数分裂期间 ROS的对颖花细胞的伤害,保护分化的颖花免于退化。
值得注意的是, 在本研究中观察到颖花退化率在品种间的差异大于氮肥处理间的差异(扬稻6号和甬优 2640在氮肥处理间的颖花退化率分别介于7.49%~9.68%和11.8%~15.8%) (表1), 这一方面表明水稻颖花退化状况在很大程度上受内在遗传力(内因)的控制, 另一方面也说明氮素等外界营养因素(外因)在调控水稻颖花退化过程中也发挥着重要作用。本研究中颖花退化率在氮肥处理间差异较小的重要原因可能是由于在氮肥处理中不仅保花肥的施用量不同, 前期的基肥、分蘖肥、促花肥的施用量均不同, 这导致不同的氮肥处理的有效穗数、分化颖花数也相差很大, 从而“稀释”了保花肥本身的效应。此外, 在减数分裂期扬稻6号幼穗中的BRs含量显著高于甬优2640幼穗中的含量, 在同等施氮量的条件下这一现象尤为明显, 这与两品种间颖花退化率的差异状况相反(表1和图2-A~D)。从另一个方面证明了BRs对水稻颖花退化的调控作用。表明稻穗中具有较高的BRs水平可以作为减少水稻颖花退化的一项重要生理指标, 通过品种选育或合理的栽培措施增加稻穗的 BRs生物合成与积累, 可有效减少水稻颖花退化。这一发现对认识水稻颖花退化机制、减少水稻颖花退化, 提高库容和产量潜力均具有重要意义。BRs介导施氮量对水稻颖花退化的遗传与分子机制值得进一步深入探究。
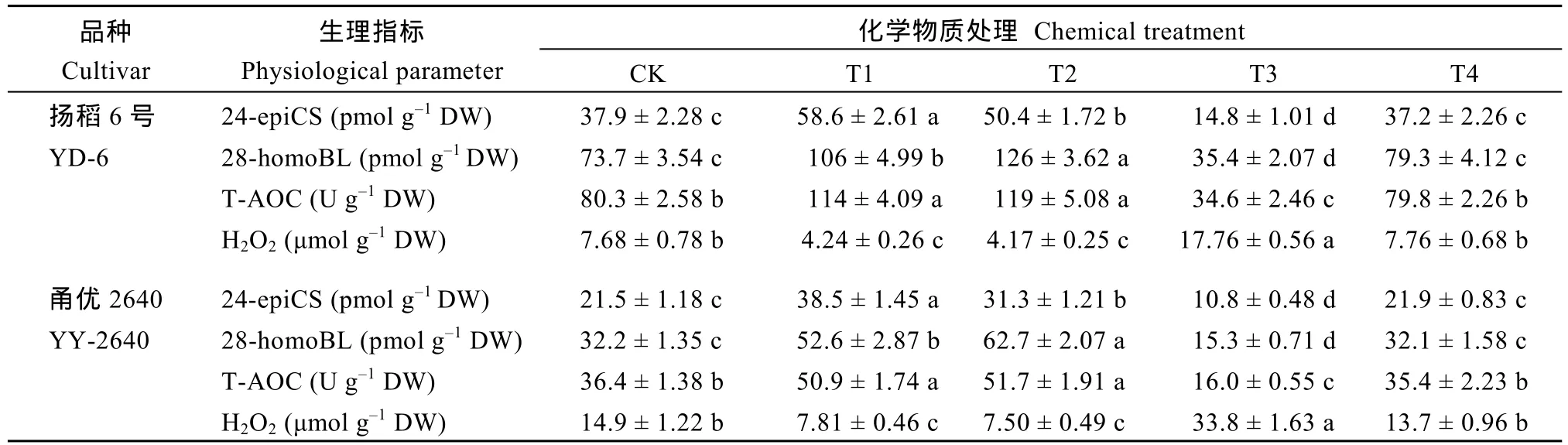
表2 外源化学调控物质对稻穗中油菜素甾醇(BRs)、总抗氧化能力(T-AOC)和过氧化氢(H2O2)水平的影响Table 2 Effects of chemical applications on the levels of brassinosteroids (BRs), hydrogen peroxide (H2O2), and total antioxidant capacity (T-AOC) of young panicles in rice
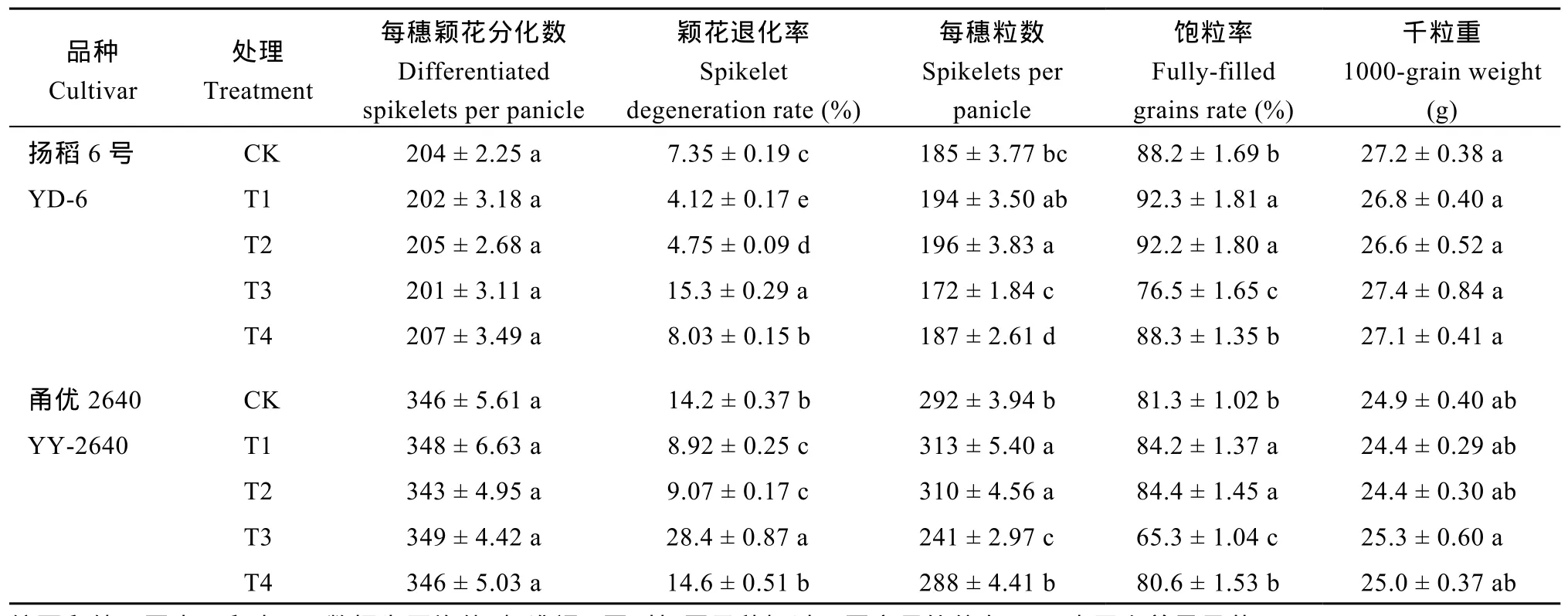
表3 外源化学调控物质对水稻颖花分化与退化、每穗粒数、饱粒率和粒重的影响Table 3 Effects of applied chemical regulators on spikelet differentiation and degeneration, spikelet number per panicle, fully filled grains, and grain weight in rice
4 结论
增加水稻减数分裂期幼穗中的BRs含量可以有效降低颖花退化率。穗型较大的水稻品种比穗型较小的品种需要施用更多的氮肥以增加减数分裂期幼穗中 BRs水平, 进而有效减少颖花退化。但氮肥施用量过多导致减数分裂期稻穗含氮量过高会不利于幼穗中 BRs含量的增加, 进而增加颖花退化。当水稻减数分裂期幼穗含氮量为 1.25%时, 可有效提高水稻幼穗中的 BRs水平, 从而减少颖花退化。BRs通过调节减数分裂期稻穗的抗氧化能力介导不同施氮量对水稻颖花退化的影响。

