合成硒代谷胱甘肽酿酒酵母菌株的筛选与发酵优化
何家伟,蔡俊
(发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,工业微生物湖北省重点实验室,湖北工业大学,湖北 武汉 430068)
硒是动植物必须的营养元素[1]。含硒化合物是癌症治疗中的抗氧化剂和化学预防剂[2-5]。
在富硒酿酒酵母菌体内存在多种有机硒,其中包括一种具有补硒、抗癌潜力的硒肽物质—硒代谷胱甘肽[6]。硒代谷胱甘肽(selenogutathione,GSeH)由 L-谷氨酸、L-硒代半胱氨酸(L-selenocysteine,Sec)和甘氨酸经肽键脱水缩合而成,是一种在生物体中含量很低的非蛋白类硒基化合物,通常分布于各种富硒植物和富硒菌体中[7-8]。GSeH的高抗氧化能力取决于其合成前体Sec。Sec被证明是各种重要抗氧化硒酶中的关键氨基酸[9-15],这些硒酶通过活性位点处的Sec残基有效减少了过氧化物[16]。在氧化应激条件下,自由基物种对蛋白质和其他大分子的氧化可被抗氧化剂化合物调节[17]。谷胱甘肽修复溶菌酶中的色氨酸自由基的速率常数为(1.05±0.05)×105L/(mol·s),而硒代谷胱甘肽修复色氨酸和酪氨酸自由基的速度较谷胱甘肽快约3个数量级[18]。可见硒代谷胱甘肽在抗氧化能力上远远高于谷胱甘肽。GSeH的高抗氧化能力及补硒功能在制药行业有着巨大的潜力。
酵母富硒发酵过程中,培养基硫硒比对菌体的富硒和生长有很大影响,合适的硫硒比在硒代谷胱甘肽的发酵生产中尤为关键[19]。硒与硫在菌体吸收过程中处于竞争关系,但硒源和硫源充足的情况下,菌体优先吸收硫元素。因此,适当降低生长环境中硫元素的含量,菌体在满足生长的前提下会吸收更多的硒,并将其转化为有机硒。过高的硫含量会使试验菌株更多地合成谷胱甘肽而非硒代谷胱甘肽,低硫培养的方法能够极大程度上增加硒代谷胱甘肽产量。现国内已有较多筛选富硒酿酒酵母菌种的研究[20-23],但对合成特定硒代产物的酿酒酵母筛选研究较少。本文以19株酿酒酵母为出发菌株,通过耐硒驯化、硫酸二乙酯(diethyl sulphate,DES)诱变、乙硫氨酸抗性筛选以及添硒低硫培养优化,成功得到一株富硒能力优良的菌株,可利用生物转化途径将无机硒转化得到GSeH,并对其发酵进行优化,以期为开发富硒产品提供一种安全的抗氧化有机硒源。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株
19株酿酒酵母Saccharomyces cerevisiae分别为CGY、CGY2、CCCG、CCY、CLS、CHY、CEPY、CBY、CGWY、CKY、GAQ4、CMY、JYYR、CRY、GAQ1、XHV-25、GAQ2、JYYJS、BDYD:湖北工业大学实验室保藏菌株。
1.1.2 试剂和培养基
培养基:酵母浸出粉胨葡萄糖液体培养基、YEPD固体培养基、无氨基酵母氮培养基和无硫酵母氮源基础培养基(yeast nitrogen base,YNB)培养基。
亚硒酸钠、硫酸二乙酯、硝酸、高氯酸、甲酸、3,3-二氨基联苯胺、乙硫氨酸、庚烷磺酸钠、乙腈、三氟乙酸(tallow fatty acid,TFA)、氮乙酰半胱氨酸:美国 Sigma-Aldrich公司。以上试剂均为分析纯。
1.2 仪器与设备
AR1140电子分析天平:奥豪斯国际贸易(上海)有限公司;ZSD-1270全自动生化培养箱、ZHWY-2012C恒温振荡器:上海智诚分析仪器制造有限公司;YXQ-LS-75211立式压力蒸汽灭菌器:上海博迅实业有限公司;3K15低温高速离心机:美国Sigma公司;JY92-11超声波细胞粉碎机:宁波新芝生物科技股份有限公司;BSC系列生物安全柜:北京东联哈尔仪器制造有限公司;MX-S可调式混匀仪:北京大龙仪器有限公司,Waters QDa MS质谱仪、Waters 2545高效液相色谱仪:美国Waters公司。
1.3 试验方法
1.3.1 菌种活化
将19株酿酒酵母菌分别接入100 mL YEPD液体培养基中,于30℃、180 r/min恒温摇床中活化24 h。
1.3.2 Na2SeO3抗性筛选
将Na2SeO3溶液过滤除菌,加入到灭菌后尚且呈液体状态的YEPD固体培养基中摇匀以保证混合均匀。Na2SeO3浓度按200、400、600 mg/L等梯度递增至3 000 mg/L。选出在高硒浓度下能够生长且菌落较大的菌株,进行驯化培养。
1.3.3 富硒酿酒酵母的驯化培养
将筛选出的酵母菌株接种于装有50mL含50 mg/L Na2SeO3的YEPD培养基中,30℃、180 r/min下培养。每24 h吸取5 mL菌液转接于含50 mg/L Na2SeO3的新鲜YEPD培养基中,连续转接培养90次。
1.3.4 DES诱变
取驯化培养后的酿酒酵母加入YEPD培养基,30℃、180 r/min下培养,取对数生长初期的酿酒酵母发酵液于8 000 r/min离心10 min,用蒸馏水洗3次,加入磷酸盐缓冲液(phosphate buffered saline,PBS)制成菌悬液。加入1%DES,于30℃、180 r/min培养60 min,之后加入硫代硫酸钠溶液终止反应,离心去上清液,蒸馏水清洗3次,用于下一步抗性平板涂布。
1.3.5 乙硫氨酸抗性筛选
将滤膜除菌后的乙硫氨酸加入到灭菌后尚且呈液体状态的YNB固体培养基中混匀,乙硫氨酸浓度按2、4、6、8、10 mg/L。将 DES 诱变后的菌株加入 5 mL YEPD培养基,培养16 h后离心收集菌体,蒸馏水清洗3次后,稀释涂布于乙硫氨酸抗性平板。同时对未诱变处理的酵母培养液进行稀释涂布于该平板上,取在乙硫氨酸最高抗性平板上长出的菌落,在无硫YNB培养基上进一步验证。
1.3.6 发酵条件的单因素优化试验
采用单因素试验探究发酵温度、亚硒酸钠添加时间、初始pH值、摇床转速、接种量、装液量对酿酒酵母菌株CMY-15-1发酵硒代谷胱甘肽产量的影响。每组试验做3次平行。
1.3.7 发酵培养基单因素优化试验
采用单因素法优选CMY-15-1菌株产硒代谷胱甘肽的培养基条件,探究最优碳源、最优氮源、最优无机盐和最优亚硒酸钠添加量等条件。每组试验做3次平行。
1.3.8 应用于生物过程优化的统计学方法
1.3.8.1 Plackett-Burman(PB)试验设计
根据上述试验结果,选取葡萄糖、蛋白胨、酵母粉、磷酸氢二钾、氯化铵、氯化镁、氯化钙、亚硒酸钠8个成分,用Design-Expert软件设计PB试验表,筛选出对CMY-15-1菌株产硒代谷胱甘肽影响比较显著的因素。发酵条件为优化后的试验条件。
1.3.8.2 最陡爬坡试验
以PB设计试验筛选出的显著性因素为基础,对其最佳值区域进行确定,为后续的中心复合设计提供试验依据。依据显著性因素的正负效应,设计合理的步长,增加试验的密集度,设计最陡爬坡试验表。发酵条件为优化后的试验条件。
1.3.8.3 中心复合设计(central composite design,CCD)结合响应面试验设计
根据PB试验和最陡爬坡试验结果,采用三因素五水平的CCD优化试验来确定CMY-15-1产硒代谷胱甘肽的最佳培养基组成。
1.3.9 酿酒酵母生物量的测定
发酵液于8 000 r/min离心10 min,蒸馏水清洗3次后收集菌体,80℃烘干至恒重,酿酒酵母生物量=酿酒酵母菌体质量/发酵液体积。
1.3.10 有机硒测定
烘干硒酵母样品有机硒含量按照GB 5009.93—2017《食品安全国家标准食品中硒的测定》中荧光分光光度法进行检测。
1.3.11 高效液相色谱与质谱联用测定谷胱甘肽和GSeH含量
取发酵后的菌体进行破壁处理,取破壁前后菌体用血球板计数法测定破壁率。破壁后离心取上清液并过0.22 μm滤膜。取谷胱甘肽标品作标准曲线(以谷胱甘肽(glutathione,GSH)浓度为横坐标,峰面积为纵坐标),测定谷胱甘肽含量。利用电喷雾电离(electrospray ionization,ESI)质谱通过SIR模式标定特征分子量355表征硒代谷胱甘肽出峰时间。CMY-15-1内不含有N-乙酰-半胱氨酸,其具有硒代谷胱甘肽类似的结构且出峰时间与被检测物不重叠,可用其作为内标物,以峰面积作为参照指标,用于定量样品内硒代谷胱甘肽含量。
高效液相色谱条件:inertsil ODS-VPC18柱(4.6mm×250 mm,5 μm),柱温为 25 ℃,进样量 20 μL。流动相为乙腈-TFA-水溶液,流量0.6 mL/min;梯度洗脱程序为 0~3 min 乙腈-TFA-水溶液(体积比 1.0∶0.1∶98.9),3 min~10 min 乙腈-TFA-水溶液(40.0∶0.1∶59.9),10 min~15min 乙腈-TFA-水溶液(体积比 1.0∶0.1∶98.9)。
质谱条件:电喷雾电离源正离子模式ESI+,选择监测模式Scan,喷雾电压5.5 kV,雾化气流量15 L/h,离子源温度500℃,锥孔电压15 V,碰撞气体为氮气,数据采集扫描时间20 ms。
1.4 数据处理
数据用Origin 8.0软件、Design Expert 10进行处理分析。
2 结果与分析
2.1 耐硒酵母菌株筛选及驯化
硒标准曲线见图1,耐硒酵母驯化与未驯化菌株的生物量和有机硒含量比较见表1。
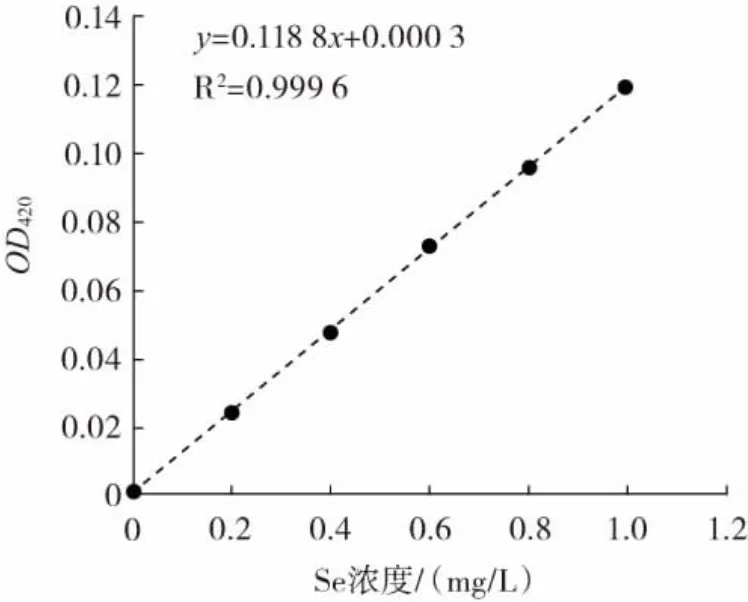
图1 四价硒标准曲线Fig.1 Standard curve of tetravalent selenium

表1 耐硒酵母驯化与未驯化菌株的生物量和有机硒含量比较Table 1 Comparison of biomass and organic selenium content of Se-tolerant yeast with and without Se-tolerant strains
由表1可知,对19株酿酒酵母菌株进行耐硒筛选,得到4株酿酒酵母菌株能在浓度3 000 mg/L Na2SeO3的YEPD固体培养基中生长,分别是CMY、JYYR、BDYD和XHV-25。在经过耐硒驯化培养后,驯化菌株CMY-1、JYYR-1、BDYD-1和 XHV-25-1 和原菌株于200 mg/L Na2SeO3YEPD培养基发酵24 h,其合成有机硒能力和生物量均有所提高。其中CMY-1产有机硒能力最强,较未驯化CMY有机硒含量提高165.6%,比XHV-25高出4.75倍。具有高耐硒能力的菌株,其积累硒的能力和将无机硒转化为有机硒能力都较强[24]。
2.2 DES诱变结果
DES诱变后与出发菌株的生物量和有机硒产量比较结果见表2。

表2 DES诱变后与出发菌株的生物量和有机硒产量比较Table 2 Comparison of biomass and organic selenium yield between DES mutagenesis and original strain
2.3 乙硫氨酸抗性筛选结果
谷胱甘肽标准曲线见图2,CMY-15-1破壁上清液高效液相色谱图见图3,CMY-15-1破壁上清液质谱图见图4。乙硫氨酸抗性筛选后与出发菌株的GSH和GSeH含量比较结果见表3。

图2 谷胱甘肽标准曲线Fig.2 Standard curve of glutathione

图3 CMY-15-1破壁上清液高效液相色谱图Fig.3 High performance liquid chromatography diagram of CMY-15-1 wall broken supernatant

图4 CMY-15-1破壁上清液质谱图Fig.4 Mass Spectrometry diagram of CMY-15-1 wall broken supernatant

表3 乙硫氨酸抗性筛选后与出发菌株的GSH和GSeH含量比较Table 3 Comparison of GSH and GSeH contents after screening for ethionine resistance with those of the original strain
由表3可知,相较未筛选前,谷胱甘肽含量提高60.4%。谷胱甘肽在酿酒酵母内由γ-谷氨酰半胱氨酸合成酶(γ-glutamylsysteine synthetase,γ-GCS)GSH1 和谷胱甘肽合成酶(glutashione synthetase,GS)GSH2 催化合成,GSH1是该反应的调节酶,受终产物谷胱甘肽反馈抑制。乙硫氨酸是谷胱甘肽合成途径中的前体类似物[25],其能与GSH1酶相结合,却又不能参与蛋白质合成,其在胞内浓度不会下降,因此GSH1酶无法恢复正常酶活,使菌体无法合成谷胱甘肽。通过诱变后乙硫氨酸抗性筛选得到的酿酒酵母菌株,能在很大程度上解除谷胱甘肽对GSH1的反馈抑制,从而提高谷胱甘肽的产量。硒是硫的类似物,硒和硫在酿酒酵母体内的代谢途径是相似的[26],该抗性筛选同样也能增加胞内GSeH的积累。
2.4 发酵条件的单因素优化
发酵条件单因素试验结果见图5~图10。
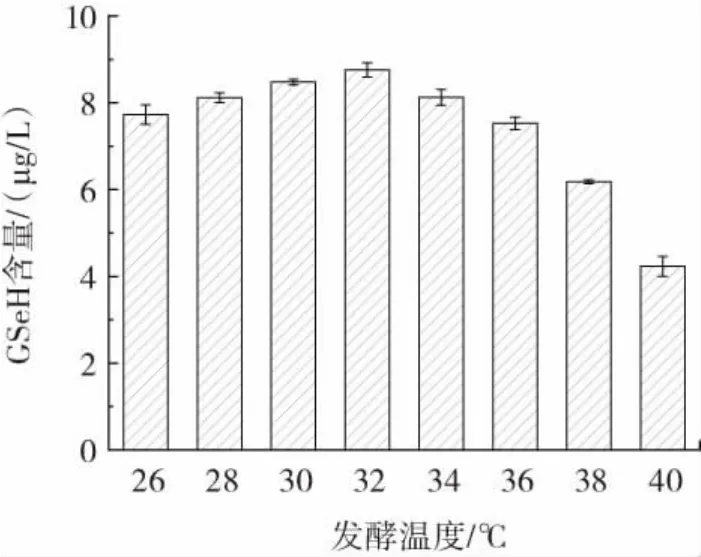
图5 发酵温度对CMY-1-15菌株GSeH产量的影响Fig.5 Effect of fermentation temperature on the yield of CMY-1-15 strain GSeH

图6 亚硒酸钠添加时间对CMY-1-15菌株GSeH产量的影响Fig.6 Effect of sodium selenite addition time on the yield of CMY-1-15 strain GSeH
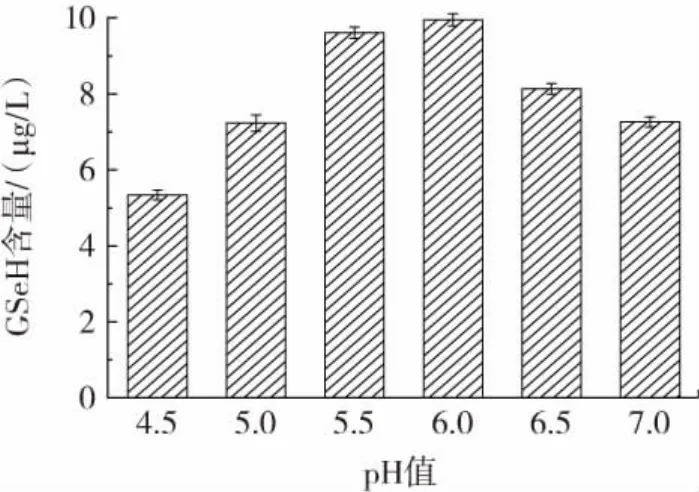
图7 pH值对CMY-1-15菌株GSeH产量的影响Fig.7 Effect of pH on the yield of CMY-1-15 strain GSeH

图8 转速对CMY-1-15菌株GSeH产量的影响Fig.8 Effect of rotational speed on the yield of CMY-1-15 strain GSeH

图9 接种量对CMY-1-15菌株GSeH产量的影响Fig.9 Effect of inoculation amount on the yield of CMY-1-15 strain GSeH
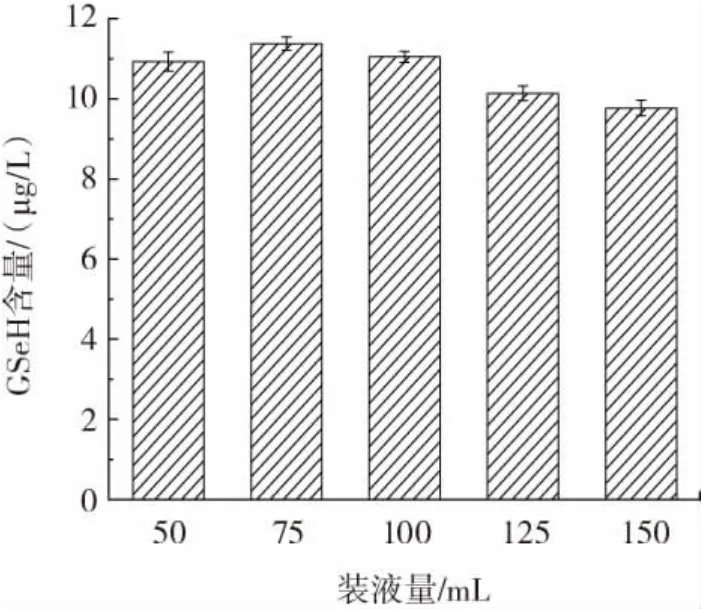
图10 装液量对CMY-1-15菌株GSeH产量的影响Fig.10 Effect of liquid loading amount on the yield of CMY-1-15 strain GSeH
由图5可知,当发酵温度为32℃时,硒代谷胱甘肽的产量达到最大值,为8.76 μg/L。故选择32℃为最佳发酵温度。由图6可知,不同发酵时段添加亚硒酸钠,硒代谷胱甘肽的产量也不同,当发酵时长5 h时添加亚硒酸钠,硒代谷胱甘肽的产量达到最大值,为9.73 μg/L,故选择发酵5 h添加亚硒酸钠为最佳添加亚硒酸钠时间。由图7可知,当初始pH6.0时,硒代谷胱甘肽的产量达到最大值,为9.95 μg/L,此后,随着初始pH值的升高,硒代谷胱甘肽的产量反而会降低,故最佳初始pH值为6.0。由图8可知,当摇床转速达到200 r/min时,硒代谷胱甘肽的产量达到最大值,为10.50 μg/L,故最佳摇床转速为200 r/min。由图9可知,当接种量为7%时,硒代谷胱甘肽的产量达到最大值为11.13 μg/L,故选择最佳接种量为7%。由图10可知,当装液量为75 mL时,硒代谷胱甘肽的产量达到最大值,为11.38 μg/L,故选择最佳装液量为75 mL。
2.5 发酵培养基的优化
发酵条件培养基优化结果见图11~图18,复合氮源对硒代谷胱甘肽产量的影响结果见表4。
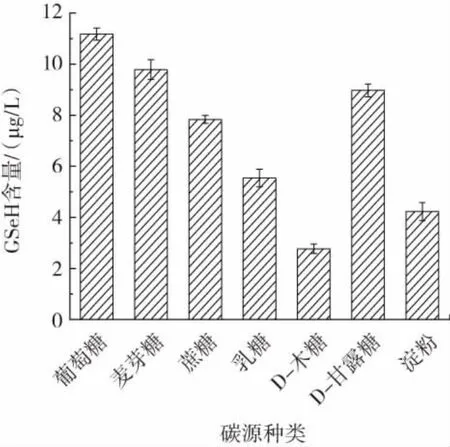
图11 碳源种类对GSeH产量的影响Fig.11 Effects of carbon source types on GSeH yield

图12 最优碳源添加量对GSeH产量的影响Fig.12 Effect of optimal carbon source addition on GSeH yield

图13 有机氮源种类对GSeH产量的影响Fig.13 Effect of organic nitrogen source types on GSeH yield
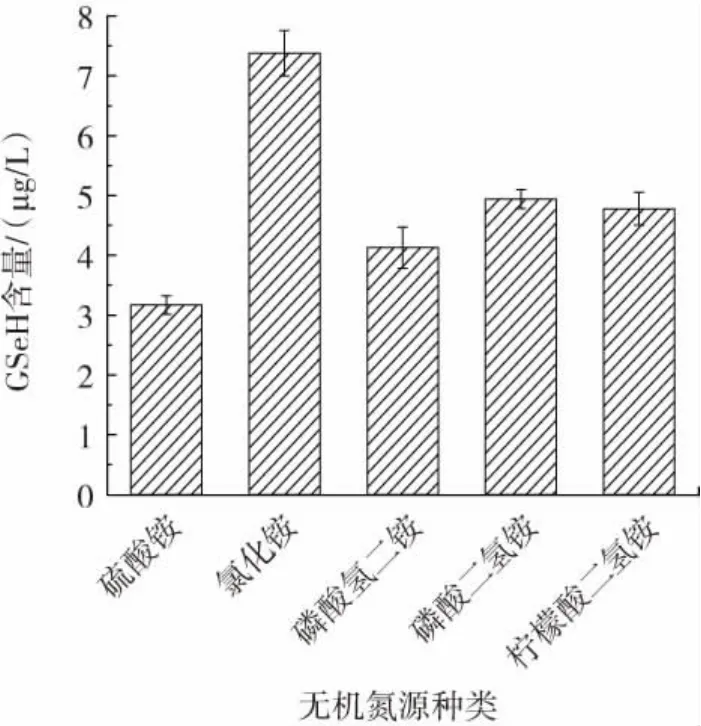
图14 无机氮源种类对GSeH产量的影响Fig.14 Effect of inorganic nitrogen source types on GSeH yield
由图14可知,当发酵培养基无机氮源为氯化铵时,胞内硒代谷胱甘肽产量最高为7.38 μg/L,故选择氯化铵为最佳无机碳源。

图15 蛋白胨添加量对GSeH产量的影响Fig.15 Effect of peptone dosage on GSeH yield

图16 Na2SeO3添加量对GSeH产量的影响Fig.16 Effect of Na2SeO3addition on GSeH yield

图17 无机盐种类对GSeH产量的影响Fig.17 Effects of inorganic salts on GSeH yield

图18 酵母粉添加量对GSeH产量的影响Fig.18 Effect of yeast powder addition on GSeH yield

表4 复合氮源对硒代谷胱甘肽产量的影响Table 4 Influence of compound nitrogen source on selenoglutathione yield
由图11可知,当发酵培养基碳源为葡萄糖时,胞内硒代谷胱甘肽产量最高为11.25 μg/L,故选择葡萄糖为最佳碳源。
由图12可知,当葡萄糖添加量达到35 g/L时,硒代谷胱甘肽产量达到最大值为14.38 μg/L,故选择葡萄糖最佳添加量为35 g/L。
由图13可知,当发酵培养基有机氮源为蛋白胨时,胞内硒代谷胱甘肽产量最高为11.29 μg/L,故选择蛋白胨为最佳有机碳源。
由图15可知,当蛋白胨添加量为10 g/L时,硒代谷胱甘肽产量最大,为19.55 μg/L。随着蛋白胨添加量的逐渐增加,硒代谷胱甘肽产量随之降低,硫元素和硒元素在酿酒酵母细胞内是一种代谢竞争关系,当环境中大量存在硫元素时,酿酒酵母会更倾向于吸收利于细胞生长的含硫物质,不利于有机硒类物质的合成。硫作为各种蛋白质和酶类物质的关键元素,缺少硫元素却会使菌株难以大量生长。故发酵培养基需要选择合适的硫硒比,在不影响菌株生长的情况下,尽可能的合成更多的硒代谷胱甘肽。
有机氮源往往都含有不少硫元素,此时可以选择无机氮源和有机氮源作为复合氮源。由表4可知,利用蛋白胨和氯化铵作为复合氮源,蛋白胨10 g/L,氯化铵7 g/L时,此时硒代谷胱甘肽产量最高为27.33 μg/L。
由图16可知,当亚硒酸钠添加量达到150 mg/L时,硒代谷胱甘肽产量达到最大值为28.73 μg/L。相关文献表明[27],亚硒酸钠对菌株有一定毒性,添加过多的无机硒会导致菌株生长量下降,并在同时菌体会产生一种应激机制,将有机硒代谢为对菌体无害的单质硒。故硒代谷胱甘肽产量趋势为先上升后下降。
由图17可知,磷酸氢二钾、氯化镁、氯化钙都能较好的促进CMY-15-1菌株产硒代谷胱甘肽,硒代谷胱甘肽产量分别为 26.34 μg/L、26.93 μg/L、26.56 μg/L。故选择磷酸氢二钾、氯化镁、氯化钙作为无机盐进行后续Plackett-Burman设计试验。
由图18可知,随着酵母粉添加量的提高,硒代谷胱甘肽的产量也逐渐提高,当酵母粉添加量达到8 g/L时,硒代谷胱甘肽产量达到最大值为31.43 μg/L。因为酵母粉中也同样含有较多的硫元素,与硒元素产生代谢竞争,但同时酵母粉中又含有大量微量元素,这对菌株的生长起到至关重要的作用,故硒代谷胱甘肽产量趋势为先上升后下降。
2.6 应用于生物过程优化的统计学方法
2.6.1 PB设计试验
本试验以上述碳源、氮源和金属离子优选试验结果为基础,对影响酿酒酵母CMY-15-1菌株产硒代谷胱甘肽的因素进行考察,这些因素分别是葡萄糖、蛋白胨、酵母粉、磷酸氢二钾、氯化铵、氯化镁、氯化钙、亚硒酸钠。使用Plackett-Burman试验设计考察8个组分的重要性,每个因素取高低两个水平,每组试验做3次平行,PB试验用Design-Expert软件设计如表5。
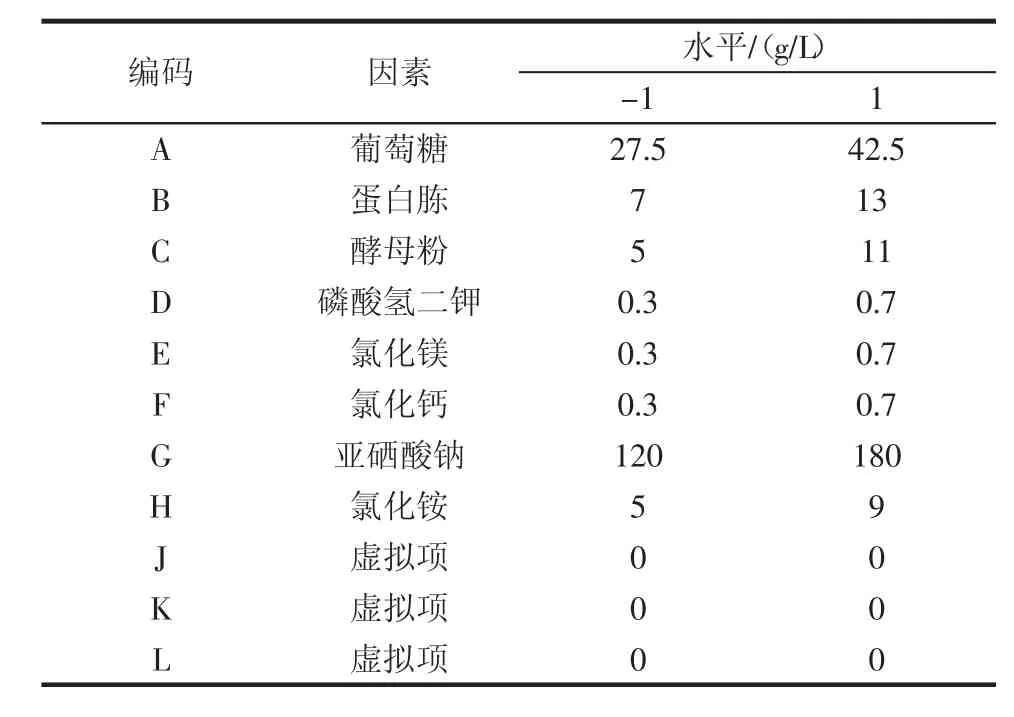
表5 PB设计试验因素与水平Table 5 Factors and levels of PB design test
通过对上述试验的结果进行分析,可以基本确定PB试验所需的培养基组分,然后通过PB试验筛选得到培养基对酿酒酵母菌株CMY-15-1产硒代谷胱甘肽有显著性影响的组分,以便对培养基的组分进行进一步优化。按照软件设计PB试验,试验12次,每组3个平行,按照表5中的组分配制培养基进行发酵试验,测定硒代谷胱甘肽含量,试验结果见表6~表8。

表6 PB设计试验结果Table 6 Results of PB design test

表7 PB设计试验的回归分析Table 7 Regression analysis of the PB design test
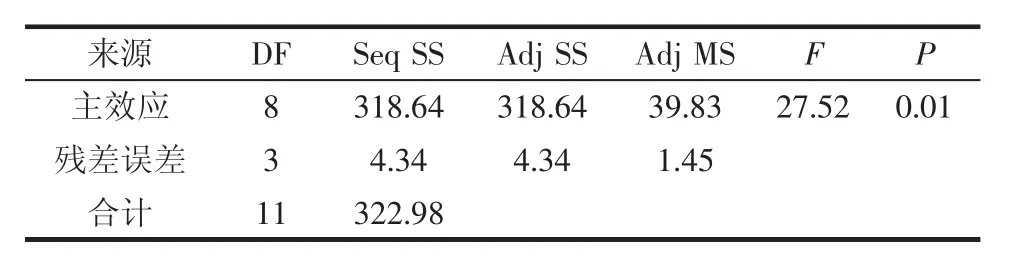
表8 PB设计试验的方差分析Table 8 Analysis of variance for the PB design test
由表7和表8可知,该试验设计的回归模型的P值(prob>F)<0.05,表明该模型显著。蛋白胨、亚硒酸钠和氯化铵的P值在95%的置信区间内是小于0.05的,说明蛋白胨、亚硒酸钠和氯化铵这3种培养基组成成分是影响酿酒酵母CMY-15-1产硒代谷胱甘肽的主要因子,确定此3个因素为响应面试验的3个试验变量。其中蛋白胨为负效应,亚硒酸钠、氯化铵为正效应。该模型显著,其决定系数R2=0.986 6,说明此模型中98.66%的变量可通过此模型来解释。
2.6.2 最陡爬坡试验
根据PB设计试验得到影响酿酒酵母CMY-15-1菌株产硒代谷胱甘肽的显著因素,其中蛋白胨为负效应,亚硒酸钠、氯化铵为正效应,按照各因素正负效应来设定最陡爬坡试验。最陡爬坡试验设计见表9。
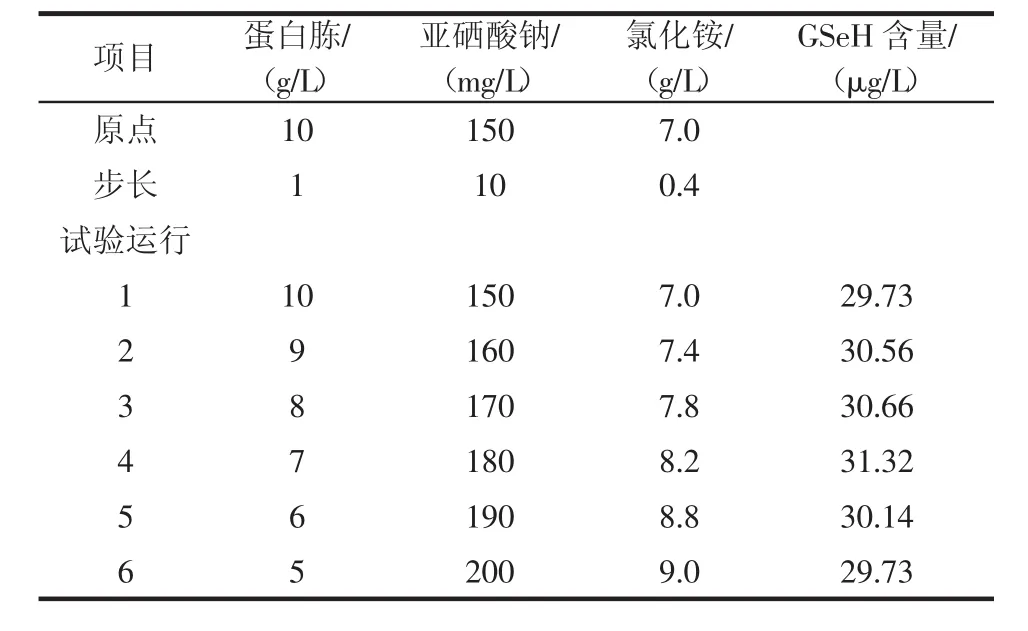
表9 最陡爬坡试验设计Table 9 Test design of steepest climb
由表9可知,当蛋白胨、亚硒酸钠、氯化铵添加量为7 g/L、180 mg/L、8.2 g/L时,酿酒酵母菌株CMY-15-1产硒代谷胱甘肽含量最高,达到31.32 μg/L,将其作为中心复合试验的中心点,进一步优化组分添加量。
2.6.3 中心复合设计试验
通过最陡爬坡试验得到中心点为蛋白胨添加量7 g/L,亚硒酸钠添加量180 mg/L,氯化铵8.2 g/L,以此为中心点以硒代谷胱甘肽产量为响应值进行三因素五水平的中心复合设计试验,各因素水平如表10所示。

表10 CCD设计试验的因素与水平Table 10 Factors and levels of CCD design test
以试验结果表中的硒代谷胱甘肽作为相应量,利用软件Design-Expert构建二次式模型,模型方程为R1=30.72-4.28A+2.30B+1.22C-1.24AB-0.84AC+0.34BC-3.86A2-2.63B2-1.83C2,其中R2=0.9955。由二价多项式分析表可知方程中 A、B、C、AB、AC、A2、B2、C2各项的 P 值均小于0.05。这说明以上各项对CMY-15-1菌株产硒代谷胱甘肽有显著性影响。失拟项检验值为0.107 1>0.05,这说明模型能与数据准确拟合。
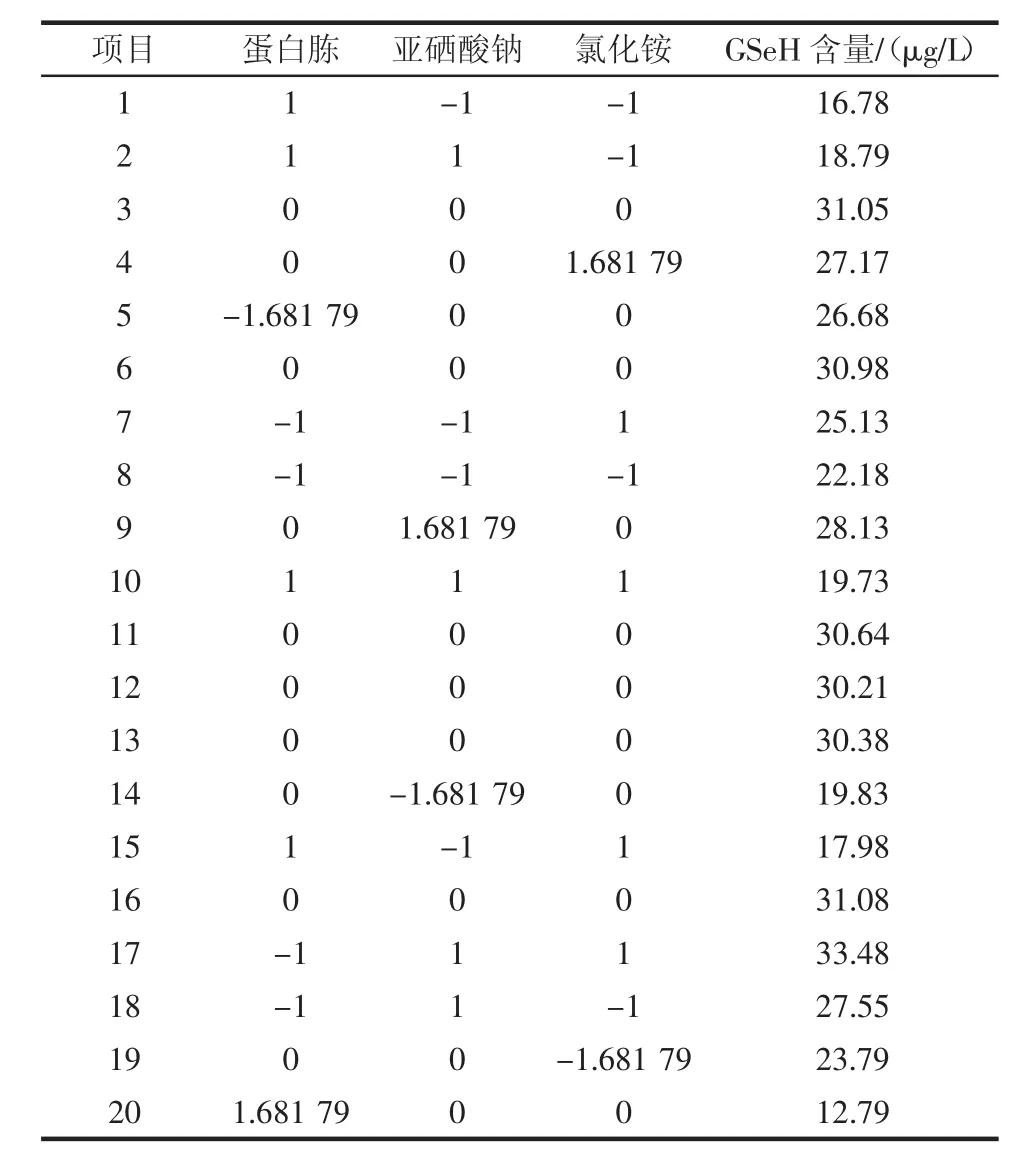
表11 CCD设计试验与结果Table 11 CCD design test and results

表12 二价多项式回归分析Table 12 Regression analysis of divalent polynomial
经回归方程的方差分析结果验证表明,模型的P值<0.05,方程具有统计学上的显著性,说明该模型与试验值拟合较好,适用于CMY-15-1产硒代谷胱甘肽的理论预测。蛋白胨和亚硒酸钠、蛋白胨和氯化铵之间存在显著交互作用,通过软件对回归方程中AB、AC交互项绘制响应面分析图,见图19~图20。

图19 蛋白胨和Na2SeO3的交互作用对CMY-15-1产硒代谷胱甘肽的影响Fig.19 Effect of the interaction of peptone and Na2SeO3on the production of selenoglutathione by CMY-15-1

图20 蛋白胨和NH4Cl的交互作用对CMY-15-1产硒代谷胱甘肽的影响Fig.20 Effect of the interaction of peptone and NH4Cl on the production of selenoglutathione by CMY-15-1
由模型和软件分析可知蛋白胨5.46 g/L,亚硒酸钠205.9 mg/L,氯化铵9.56 g/L为最佳添加量。在此预测最优培养基组分下硒代谷胱甘肽产量为33.46 μg/L。
2.6.4 验证试验
用CCD设计试验得到的最佳培养基组成:蛋白胨5.46 g/L、亚硒酸钠205.9 mg/L、氯化铵9.56 g/L、葡萄糖35 g/L,酵母粉8 g/L,磷酸氢二钾0.5 g/L,氯化镁0.5 g/L,氯化钙0.5 g/L做3次重复试验,平均硒代谷胱甘肽产量 33.71 μg/L。实测值与回归方程预测值(33.46 μg/L)吻合良好。
3 结论
本研究利用实验室19株酿酒酵母作为起始菌株,通过耐硒驯化、DES诱变和乙硫氨酸抗性筛选,获得了一株富硒能力强的菌株CMY-15-1,其有机硒含量达到2 663.3 μg/g。单因素试验确定CMY-15-1最佳发酵条件为发酵温度32℃、亚硒酸钠添加时间为发酵后5 h、初始 pH6.0、摇床转速 200 r/min、接种量 7%、装液量75 mL。在最优发酵条件下,通过单因素试验筛选出最佳碳源、有机氮源和无机氮源、无机盐等成分,并优化了亚硒酸钠添加量。通过PB设计试验有效筛选出对酿酒酵母CMY-15-1产硒代谷胱甘肽有显著性影响的成分,通过最陡爬坡试验,确定培养基中这些组分的添加量,最后由中心复合设计试验得到最佳发酵培养基组成为蛋白胨5.46 g/L、亚硒酸钠205.9 mg/L、氯化铵9.56 g/L、葡萄糖35 g/L、酵母粉8 g/L、磷酸氢二钾0.5 g/L、氯化镁0.5 g/L、氯化钙0.5 g/L,测得硒代谷胱甘肽含量为 33.71 μg/L,预测值为 33.46 μg/L,结果相差不大,说明采用上述一系列优化方法得到的试验结果是合理可靠的,优化后的硒代谷胱甘肽产量是优化前的3.94倍左右。
在本试验中,过高的硫含量会使试验菌株更多的合成谷胱甘肽而非硒代谷胱甘肽,复合氮源低硫培养的方法能够极大程度上增加硒代谷胱甘肽产量。这为富硒酿酒酵母菌种发酵生产硒代谷胱甘肽提供了一定的理论依据。

