苹果短链脱氢酶基因MdSDR响应腐烂病菌侵染的功能研究
王帅乐 肖珂雨 王维东 黄丽丽
(西北农林科技大学旱区作物逆境生物学国家重点实验室/植物保护学院, 陕西 杨凌 712100)
短链脱氢/还原酶(short-chain dehydrogenases/reductase, SDR)是一类NAD(P)(H)依赖的氧化还原酶,负责催化生物体内的氧化还原反应[1-3]。SDR在高等植物中分布广泛[4],主要参与生物碱、萜类、酚类物质和激素等多种次级代谢途径,增强了植物对细菌、真菌、病毒、动物和昆虫等生物胁迫以及非生物胁迫的适应能力,并且在植物传粉、种子传播和种间竞争中发挥重要作用[1,5-8]。同时,SDR也参与多种初级代谢,维持植物正常的生长发育。例如,在叶绿素的合成途径中,SDR家族的原叶绿体氧化还原酶(protochloropyllide oxidoreductase, POR)能将原叶绿素转化为叶绿素[9-10];在脂肪酸合成途径中,SDR家族的β-酮脂酰-ACP还原酶(β-ketoacyl-ACP reductase, KAR)和烯脂酰-ACP还原酶(enoyl-ACP reductase, ENR)能催化还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)和还原型烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide,NADH)依赖的两个还原步骤,是植物脂肪酸生物合成的两种关键酶[11-12]。
脂肪酸是细胞膜、栓质和角质蜡的关键成分,为植物抵御环境胁迫提供了物理屏障[13-14]。植物能通过改变不饱和脂肪酸的含量来调节膜的流动性,从而维持适合关键整合蛋白(integral protein)发挥功能的环境[15-16]。例如,在高温胁迫环境下,野生型烟草叶绿体中的光合蛋白出现热变性和光合效率下降。而三元脂肪酸(trienoic fatty acids,TAs)表达被抑制的转基因植株中,未检测到光合蛋白热变性,其光合效率降幅较小[17]。另外,脂肪酸也参与病原胁迫响应。研究发现,游离亚麻酸既是一种胁迫信号分子,也是植物氧化脂质(如茉莉酸)生物合成的前体[18-19]。许多研究也证明,叶绿体油酸(oleic acid, OA)和壬二酸(azelaic acid, AZA)水平对拟南芥的生物胁迫响应至关重要,可以引发细胞程序性死亡(programmed cell death,PCD)和激发系统获得性抗性(systemic acquired resistance,SAR)[20-21]。另外,植物叶片中脂肪酸的积累能刺激植物脂滴(lipid droplets,LDs)的产生。而脂滴在植物胁迫应答、激素信号途径和植物生长发育中起重要作用[22-23]。例如,脂滴表面的油体钙蛋白caleosin和油体固醇蛋白steroleosin等蛋白具有酶活性,其中caleosin具有过氧化酶活性,可以将α-亚麻酸衍生物转化为各种氧化脂类植保素;steroleosin是一种甾醇脱氢酶,可以将甾醇底物转化为油菜素类固醇(brassinosteroids,BRs),从而调控生长发育和胁迫响应[24-25]。上述研究结果均表明,脂肪酸在植物抵抗生物胁迫中发挥着重要的作用。
在苹果(Malusdomestica)中,目前关于SDR基因功能的研究仍鲜有报道。西北农林科技大学果树病害病原生物学及综合防治团队前期以富士苹果cDNA为模板克隆获得MdSDR基因编码区(coding sequence,CDS)全长序列,并通过预测发现其可能与脂肪酸的合成有关[26]。为了验证MdSDR蛋白是否参与脂肪酸的合成和调控植物免疫,本研究通过农杆菌介导的瞬时表达技术及实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术探究苹果MdSDR对脂肪酸合成中关键基因表达的影响,揭示MdSDR在脂肪酸合成中的重要作用,并利用苹果瞬时表达技术探究MdSDR对苹果树腐烂病菌侵染的影响,初步研究其抗逆功能和作用机理,旨在为苹果抗性品种的研究提供一定的理论基础。
1 材料与方法
1.1 植物材料
嘎啦苹果组培苗(Malusdomesticcv.Royal gala)由西北农林科技大学园艺学院李明军教授实验室惠赠。组织培养植株生长于MS培养基中,培养基配方为:4.43 g·L-1MS+30 g·L-1蔗糖+8 g·L-1琼脂+0.3 mg·L-16-苄氨基嘌呤+0.2 mg·L-1吲哚-3-乙酸,pH值为5.8;组培苗置于人工智能气候箱(RXZ-500-D-PED,宁波江南仪器厂)内培养,培养条件为:温度 25℃,光照16 h/黑暗8 h,光照度6 400 Lx,相对湿度60%。每15 d更换一次培养基。
1.2 菌株和质粒载体
大肠杆菌DH5α、农杆菌GV3101及载体pCAMBIA1302均购自北京擎科新业生物技术有限公司;苹果腐烂病菌03-8(Valsamali)保存于西北农林科技大学。
1.3 植物表达载体的构建
以富士苹果mRNA反转录合成的cDNA为模板,利用特异性引物MdSDR-F、MdSDR-R对MdSDR基因进行PCR扩增,采用快捷型琼脂糖凝胶DNA回收试剂盒II(DP1722,Bioteke,北京)对目的基因条带进行回收。将回收产物与线性化载体pCAMBIA1302连接构建重组质粒pCAMBIA1302-MdSDR。热激法转化大肠杆菌DH5α,进行卡那霉素抗性筛选及菌落PCR验证后提取质粒送至上海生工生物工程股份有限公司测序。将测序重组质粒及空载体(对照)分别电击转化至农杆菌GV3101,卡那霉素抗性筛选及菌落PCR验证后于-80℃冰箱保存备用。
1.4 农杆菌介导的苹果组培苗瞬时转化
用含50 μg·mL-1卡那霉素及50 μg·mL-1利福平的YEP培养基,以28℃、200 r·min-1的条件培养含有pCAMBIA1302-MdSDR和pCAMBIA1302表达载体的农杆菌16 h,6 000 r·min-1离心10 min收集菌体,用0.01 mol·L-1的MgCl2溶液清洗2次,最终用含100 μmol·L-1乙酰丁香酮及10 μmol·L-12-吗啉乙磺酸(4-morpholineethanesulfonic acid,MES)的MgCl2溶液重悬菌体,使其OD600值为1。挑选健康、长势相近的4周龄组培苗若干,使用真空渗透的方法[26]对其进行瞬时转化,转化后的组培苗培养条件与1.1中的组培条件相同。
1.5 苹果总RNA提取及cDNA的合成
组培苗瞬时表达48 h后随机选取叶片样品进行苹果总RNA的提取,提取方法参照快速通用植物RNA提取试剂盒说明书(0416-50gk,北京华越洋生物有限公司),提取完成后对其浓度进行测定,于-80℃冰箱保存备用。cDNA的合成参照High Capacity cDNA反转录试剂盒说明书(4368813,Thermo Fisher scientific,美国)进行,反转录产物于-80℃冰箱保存备用。
1.6 实时荧光定量PCR分析
在NCBI数据库中找到MdβCT、MdACCase、MdKAR、MdKASⅠ、MdKASⅡ、MdHAD、MdENR等与苹果脂肪酸合成相关的基因序列以及与植物脂滴调控相关基因MdSEIPIN[27-28],并以MdEF-1α为内参基因[29]。使用Primier 5软件对上述基因进行引物设计(表1)。
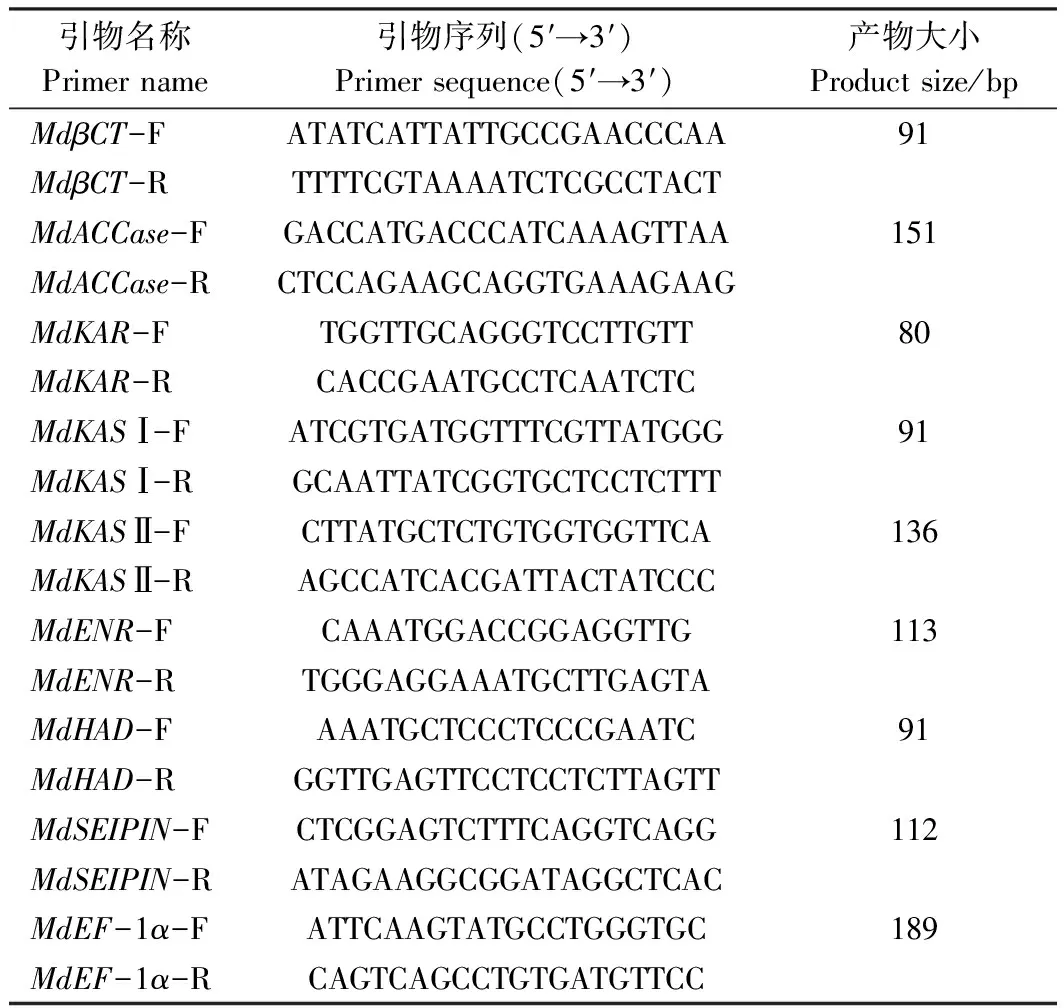
表1 引物序列
利用PCR技术检测上述引物的特异性,PCR反应体系为20 μL:10 μL 2×Taq MasterMix、上下游引物各0.5 μL、1 μL cDNA、8 μL ddH2O。反应程序:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环。
基因相对表达水平测定:按照2×SYBR®Green PCR Master Mix(A311-10,北京康润诚业生物科技有限公司)说明书配制qRT-PCR反应体系,每个样品设3个重复。qRT-PCR反应体系为20 μL:10 μL 2×RealStar Green Power Mixture、10 μmol·L-1正反向引物各0.5 μL、1.5 μL cDNA、7.5 μL ddH2O。使用罗氏LightCycler96实时荧光定量PCR仪,反应程序:95℃预变性5 min;95℃变性10 s,58℃退火30 s,72℃延伸30 s,45个循环;熔解反应程序为:95℃ 10 s,65℃ 60 s,97℃ 1 s。
1.7 真菌活化与侵染试验
将苹果腐烂病菌(V.mali)在马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基上活化,于25℃条件下培养3 d。组培苗瞬时转化48 h后取叶片刺伤接种V.mali。将叶柄插入水琼脂中保湿,25℃共培养36 h左右,拍照并用Image J软件计算病斑直径,重复3次。使用GraphPad Prism 9作图并用SPSS 26.0进行t测验分析。为了减少试验误差,每次重复使用至少30个叶片,取自长势相似的组培苗。
1.8 苹果叶片脂肪酸含量的测定
组培苗瞬时表达48 h后取叶片样品,液氮速冻后用干冰保存运输,送至西安迈维代谢生物科技有限公司进行脂肪酸含量及种类的测定。处理组与对照组各做3次重复,使用GraphPad Prism 9作图并用SPSS 26.0进行t测验分析。
1.9 苹果叶片中脂滴的染色观察
尼罗红(HY-D0718,MedChemExpress, 美国)在缓冲液中稀释至200 mmol·L-1,pH值为7。将组培苗瞬时表达48 h后取叶片样品,在尼罗红染液中37℃避光孵育5~10 min,洗去染色液后制片。用FV3000激光共聚焦扫描显微镜(奥林巴斯,日本)观察,由488 nm激发,在500~540 nm光谱下收集信号。
2 结果与分析
2.1 苹果叶片抗病性检测
为了探究MdSDR蛋白在植物抗生物胁迫中的作用,在苹果组培苗叶片中瞬时表达MdSDR基因后接种V.mali,检测病斑变化情况。结果显示,过表达MdSDR的苹果叶片的病斑明显小于对照(图1-A)。平均病斑直径统计结果显示,过表达MdSDR的苹果叶片的病斑直径显著小于(P<0.001)对照(约14.46%)(图1-B),表明过表达MdSDR提高了苹果叶片对V.mali的抗病性。
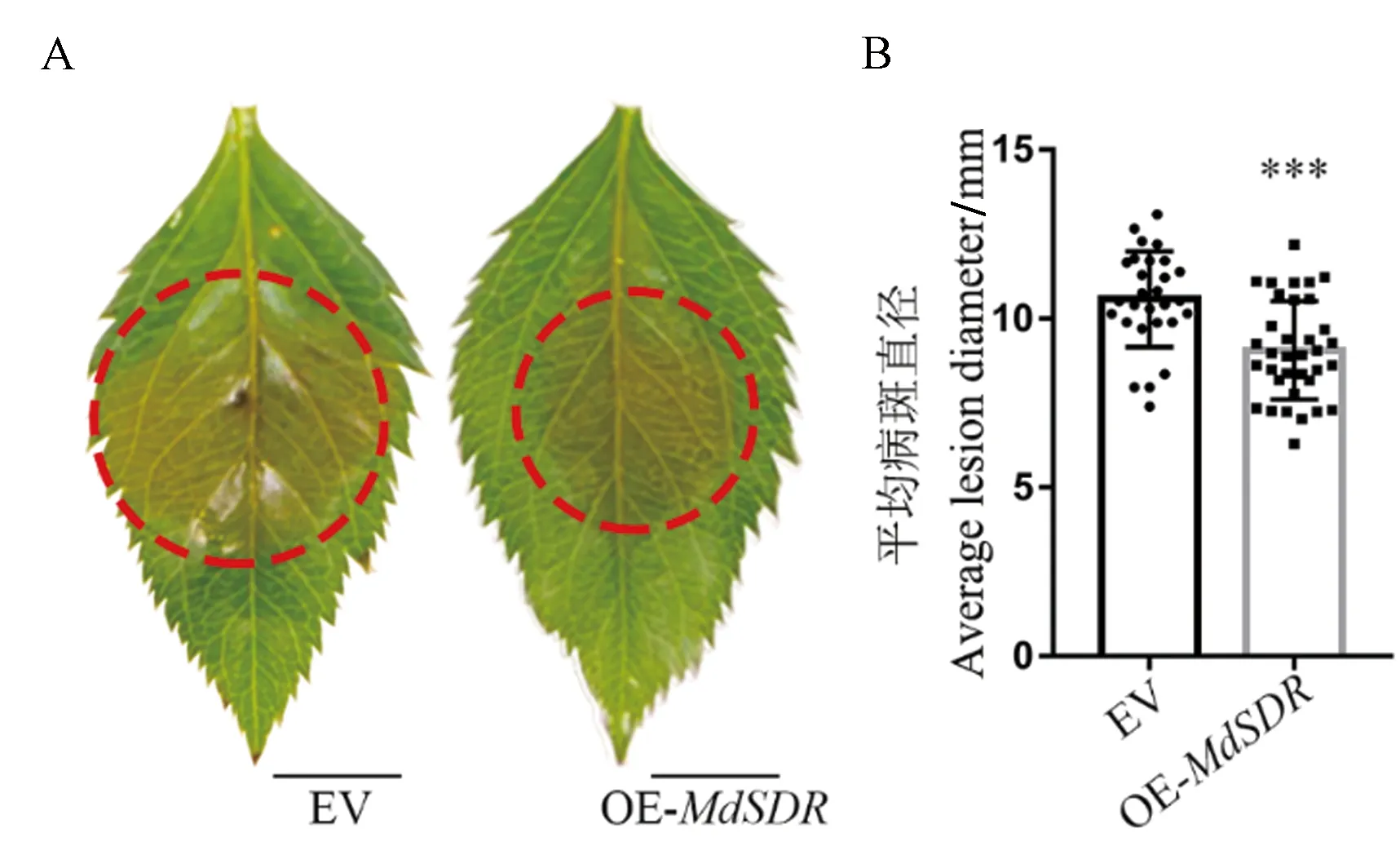
注:A:V. mail.侵染苹果叶片36 h后的叶片表型;B:V. mail.侵染苹果叶片36 h后的平均病斑直径。***表示在P<0.001水平差异显著。
2.2 脂肪酸合成相关关键基因的表达水平检测
为了探究MdSDR对植物脂肪酸合成的影响,对脂肪酸合成通路关键酶编码基因的表达水平进行了检测。与对照相比,瞬时过表达MdSDR苹果叶片中脂肪酸从头合成通路中的相关基因全部显著上调表达,其中MdACCase、MdKAR和MdENR上调幅度较大,MdACCase上调48.41倍,MdKAR上调129.79倍,MdENR上调168.20倍。MdβCT、MdKASⅠ、MdKASⅡ和MdHAD均呈现出上调表达的趋势,其中MdβCT、MdKASⅠ和MdKASⅡ均上调约5倍,MdHAD上调8.67倍(图2)。上述结果表明,MdSDR蛋白参与调控脂肪酸的生物合成。

注:***表示在P<0.001水平差异显著;****表示在P<0.000 1水平差异显著。
2.3 苹果叶片脂肪酸含量测定
为了探究过表达MdSDR对植物叶片中脂肪酸积累水平的影响,对苹果叶片中的脂肪酸含量进行了测定。通过对试验组与对照组数据进行差异显著性分析,发现过表达MdSDR的苹果叶片中各种脂肪酸含量未发生显著变化(P>0.05)(图3)。
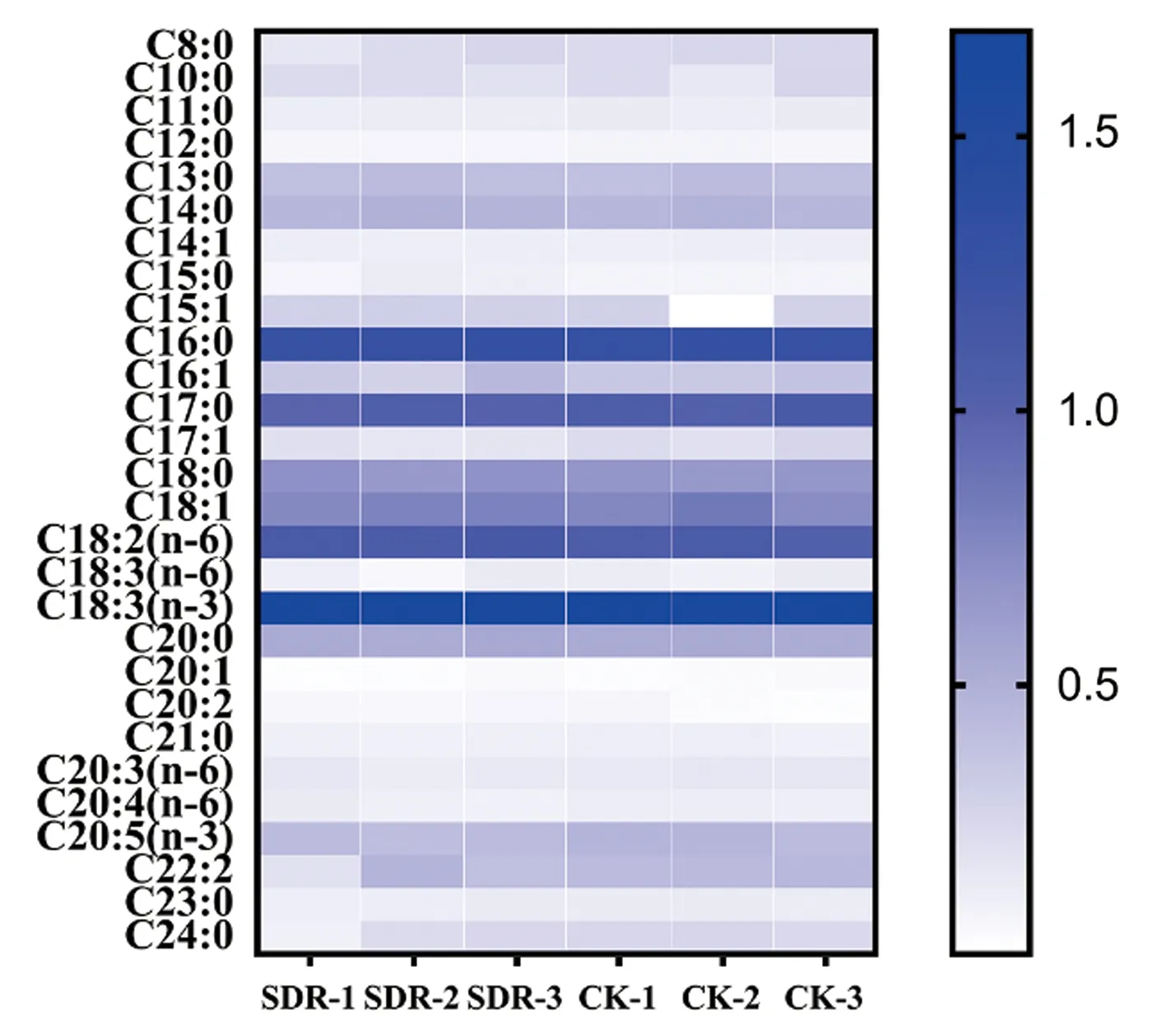
图3 脂肪酸相对含量
2.4 脂滴合成关键基因的表达水平检测
为了验证上述推测,过表达MdSDR后检测了调控脂滴形成的关键基因MdSEIPIN的表达水平变化。结果显示,瞬时表达MdSDR后,苹果叶片中MdSEIPIN基因的表达水平显著提高(图4-A)(P<0.05),表明瞬时表达MdSDR促进了脂滴的生物合成。Western Blot结果显示,在瞬时表达MdSDR基因的苹果组培苗叶片中检测到MdSDR蛋白(图4-B),表明通过农杆菌介导瞬时表达技术,MdSDR蛋白在苹果组培苗叶片中成功表达。

注:A:MdSEIPIN相对表达水平;B:MdSDR蛋白表达检测。*表示在P<0.05水平差异显著。
2.5 苹果叶片中脂滴的染色观察
本研究采用尼罗红染色[30]观察瞬时表达MdSDR的苹果叶片样品,结果显示,瞬时表达MdSDR后的苹果叶片出现大量的点状绿色荧光(图5-A),而在对照中并未发现有大量的点状绿色荧光(图5-B)。本试验过表达的MdSDR蛋白上融合有GFP标签,因此为了排除GFP荧光给试验带来的干扰,单独表达了MdSDR-GFP和GFP,观察并未发现点状绿色荧光(图5-C、D)。综上所述,瞬时表达MdSDR促进了脂滴的形成。
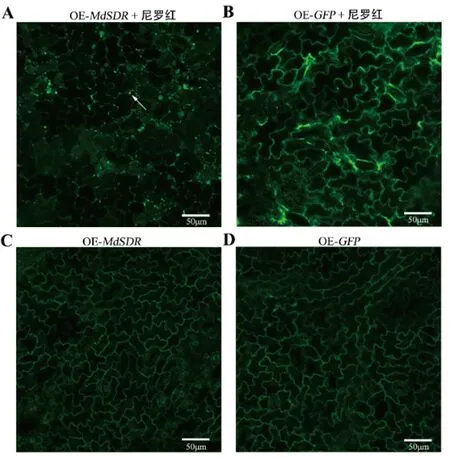
注:脂滴被尼罗红染色后激发出的荧光呈点分布。A:瞬时表达MdSDR-GFP后用尼罗红染色的苹果叶片;B:瞬时表达GFP后用尼罗红染色的苹果叶片;C:瞬时表达MdSDR-GFP后未染色的苹 果叶片;D:瞬时表达GFP后未染色的苹果叶片。
3 讨论
短链脱氢/还原酶不仅可以参与调控植物初级代谢,如脂肪酸生物合成、叶绿素生物合成或降解,还可以参与调控植物的次级代谢,如萜类、类固醇、酚类和生物碱的生物合成[31]。在脂肪酸生物合成的过程中,乙酰CoA的羧化反应是脂肪酸合成通路的限速步骤,故乙酰CoA羧化酶(acetyl CoA carboxylase, ACCase)活性控制着脂肪酸的合成速度;在脂肪酸链延伸阶段中,β-酮脂酰-ACP合酶(β-ketoacyl-ACP synthaseⅡ, KAS)能催化第一步的缩合反应;同时,β-酮脂酰-ACP还原酶(β-ketoacyl-ACP reductase, KAR)和烯脂酰-ACP还原酶(enoyl-ACP reductase, ENR)负责催化其中两步还原反应,即在还原型辅酶II NADPH的协助下,KAR催化β-酮丁酰基的β-位羰基还原为羟基,ENR催化△2-烯丁酰基的α-双键还原为单键;而β-羟脂酰-ACP脱水酶(β-hydrdoxyacyl-ACP dehydrase, HAD)则负责催化β-羟丁酰基α、β-碳原子间的脱水反应[32]。本研究发现瞬时过表达MdSDR后,苹果中乙酰CoA羧化酶(MdACCase)基因、β-酮脂酰-ACP合酶(MdKAS)基因、β-酮脂酰-ACP还原酶(MdKAR)基因、烯脂酰-ACP还原酶(MdENR)基因的表达水平显著上调(图2)。上述结果表明,MdSDR能参与调控植物脂肪酸的生物合成过程,这与本实验室前期预测的结果[26]一致。
已有研究表明脂肪酸能参与调控植物的免疫反应[1,21]。例如茄子中棕榈油酸的积累提高了植物对白粉病菌的抗病性[33];番茄中棕榈油酸的积累增加了植物对黄萎病菌的抗病性[34];亚油酸和亚麻酸的积累会显著提升鳄梨对炭疽病菌(Colletotrichumgloeosporioides)和番茄对丁香假单胞菌(Pseudomonassyringae)的抗病性[35-36];根际微生物诱导植物对灰霉病菌(Botrytiscinerea)的抗病性同样与植物中亚油酸和亚麻酸积累水平密切相关[37]。本研究发现,过表达MdSDR能够提高苹果对腐烂病菌的抗性(图1),然而苹果叶片中脂肪酸含量无显著变化(图3)(P>0.05)。因此推测MdSDR参与调控脂肪酸的生物合成,但并未通过增加脂肪酸含量来提高苹果抗性。
脂肪酸作为初级代谢产物,是生物体内多种中性脂质生物合成的前体。然而过高水平的脂肪酸会对细胞造成损伤[38]。因此生物体会通过多种途径将脂肪酸转化成中性脂质,例如脂肪酸能够通过多步反应,最终在SEIPIN蛋白调控下形成了成熟的脂滴[28,30],保持了细胞内的脂肪酸水平的稳态[22,39]。
脂滴是由富含膜蛋白的单层磷脂分子层包裹中性脂类物质组成的细胞器[40]。脂滴一般存在于种子等植物的营养储存器官中,为植物提供能量和参与植物生长发育调控。叶片等光合组织中脂滴的数量通常远小于种子和花,但叶片脂滴能参与调控植物的非生物和生物胁迫响应[23,39]。例如,脂滴相关蛋白(LD-associated protein,LDAP)能调控植物脂滴的产生。对拟南芥ldap1/ldap3双敲除突变体的研究发现,突变体植物比野生型更容易受到干旱胁迫的影响[41]。而过表达ldap基因的拟南芥显著提高了对干旱胁迫的抗性,这说明脂滴参与调控植物的干旱胁迫响应;另外两种脂滴表面的双加氧酶(dioxygenase)和caleosin能将α-亚麻酸转化为氧化脂类(oxylipin)植保素,从而作为一种信号分子触发植物的超敏反应(hypersensitive response, HR)[21,25]。这些研究均表明脂滴参与植物的非生物和生物胁迫响应。本研究发现过表达MdSDR促进了脂滴的产生(图4、5),同时也提高了苹果对病原菌的抗性(图1)。因此推测MdSDR蛋白通过调控脂肪酸的生物合成间接提高了脂滴的积累水平,从而提高了苹果对腐烂病菌的抗性,但脂滴提高苹果抗病性的具体调控机制还有待进一步研究。
4 结论
本研究利用农杆菌介导的瞬时转化体系在苹果组培苗中过表达MdSDR,检测到苹果叶片中脂滴数量增加,并且对V.mali的抗性显著提高。初步证明MdSDR可以通过促进脂肪酸的生物合成,间接提高叶片脂滴的水平,从而增加植物的抗病性。该研究为理解植物抵抗病原胁迫的途径提供了新思路。

