大豆疫霉生防菌解淀粉芽孢杆菌JDF3 的鉴定
刘 冬,胡九龙,李坤缘,李 萍,高智谋,2*
(1. 安徽农业大学植物保护学院,合肥 230036;2. 安徽农业大学生命科学学院,合肥 230036;3. 安庆职业技术学院园林园艺系,安庆 246003)
大豆疫霉可引起大豆根和茎秆腐烂,给大豆种植业造成巨大风险。在我国多个省份,如福建、黑龙江和安徽等地均有大豆疫霉根腐病和茎腐病的报道[1-2]。目前,大豆疫霉菌的防治主要采用化学药剂防治[3],但较长时间且不当使用药剂致使大豆疫霉产生抗药性,防治效果下降。为解决病原菌对药剂的抗性,生物防治技术成为研究热点。一些芽孢杆菌[4]和假单胞菌[5-6]等被用来抑制大豆疫霉且效果良好,生物防治制剂在市场上也有销售。韩祥东[5]和Wagner[6]等发现假单胞菌可以防治大豆疫霉,而且可以在大豆根系定殖,具有较好的应用前景。芽孢杆菌防治大豆疫病也有报道,它们分别是高地芽孢杆菌和解淀粉芽孢杆菌[4,7]。解淀粉芽孢杆菌FZB42共含11 个基因簇,占基因组的9%以上,用于合成抗菌代谢产物[7-9]。大量的体外研究普遍认为抗真菌活性是由于环形脂肽杆菌霉素D 和丰原素[7],同时其抗菌活性还与非核糖体合成的聚酮类化合物和溶杆菌素[8]等物质紧密相关[9]。目前,以大豆疫霉抑制生物制剂防治大豆疫病的相关研究仍较少。本研究从健康大豆根际分离鉴定生防菌,并评价其抑菌能力和防治效果,以期利用生物防治技术控制大豆疫病,为降低大豆疫霉造成的经济损失提供帮助。
1 材料与方法
1.1 供试菌株
抑菌谱测试所用菌株包括6 株:大豆疫霉(P.sojae)、细极链格孢(Alternaria tenuissima)、西瓜炭疽病菌(Colletotrichum orbiculare)、尖孢镰孢西瓜专化型(Fusarium oxysporumf. sp.niveum)、小麦纹枯病菌(Rhizoctonia cerealis)和小麦全蚀病菌(Gaeumannomyces gramini),均由安徽农业大学真菌学及植物真菌病害实验室保存。
1.2 方法
1.2.1 生防菌的分离 取土壤100 g 左右置于一次性自封袋中,做好标记备用。参考Lu 等描述的方法[4]处理样品,以无菌水媒介完成10 倍稀释。在生物安全柜中接种,以固体牛肉膏蛋白胨培养基培养,接种量为每个培养皿0.1 mL[5]。以10% V8 培养基评价生防菌抑制大豆疫霉的能力,挑取长势良好的菌株对称接种于大豆疫霉菌落四周并标记生防菌菌株编号,25 ℃培养3~5 d 观察结果并复筛验证。
1.2.2 生防菌复筛与抑菌评价 以平板对峙法测试
生防菌抑菌能力,于V8 培养基平板中线接种待测生防菌(未接种的为对照组),距离细菌2.0 cm 处两边分别接种大豆疫霉,设3 个重复。大豆疫霉的抑制效果的评价参考武自强等[10]报道的方法进行,计算公式如下:

另外,抑菌谱抑菌率的测定也按照公式(1)(2)进行计算。
1.2.3 发酵液对大豆疫霉的作用 以离体叶片接种法评价发酵液对大豆疫霉的防治效果[11]。在叶龄相同和大小均匀的大豆叶上喷洒细菌JDF3 发酵液原液,每片叶片喷洒量为0.1 mL,以无菌LB 培养基为空白对照。在边缘打取6 mm 的大豆疫霉菌碟接种于大豆(每组30 个)叶脉一侧,参考Lu 等[4]报道的方法评估防治效果。
1.2.4 大豆疫病防治能力测定 以蛭石为基质加适量水拌匀分装到塑料盆内,播撒大豆Willmas 小种,参考Wagner 等[6]的方法种植大豆,并进行大豆疫病温室盆栽生物防治试验,每隔2 d 按每盆灌根细菌JDF3 20 mL(浓度为1.1×108cfu·mL-1)及发酵液原液。设10 个生物学重复,对照组灌根等量的液体LB 培养基。灌根3 次后,按照每棵1×106mL-1的比例接种大豆疫霉游动孢子,观察和记载严重度,计算病情指数和防治效果[4,11-12]。

1.2.5 菌落形态特征及生理生化试验 在LB 培养基上(37±1)℃培养24 h 记录菌落特征,以革兰氏染色结合显微镜观察其形态特征[4]。菌株JDF3 的生理生化试验按照《常见细菌鉴定手册》记录的步骤执行[13]。
1.2.6 拮抗细菌JDF3 分子鉴定 以CTAB 法[14]提取JDF3 基因组DNA,用引物27f 和1492(16S rDNA)[15]以及gyrB 上下游(gyrase subunit B) 引物进行扩增[16]。体系为50 µL,扩增体系成分添加及PCR 温度条件参考CWBIO 试剂盒说明书。电泳、回收目标片段,连接到PMD-19 载体测序[14],与GenBank 中序列比对,以MEGA5.0 构建系统发育树进行分子鉴定。
2 结果与分析
2.1 大豆疫霉拮抗细菌筛选
从发病严重田块的健康大豆根际土壤分离获得细菌JDF3,其与大豆疫霉对峙培养结果显示(图1)大豆疫霉生长受到抑制,抑制率为71.4% ± 2.6%。

图1 细菌抑制大豆疫霉生长Figure 1 Bacterial inhibition growth of Phytophthora sojae
2.2 细菌JDF3 的抑菌谱
细菌JDF3 对6 种植物病原菌株的抑制结果见图2 和表1。细菌JDF3 对A. tenuissima、G. gramini和C. orbiculare的抑制率在71.25%~77.78%范围内,对其他2 种病原菌的抑制率在58.82% ~ 64.71%之间,表明JDF3 具有广谱抑菌活性。

表1 细菌JDF3 的抑菌效果Table 1 Bacteriostatic effects of Bacillus JDF3

图2 细菌 JDF3 的抑菌谱Figure 2 Bacteriostasis of Bacillus JDF3
2.3 发酵液抑制大豆疫霉产生孢子囊
对照大豆疫霉(CK)在诱导下产生大量孢子囊,而发酵液胁迫的大豆疫霉在诱导下几乎未产生孢子囊(图3),这表明发酵液胁迫可以抑制孢子囊的产生,且抑制率92.8% ± 3.2%。
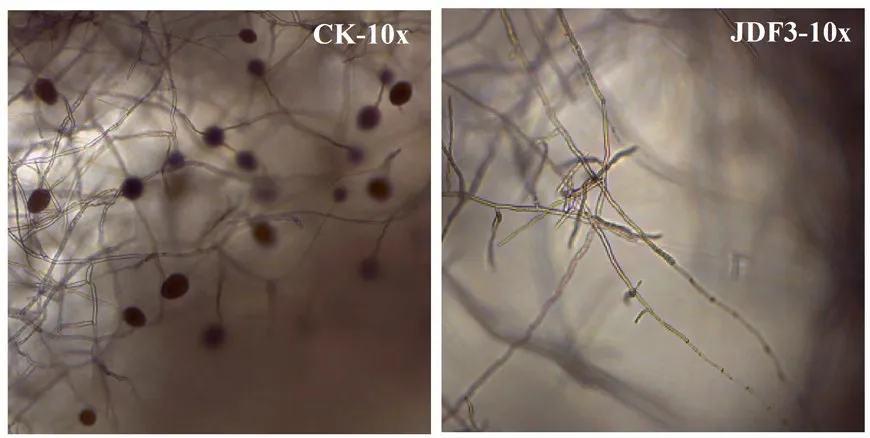
图3 发酵液抑制大豆疫霉产生孢子囊Figure 3 Sporangium production by Phytophthora sojae inhibited by fermentation broth
2.4 发酵液抑制大豆疫霉侵染
以离体叶片测定细菌发酵液对大豆疫霉的防治效果,对照叶片被大豆疫霉侵染,出现明显的水渍黄褐色病斑(图4),而喷洒JDF3 发酵液的大豆叶片未见上述发病症状。即表明菌株JDF3 具有良好的防治大豆疫病的潜力。

图4 发酵液抑制大豆疫霉侵染Figure 4 Infection of Phytophthora sojae inhibited by fermentation broth
2.5 菌株JDF3 及其发酵液对大豆疫病的防治效果
菌株 JDF3 及其发酵液对大豆疫病温室盆栽防治效果(图5)显示:CK1 和CK2 大豆盆栽苗出现明显的病斑,感病严重的大豆苗下胚轴处和根茎处呈现棕褐色至黑色,茎秆和叶片干枯脱水,而轻度感病的盆栽大豆苗下胚轴出现黄萎表型,茎基部和主根有轻度棕色病斑,另外也有部分大豆苗未出现病状。CK1 和CK2 盆栽大豆苗发病严重度等级分布在1~4 级,而菌株JDF3 及其发酵液处理仅有小部分大豆苗下胚轴出现黄萎或棕黑点,根茎有轻度病斑,发病严重度大多数分布在0~1 级,少数分布在2 级。对10 盆大豆苗发病指数进行统计(表2),对照组1 和2 病情指数为87.8 和86.1,处理组病情指数在25.7~35.4 范围内,显著(P< 0.01)低于对照。菌株JDF3 及其发酵液(BAFB)防治效果分别为70.7%和61.4%。
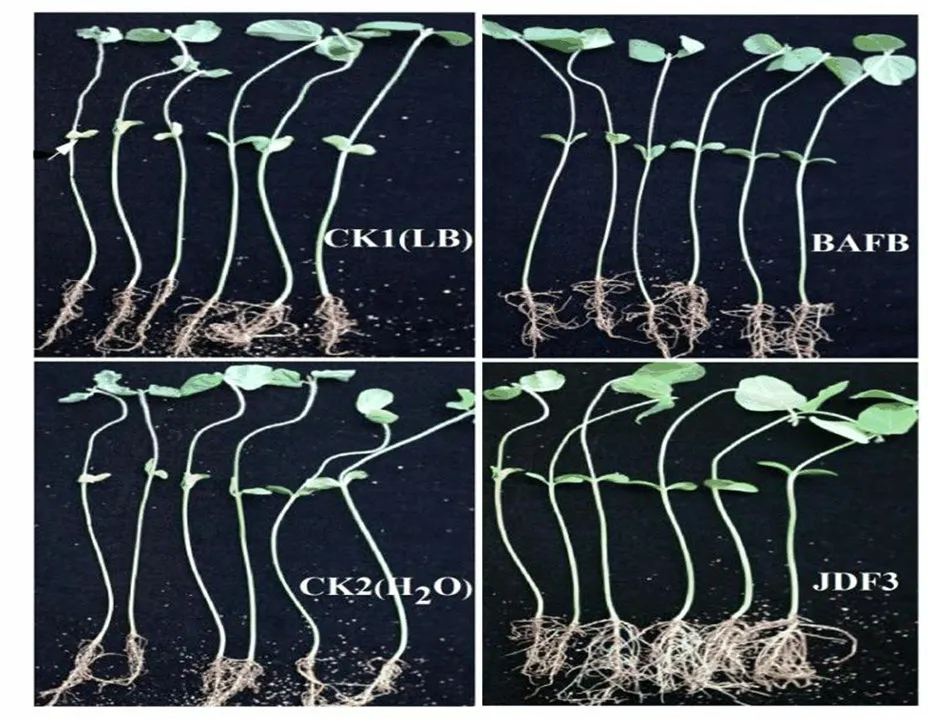
图5 细菌 JDF3 及其发酵液大豆疫病防治效果Figure 5 Bacillus JDF3 and its fermentation broth control effect of soybean blight
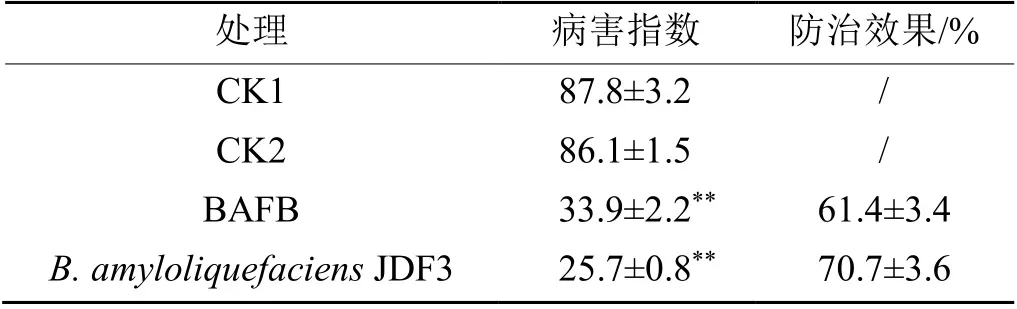
表2 大豆疫病防治效果统计Table 2 Control effects of soybean blight
2.6 菌株JDF3 的鉴定
菌株JDF3 菌落为淡黄色,表面光滑(图6A);革兰氏阳性,杆状,其大小1~2 μm × 2~4 μm (图6B)。15 项生理生化测定结果阳性(表3,“+”代表阳性,“-”代表阴性);结合菌落形态特征初步鉴定为芽孢杆菌属。

表3 菌株JDF3 的生理生化结果Table 3 Results of physiological and biochemical experiments of the strain JDF3
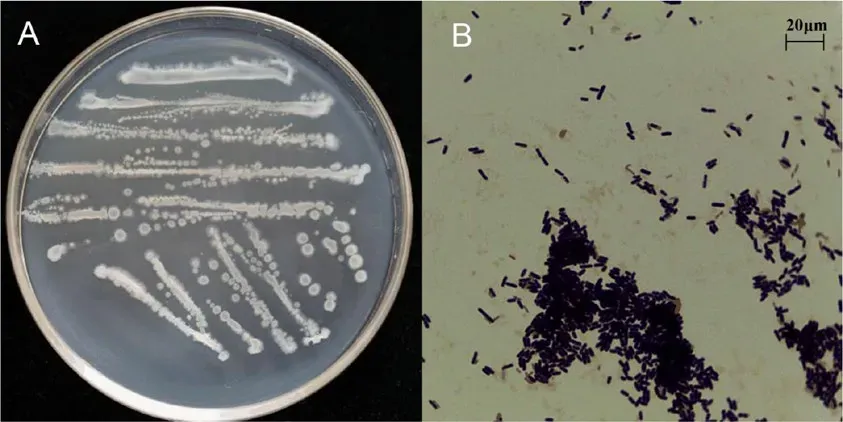
图6 菌落形态(A)和革兰氏染色结果(B)Figure 6 Colony morphology (A) and gram staining result (B)of bacteria JDF3
为了准确的鉴定菌株JDF3,利用细菌通用引物对菌株JDF3 基因组DNA 进行扩增和测序,序列与3 株芽孢杆菌(贝莱斯芽孢杆菌CP029473.2、解淀粉芽孢杆菌 HG328253.1 和枯草芽孢杆菌KC146707.1)的同源性为100%,但所比对序列与GenBank 中3 株菌株序列的覆盖度分别为95.0%、99.8%和94.0%。菌株JDF3 与上述3 株芽孢杆菌的序列仍有所区别。以芽孢杆菌鉴定常用特异性引物gyrB扩增获得1 个1 259 bp 的片段。测序结果与GenBank 数据库序列比对,并在此基础上建立系统发育树;菌株JDF3 与解淀粉芽孢杆菌处于同一分支(图7),进一步确定菌株JDF3 为解淀粉芽孢杆菌。

图7 基于gyrB 基因序列菌株JDF3 的系统发育树Figure 7 Phylogenetic tree of strain JDF3 based on the gyrB gene sequence
3 讨论与结论
本研究分离获得1 株能有效的抑制大豆疫霉的细菌JDF3,其对大豆疫病的防治率为70.7%。它具有广谱抑菌能力,其对细极链格孢、小麦全蚀病菌和瓜蒌炭疽病菌都有较好的抑制效果。基于形态特征、生理生化和gyrB基因序列结果,菌株JDF3 被鉴定为解淀粉芽孢杆菌。16S rRNA 基因序列进化分析表明3 种芽孢杆菌亲缘关系密切,序列相似性高达99%,甚至100%[17],这很好地解释了本研究中菌株JDF3 与贝莱斯芽孢杆菌和枯草芽孢杆菌序列高度相似、仅在覆盖度上存在差异的现象。仅凭16S rRNA 基因序列分析不能有效区分解淀粉芽孢杆菌及其相近种[17],文献显示保守基因gyrB可用来进一步有效地确定它们的分类地位[18]。
芽孢杆菌是主要生防菌来源[4],特别是解淀粉芽孢杆菌具有优异的生物防治效果[7-9]。芽孢杆菌防治大豆疫病可以避免抗药性的发生,且可以促进大豆的生长,刺激大豆的获得性防卫反应诱导其产生获得性抗病能力[4-5,19-20]。次级代谢产物在生物防治作用方面扮演着重要角色[7-9],苯酚和三甲基苯酚对尖镰孢有抑制效果,7 种酮类挥发性代谢物可影响土壤中细菌和真菌数量的分布[16]。挥发性成分2-甲基丁酸、3-甲基丁酸和异丁酸等对香蕉枯萎病菌抑制率在65%以上[21]。次级代谢物癸醇和己醇浓度在≥50 μg·L-1时对大豆疫霉具有良好的抑制效果[19],一些酚类物质和有机酸等物质对大豆疫霉的抑制作用有待进一步评价。而其蛋白酶、几丁质酶、脂肽、丰原素和表面活性等物质也表现出抑菌作用[7-9,20-22]。关于芽孢杆菌JDF3菌株的对大豆疫病的小区及大田防治效果尚待进一步试验研究。

