妊娠期糖尿病胎盘组织中SOCS3与IRS1、IRS1ser307水平的相关性研究
朱晓琴 苏 敏
1 南通大学医学院,江苏省南通市 226001; 2 南通大学附属医院妇产科
妊娠期糖尿病(Gestational diabetes mellitus, GDM)是一种在妊娠期首次发生或发现的不同程度糖代谢异常的内分泌代谢性疾病,在我国GDM发病率已达17.5%~18.9%[1]。GDM与巨大儿、胎儿生长受限、新生儿低血糖等多种不良妊娠结局相关,且GDM孕妇以后发生2型糖尿病的概率显著增加。因而,在致力于良好控制孕期血糖的同时,探索GDM的发病机制对于早期预防GDM的发生具有重要的临床价值。
胰岛素受体底物1(Insulin receptor substrate 1,IRS1)是调节胰岛素信号通路的关键分子,当IRS1表水平或其磷酸化水平异常时,都将影响胰岛素在细胞内的水平,进而引起胰岛素效能下降,诱发胰岛素抵抗(Insulin resistance,IR)[2],而胰岛素抵抗是2型糖尿病发病机制的核心。细胞因子信号转导抑制因子3(Suppressor of cytokine signaling-3,SOCS3)是少数具有降血糖作用的脂肪因子之一,同时被认为是胰岛素信号传导通路中的重要负性调节因子[3]。通过查阅文献发现,目前关于SOCS3与妊娠期糖尿病及胰岛素抵抗的相关性研究仍以传统的胰岛素靶器官为主,研究胎盘组织中SOCS3表达与胰岛素抵抗的相关性未见报道。
本课题拟分别利用QRT-PCR、免疫组化检测SOCS3、IRS1在胎盘组织中的表达及分布情况,通过Western blot检测SOCS3、IRS1、IRS1ser307三种蛋白的表达量,并分析胎盘组织中SOCS3与IRS1、IRS1ser307蛋白表达的相关性;同时分析SOCS3与IRS1、IRS1ser307的相关性,从而探讨妊娠期糖尿病胎盘组织中SOCS3对IRS1、IRS1ser307表达水平的影响。以探讨GDM胎盘发生胰岛素抵抗的分子机制,以及SOCS3作为靶分子在GDM治疗中的应用前景。
1 材料与方法
1.1 材料
1.1.1 实验对象:选取如皋市人民医院2020年3月—2021年3月就诊的单胎、首次妊娠、既往无内外科合并症的孕妇作为研究对象。其中40例孕期产检无异常,设为对照组;40例在孕24~28周行OGTT检查提示GDM(血糖值依据现行GDM诊断标准),设为妊娠期糖尿病组(GDM组)。所选孕妇均知情同意,并签署知情同意书。两组产妇年龄、分娩孕周、孕中期BMI、孕晚期BMI无统计学差异(P>0.05)。见表1。
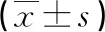
表1两组孕妇一般资料比较
1.1.2 主要试剂:SOCS3 Monoclonal Antibody(Proteintech,66797-1-lg),Anti-IRS1 antibody(ABcam,ab40777),Anti-IRS1 (phospho S307) antibody (ABcam,ab1194),Rabbit anti-β actin antibody(Beyotime,AF0003),Anti-mouse IgG,HRP-linked Antibody(Cell signaling,7076S),Anti-rabbit IgG, HRP-linked Antibody(Cell Signaling,7074S),DAB显色试剂盒(BOSTER,AR1022),聚合HRP标记抗小鼠IgG(BOSTER,SV0001),聚合HRP标记抗兔IgG(BOSTER,SV0002),逆转录试剂盒(Vazyme,R223-01),SYBR-Green Master PCR Mix(Vazyme,Q711-02/03)
1.2 方法
1.2.1 石蜡切片:两组孕妇足月剖宫产后,取胎盘组织常规方法制作石蜡切片:切片厚度4μm。
1.2.2 HE染色观察胎盘组织病理变化:常规程序脱蜡染色,苏木素染色3min,伊红染色1s。
1.2.3 免疫组织化学染色观察SOCS3、IRS1的表达定位:切片脱蜡至水。H2O2孵育10min,PBS洗涤5min×3次。枸橼酸盐抗原热修复,PBS洗涤5min。5%BSA 37℃孵育30min。滴加一抗(SOCS3抗体1∶250稀释, IRS1抗体1∶50稀释),4℃孵育过夜。PBS洗5min×3次,二抗37℃孵育30min。PBS洗5min×3次,DAB显色,蒸馏水终止显色。苏木素复染3min。梯度脱水和透明,封片,隔天拍照。先低倍镜观察,选择目标区域高倍镜下,随机观察5个视野,阳性表达呈棕黄色。
1.2.4 PCR检测SOCS3、IRS1的基因表达水平:Trizol法提取总RNA。根据试剂盒说明书行逆转录反应和荧光定量PCR。引物序列见表2。

表2PCR引物序列
1.2.5 Western Blot检测SOCS3、IRS1、 IRS1ser307蛋白表达水平:常规方法提取蛋白。配制分离胶及浓缩胶。蛋白上样量为200μg。电泳先80V再120V。300mA 90min转膜。室温封闭2h。一抗(SOCS3、IRS1抗体1∶1 000稀释, IRS1ser307抗体1∶250稀释)4℃过夜,PBST洗10min×3次。二抗(1∶2000稀释)室温90min,PBST洗20min×3次。ECL显色。

2 结果
2.1 HE染色观察胎盘组织病理结构 对照组(见图1a)胎盘组织无明显异常;GDM组(见图1b)胎盘血管分布紊乱,管壁增厚且管腔狭窄,血细胞减少,胎盘绒毛成熟不良且绒毛间质血管充盈,合体滋养层异常,细胞滋养层增生,基底膜变厚。

a b
2.2 免疫组织化学染色观察SOCS3的表达定位 SOCS3主要特异性表达于细胞质中,SOCS3在对照组(见图2a)中表达很弱,几乎无表达;在GDM组(见图2b)中表达升高,呈黄色,为阳性表达。

a b
2.3 免疫组织化学染色观察IRS1的表达定位 IRS1主要特异性表达于细胞质中,IRS1在对照组(图3a)中染色呈棕黄色,为强阳性表达,在GDM组(图3b)中表达降低,几乎不表达。
a b
2.4 PCR检测SOCS3、IRS1的基因表达水平 应用荧光定量PCR技术分析SOCS3、IRS1在胎盘组织中的基因表达水平。与对照组相比,在GDM组胎盘中SOCS3(见图4a)表达上调(P<0.01),其表达量是对照组的5.39倍(5.39±4.17);IRS1(见图4b)则是表达下调(P<0.01),其表达量仅有对照组的一半左右(0.48±0.31)。

图4PCR检测SOCS3、IRS1的基因表达水平
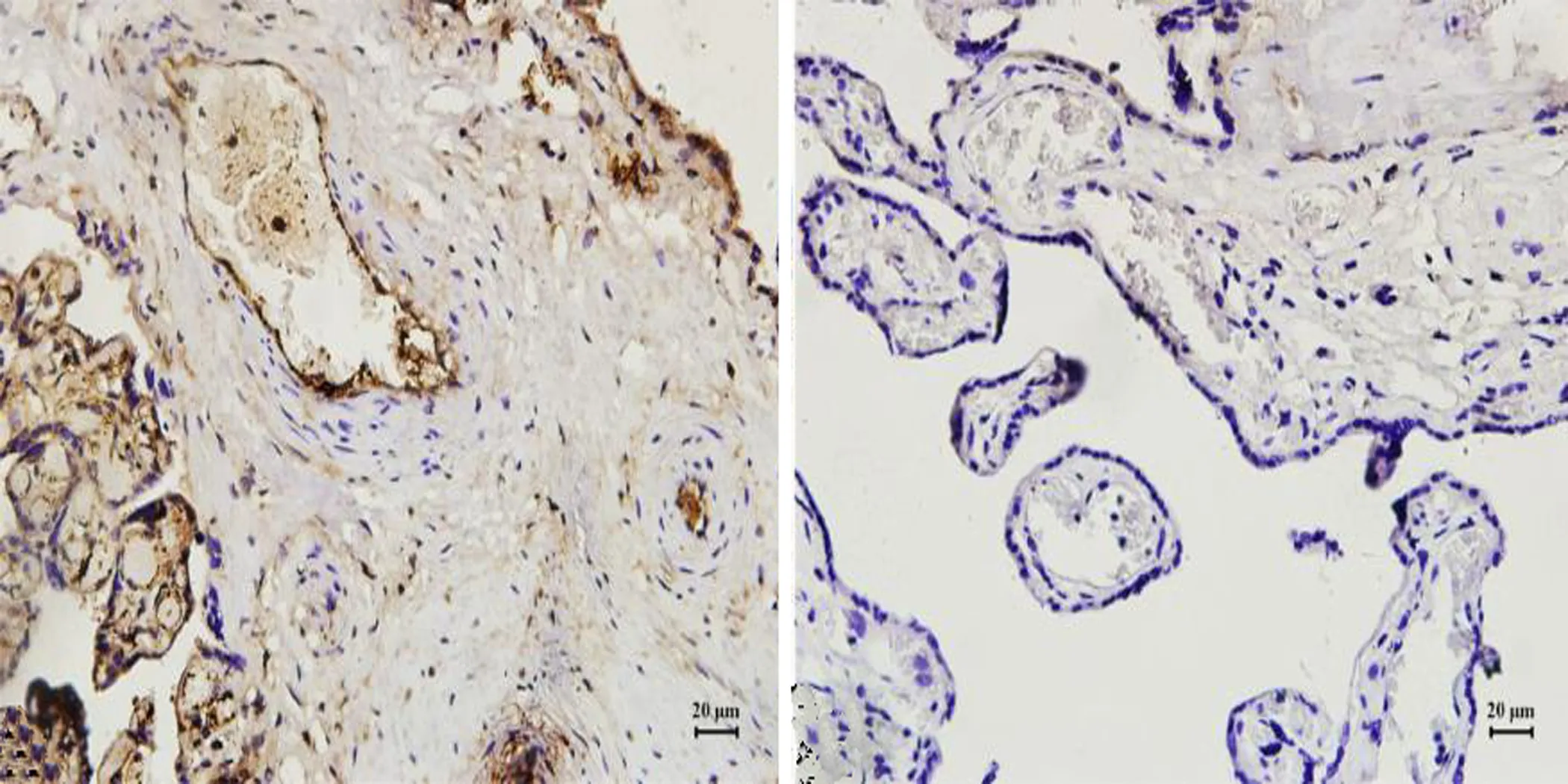
2.5 Western Blot检测SOCS3、IRS1、 IRS1ser307的蛋白表达水平 应用Western Blot技术分析SOCS3、IRS1、 IRS1ser307在胎盘组织中的蛋白表达水平,与对照组相比,GDM组胎盘中SOCS3(图5a、b)表达上调(P<0.01),其表达量是对照组的3.06倍(3.06±0.46);IRS1(图5a、c)表达下调(P<0.01),其表达量仅有对照组的2/3左右(0.67±0.13);IRS1ser307(图5a、d)表达上调(P<0.01),其表达量是对照组的2.97倍(2.97±0.24)。
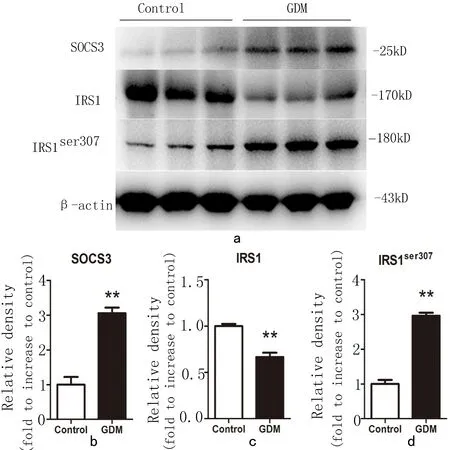
图5Western Blot检测SOCS3、IRS1、 IRS1ser307的蛋白表达水平
2.6 GDM胎盘组织中SOCS3与IRS1、IRS1ser307蛋白表达的相关性分析 为进一步研究SOCS3与IRS1、IRS1ser307蛋白表达的关系,采用Spearman 秩和相关性分析GDM胎盘组织中SOCS3与IRS1、SOCS3与IRS1ser307的相关性。经分析SOCS3与IRS1之间的相关性(r=-0.635 4,P<0.000 1),SOCS3与IRS1ser307之间的相关性(r=0.902 8,P<0.000 1)均呈强相关,见图6。
图6SOCS3与IRS1、IRS1ser307蛋白表达的相关性分析
3 讨论
妊娠期糖尿病(GDM)是一种常见的妊娠期合并症,且属于高危妊娠。虽然国内外对于GDM的研究已有40多年的时间,但GDM的发病机制至今仍未完全阐明。而机体局部和系统性胰岛素抵抗(IR)是GDM的核心问题[4]。近年来多项研究认为,GDM的发生可能与胰岛β细胞功能缺陷、激素水平、炎性因子、遗传信息、日常饮食等因素有关。正常妊娠期间,孕妇对胰岛素的敏感性及反应性降低,因此IR可能是造成葡萄糖的摄取及利用障碍,导致GDM的关键原因之一[5]。
机体内糖脂的代谢依赖于胰岛素,胰岛素则需要与细胞膜表面的胰岛素受体结合,激活胰岛素受体底物1(IRS1),活化的IRS1进一步启动下游信号转导途径。IRS1是胰岛素信号通路中连接细胞内外的信号蛋白,是关键性分子,其表达量和活化水平极大地影响着胰岛素生理效应[6]。而IRS1不同位点的磷酸化,由于蛋白激酶的影响,对胰岛素信号传导进行正性或负性调控[7],如丝氨酸位点Ser307、Ser612、Ser1101活化抑制信号传导,而酪氨酸位点Tyr 989活化则是促进信号传导。在正常生理条件下,胰岛素与细胞表面受体结合前,IRS1以丝氨酸磷酸化为主,以关闭信号通路;当胰岛素结合受体后,IRS1酪氨酸位点磷酸化,竞争性抑制丝氨酸位点的磷酸化,同时启动下游信号通路,从而发挥生理效应[8];但IR发生时,由于高糖等状态的存在,胰岛素与受体结合后,IRS1酪氨酸位点的磷酸化减弱,丝氨酸磷酸化作用增强,抑制了胰岛素信号向下游传导,进一步加重IR、高糖状态[9-10]。研究表明,IRS1表达量减少以及过度的丝氨酸磷酸化可导致胰岛素信号传导紊乱[11-12]。Hu等[13]在人肝细胞癌(HepG2)中发现,橙皮苷通过下调TLR4,上调IRS1的表达,来改善HepG2细胞中的IR。Zhang等[14]也发现WEE(Edgeworthia gardneri)在HepG2细胞中可能通过IRS1/GSK3β/FoxO1信号通路的调控来发挥抗IR作用,WEE通过上调IRS1,以及IRS1酪氨酸磷酸化的表达来降低IR作用。本实验在GDM组中,IRS1表达降低,IRS1ser307表达升高,这与文献研究一致。
SOCS3在机体内分布广泛,与人体脂质代谢、免疫、炎症、妊娠等密切相关。SOCS3可负调控生长激素、瘦素、泌乳素等细胞因子的信号传递,还与多种受体如促红细胞受体、胰岛素受体、瘦素受体等连接发挥对多种因子的调节作用。SOCS3 可竞争性地与胰岛素受体及活化的IRS 相结合,阻碍正常的IRS/PI3K/PKB 信号转导途径,而抵抗素可上调 SOCS3 的表达,诱导 IR 的发生。在 IR 状态下,IRS 的丝氨酸磷酸化水平升高,并抑制酪氨酸磷酸化水平,从而降低IRS 的活性、加速 IRS 的降解,继而影响胰岛素信号的传递。Jorgensen等[15]的研究发现特异性敲除小鼠骨骼肌中SOCS3基因后,IRS1 的表达水平和Akt的磷酸化明显升高,从而抑制了高胰岛素血症和胰岛素抵抗的发展。Li等[16]研究发现miR-152可以通过下调SOCS3的表达来抑制GDM小鼠的肝脏IR。Xu等[17]则在2型糖尿病(T2DM)中研究发现,Angptl7通过上调SOCS3的表达,导致IRS1在蛋白酶体中的降解,进而促进IR和T2DM。Chen等[18]在HepG2 和 C2C12细胞中研究发现黑果树花青素通过下调SOCS3表达,提高IRS1水平,降低IRS1ser307表达,来减弱IR作用,增强HepG2 和 C2C12 细胞中的胰岛素敏感性和糖原合成。本实验在GDM组中,SOCS3表达水平升高,这与文献研究结果一致。
本研究实验数据还显示GDM产妇胎盘组织中SOCS3蛋白表达水平与IRS1表达水平呈负相关,与IRS1ser307表达水平呈正相关。提示SOCS3可能在GDM的IR发展中起一定作用,SOCS3有望成为GDM治疗的新方向、新靶点。

