污水处理厂中两种典型微塑料表面生物膜分析*
马新刚 宛 博 孙佳雯 臧玉魏 谢连科 张国英 崔相宇 祝凡平 袁宪正#
(1.国网山东省电力公司电力科学研究院,山东 济南250002;2.山东中医药大学第二附属医院,山东 济南 250001;3.山东大学环境科学与工程学院,山东 青岛 266237)
塑料作为20世纪的一项伟大发明,现已是不可或缺的生产生活材料。据研究表明,2010年全球192个沿海国家和地区共制造了2.75亿t塑料垃圾[1]。其中,中国是世界上最大的塑料生产和消费国。大量堆积在环境中的塑料垃圾在机械作用、生物降解、光降解等过程的共同作用下,被逐渐分解成毫米级别乃至纳米级别的塑料碎片[2]。其中,微塑料指的是直径小于5 mm的塑料碎片和颗粒[3]。微塑料比表面积大,吸附污染物的能力强,可作为有机污染物的载体帮助其扩散[4]。此外,微塑料体积小,容易被贻贝、浮游动物等食物链底端生物摄食[5-6],并伴随食物链传送至上级消费者,甚至是人类,危害人类健康[7]。因此,微塑料污染不容小觑。
目前,关于微塑料的研究以海洋微塑料居多,包括微塑料的来源、分布、食物网转移、生态毒理学效应等[8]。另已有研究表明在海水中浸泡的塑料上会形成清晰可见的生物膜[9]。塑料上生物膜的形成会降低塑料浮力,使一些塑料碎片沉入深海,加重海洋塑料垃圾的堆积[10]。此外,消费者可能会优先摄取携带生物膜的高营养塑料颗粒,附着生物膜的塑料片会增加动物摄食塑料的概率[11]。ZETTLER等[12]首次对塑料表面的微生物群落进行了综合表征,提出了“Plastisphere”这个概念,并指出北大西洋近海水域中的聚乙烯(PE)和聚丙烯塑料片上会形成独特、多样且复杂的微生物群落,包括异养生物和自养生物。但目前淡水环境下微塑料与微生物群落的相互作用鲜有报道。污水处理厂含有丰富的微生物,因此,污水处理厂中的微塑料有可能携带更丰富的细菌,成为细菌传播的载体。
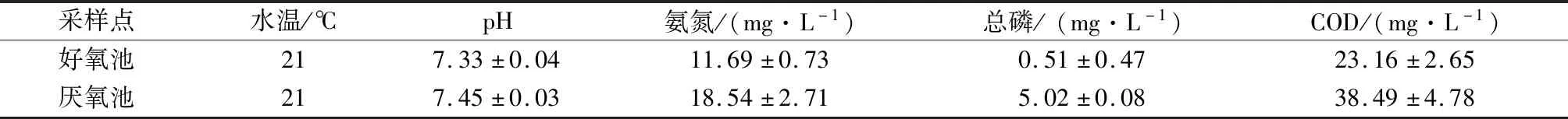
表1 污水水质情况Table 1 Water quality of sewage
本研究以常见的聚对苯二甲酸乙二醇酯(PET)和PE微塑料为实验对象,因为有研究表明PET和PE是环境中最常检测到的塑料之一[13-15],同时也是污水处理厂污泥中最常见的微塑料之一,其中由于PE被广泛用于包装,是丰度最高的微塑料类型[16-17];针对这两种微塑料上生物膜相关研究较多,其表面物理化学性质较为明晰[18],[19]2,[20]。研究在好氧池与厌氧池中PET和PE微塑料表面生物膜的差异特征,为污水处理厂中微塑料的治理与安全性评估提供理论支持。
1 材料与方法
1.1 实验材料
选择同时具有好氧池和厌氧池的青岛某污水处理厂作为实验地点,该污水处理厂采用厌氧/好氧(A/O)工艺,污水经过一系列预处理后进行二级处理,首先流入厌氧池,接着再进入好氧池。对塑料投放时的污水水质进行检测,具体水质指标如表1所示。
选择的PET和PE两种微塑料,购自于广东省东莞市某塑胶材料有限公司,具体参数如表2所示。

表2 微塑料表征Table 2 Characterization of microplastics
将120片相同的微塑料装入带孔洞的不锈钢小球(直径约6 cm)中,PET和PE各有6个不锈钢小球。另外,好氧池和厌氧池各有3个投放点,每个投放点投放装有PET的不锈钢小球和装有PE的不锈钢小球各1个,投放深度均为2 m,3处投放点间距大致相同。实验选取同一流程中的厌氧池和好氧池,即污水流经厌氧池后,流入好氧池中。
培养15 d后,将不锈钢小球从好氧池和厌氧池取出,分别命名为PET-O(好氧池PET)、PE-O(好氧池PE)、PET-A(厌氧池PET)和PE-A(厌氧池PE),并立即在低温条件下送回实验室处理。每个投放点回收的微塑料用无菌水冲洗3次,其中一部分浸泡在无菌磷酸缓冲盐溶液(PBS,0.01 mol/L,pH=7.4)中,用于观察微塑料表面生物膜的分布,剩余的部分存于-80 ℃超低温冰箱中,用于后续的脱氧核糖核酸(DNA)提取以及生物多样性分析。同时分别取好氧池和厌氧池中的本底污泥样品,分别命名为Sludge-O(好氧池污泥)、Sludge-A(厌氧池污泥),用于DNA提取以及生物多样性分析。
1.2 实验方法
1.2.1 生物膜观察
应用Fluo ViewTM FV1000型激光共聚焦显微镜(Olympus,日本)进行生物膜的观察测定。使用碘化丙啶(PI)染料(Sigma,德国)对生物膜进行染色。将浸泡在0.01 mol/L PBS中的微塑料取出,用质量分数为2.5%的戊二醛溶液固定1.5 h,再用无菌0.01 mol/L PBS冲洗3次,加入PI染料,在黑暗中染色15 min,再用无菌0.01 mol/L PBS冲洗3次。制作玻片后,通过配有氩激光器(488 nm)的激光共聚焦显微镜观察样品。每种微塑料样品随机选取一个视野,观察塑料表面是否有微生物附着(物镜10×,目镜10×)。
1.2.2 细菌的多样性分析
分别收集好氧池与厌氧池中的微塑料,通过离心(12 000 g,1 min)收集微塑料上的生物膜。使用PowerSoil®DNA分离试剂盒(Qiagen,德国)对DNA进行提取。为获取微塑料上的生物膜,将300 mg无菌玻璃珠(直径1 mm)添加到每个装有样品的PowerBead管中,充分涡旋并在FastPrep®快速核酸提取仪(MP Biomedicals,美国)上研磨3次,每次1 min。采用Qubit®2.0荧光计(Invitrogen,美国)检测抽提的基因组DNA浓度,并采用质量分数为1%的琼脂糖凝胶电泳进行DNA完整性检测。按照Illumina公司DNA测序样品前处理指导手册第二版(Illumina TruSeq DNA Sample Prep v2 Guide)对每个样品构建大约500 bp大小的DNA文库。使用Agilent 2100生物分析仪(Agilent Technologies,英国)和Agilent 2100 DNA 1000试剂盒评估文库质量。所有样品在Hiseq X-ten平台(Illumina,美国)上进行150 bp配对末端测序。筛选Illumina原始序列,然后,使用短序列比对软件SOAPaligner 2.21比对国家生物技术信息基因库的细菌基因组和序列,并除去映射到宿主基因组的序列。处理后的序列通过SOAPaligner 2.21与美国国家生物技术信息中心(NCBI)数据库(http://www.ncbi.nlm.nih.gov)进行比对,用于检测已知的细菌。然后将排列好的序列分为界、门、纲、目、科、属、种进行分类和丰度统计,生成不同层次的分类学相对丰度分布图。
1.2.3 生物信息学分析
通过Shannon-Wiener指数比较物种种类和物种丰度分配的均匀性;通过Simpson指数分析群落多样性。运用非度量多维尺度(NMDS)分析、主坐标(PCoA)分析比较Beta多样性。利用R语言Vegan软件包进行NMDS分析,利用R语言ade4程序包进行PCoA分析。
2 结果与讨论
2.1 微塑料表面生物膜的空间分布
PI与DNA结合可发出红色荧光,激光共聚焦图像(见图1)显示,经过15 d的培养,PET和PE表面均有微生物附着。在好氧池中培养的微塑料表面微生物分布较为密集,而在厌氧池中培养的微塑料表面微生物较为稀疏,这种现象可在PET和PE上同时体现。因此,与厌氧池相比,好氧池中的微生物更容易附着在PET和PE表面,形成稳定的生物膜。另外,在好氧池中培养的PE-O上有累枝虫附着,累枝虫是污水处理厂好氧池中常见的原生动物。因此,进入污水处理厂的PET和PE均会成为微生物附着的载体,生物膜的多少与环境微生物的种类相关。
2.2 物种多样性分析
由表3可以看出,好氧池中微塑料上生物膜的细菌丰度和多样性均高于好氧池中本底污泥样品,而在厌氧池中则相反;PET-O的Shannon-Wiener指数和Simpson指数均为最高,其次是PE-O;同一好/厌氧池中的PET和PE的Shannon-Wiener指数和Simpson指数差别较小。因此,微塑料会在特定环境下富集微生物,好氧池中微塑料上的生物膜具有较高的物种多样性,而厌氧池中微塑料的物种多样性较低。这说明生物膜的物种多样性与培养环境有关,而塑料种类起到的影响较小。
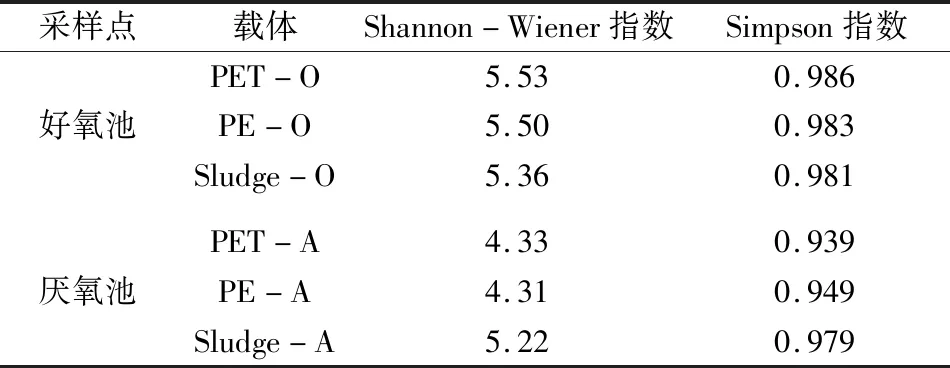
表3 各样品物种多样性指数Table 3 Species diversity index of each sample
2.3 群落结构分析
由图2可见,基于点与点之间的距离,6种样品可分为3组,其中相距较近的样品有PET-O和PE-O、PET-A和PE-A、Sludge-O和Sludge-A。这说明在好氧池中培养的PET和PE细菌群落组成相似;在厌氧池中培养的两种微塑料生物膜的细菌组成差异度较小。因此,相比于微塑料材质,环境因素对生物膜细菌群落结构的影响更大。同时,Sludge-O和Sludge-A的微生物群落接近但存在差异。从图2可以得出,不同培养环境下污泥的微生物群落结构也存在一定的差异,导致同一种微塑料在不同培养环境下的菌群差异。FENG等[19]5研究发现,不同微塑料上的微生物群落与海水中存在差异,此外,微塑料生物膜群落的差异与微塑料的类型有关,这是由于微塑料上官能团影响生物膜的形成,例如芳香基团可以促进细菌附着[21],这与本研究结果是类似的。然而,在塑料上形成了不同于相应好/厌氧池本底污泥的微生物群落,说明微塑料是一种独特的微生物载体。
各样品基于属水平的PCoA分析如图3所示,其中第1主成分(PCoA1)的贡献率为 62.9%,第2主成分(PCoA2)贡献率为 27.9%,能客观反映各样品间微生物群落结构上的差异。图3与图2显示的结果一致,微塑料上的生物膜与相应好/厌氧池中本底污泥的细菌群落组成存在明显差异。
科分类水平的细菌群落组成(见图4)显示了各样品前20的物种组成。PET-O的优势菌为红环菌科(Rhodocyclaceae),占细菌科种类总数的16.49%;PE-O的优势菌同为红环菌科,占细菌科种类总数的12.02%;Sludge-O上的优势菌为伯克氏菌科(Burkholderiaceae),占细菌科种类总数的24.62%; PET-A和PE-A中的优势菌相同,均属于聚磷菌(Candidatus Accumulibacter),分别占细菌科种类总数的32.09%、38.30%;Sludge-A上的优势菌为红环菌科,占细菌科种类总数的22.45%。虽然6种样品在科水平的优势菌不同,但其均属于β-变形菌纲(Betaproteobacteria)。此外,PET-O和PE-O的差别主要体现在伯克氏菌科,PET-O中伯克氏菌科的丰度略高于PE-O。在厌氧池中培养的PET-A和PE-A可以得到相同的结果。因此伯克氏菌科细菌更容易附着在PET上。综上所述,同种塑料在不同环境中优势菌不同,不同塑料在相同环境下优势菌相同,但仍在部分细菌上表现出丰度差异。
图5显示了属水平上前20种细菌在6种样品中的丰度分布情况以及聚类树。PET-O上陶厄氏菌(Thauera)占优势地位,随后依次为聚磷菌(CandidatusAccumulibacter)、分枝杆菌(Mycobacterium)、青枯菌(Ralstonia)。PE-O优势菌为陶厄氏菌,随后依次为分枝杆菌、戈登氏菌(Gordonia)、聚磷菌。Sludge-O主要细菌有青枯菌、陶厄氏菌、丙酸杆菌(Propionibacterium)、代尔夫特菌(Delftia)。PET-A聚磷菌占优势地位,随后依次为青枯菌、分枝杆菌、戈登氏菌。PE-A细菌丰度从高到低分别为聚磷菌、陶厄氏菌、戈登氏菌、分枝杆菌。Sludge-A主要细菌有陶厄氏菌、青枯菌、代尔夫特菌、聚磷菌。
由图5中样品的布雷距离关系可分析样品的相似度。PET-O和PE-O的细菌结构较为相似,优势菌均为陶厄氏菌。Sludge-O的细菌结构与PET-O及PE-O显著不同,优势菌为青枯菌。因此,微塑料上形成了与污泥样品结构不同的微生物群落。在厌氧池中可以得到相似的结论。PET-A和PE-A的优势菌属为聚磷菌,仅在陶厄氏菌和青枯菌的丰度上有所差异。Sludge-A的聚磷菌丰度较小,其优势菌属为陶厄氏菌。Sludge-O和Sludge-A的细菌群落结构相似,但在好氧池中培养的PET-O和在厌氧池中培养的PET-A在细菌群落结构上却存在差异,PET-A的聚磷菌和青枯菌丰度显著高于PET-O。PE-O和PE-A在细菌相对丰度上同样存在差异。另外,虽然不同微塑料上的细菌群落结构存在差异,但与相应好/厌氧池中本底污泥相比,微塑料上附着的生物膜群落结构更为相似。
3 讨 论
本研究发现,经过短期培养,PET和PE微塑料上均会形成生物膜,因此微塑料可以作为微生物的载体,协助细菌的扩散。另外,在同一生物处理池中,PE上的生物膜要多于PET,这可能是由于两者的性质不同导致的。表2显示,PE的水接触角为95.02°,PET的水接触角为76.35°,PE的疏水性大于PET。有研究表明,水接触角较大(即越疏水)的膜材料表面越容易被细菌粘附[22]。另外,研究发现由于生物膜可以增加微塑料被动物摄食的可能性,附着生物膜的微塑料环境危害性显著升高[23]。
本研究通过物种多样性分析发现,不同培养环境中的PET和PE上附着的生物膜细菌群落的丰富度和多样性存在较大差异。这可能是由于好氧池中的微生物相较于厌氧池丰富度更高且容易附着在微塑料上,另外,好氧池和厌氧池的pH、氨氮、总磷、COD等环境因子存在差异,这些都会影响微生物群落的组成。不同的环境会为微生物的附着提供不同的条件[24]。
本研究结果表明,背景污泥的优势菌与相应微塑料生物膜上的优势菌不同,如好氧污泥中的优势菌为青枯菌,而PET-O和PE-O上的优势菌为陶厄氏菌。原因可能为:PET和PE为生物膜的附着提供了条件,水体中的一些细菌会更倾向于粘附在塑料上并逐渐附着在塑料表面,形成生物膜上的优势菌。由于PET和PE在成分和物理性质方面存在差异,因此为微生物富集提供的条件不同,两者在细菌组成上就存在差异。不同塑料对附着细菌的种类具有选择性,故塑料上的优势菌与背景水样并不同。此外,污水处理厂持续运行,水体中的污染物浓度、温度、碳氮比等会随着时间变化,这也会影响微塑料上生物膜的组成,导致生物膜的优势菌和采样时背景污泥的优势菌不同[25]。
PET-O、PE-O和Sludge-A的优势菌红环菌科、Sludge-O上的优势菌伯克氏菌科、PET-A和PE-A中的优势菌聚磷菌均属于变形菌门。变形菌门是细菌中最大的门,有报道指出其在污水处理厂中分布十分广泛,是污水中最大的一个门类[26]。其中属于变形菌门的肠杆菌科(Enterobacteriaceae)含有多种致病菌,比如沙门氏菌(Salmonella)、埃希氏菌(EscherichiaCastellaniandChalmers)、志贺氏菌(ShigellaCastellani)。在本实验中,各样品在科水平的细菌相对丰度显示,在6种样品中均可检测到一定数量的肠杆菌科细菌。因此,微塑料有可能携带致病菌,成为致病菌传播的载体。虽然污水处理厂通过二级处理和三级处理可以去除大部分微塑料[27],但污水处理厂的出水中仍检测到大量微塑料[28],它们会被释放到水生生态系统中,特别是河流[29-30]。污水处理厂是将微塑料传播至河流、江海的重要点源[31]。因此,携带致病菌的微塑料会通过出水由污水处理厂进入河流或海洋,将致病菌扩散至更广的环境中。但目前尚未对从污水处理厂流入水生生态系统中的微塑料上致病菌的含量做相关研究,其对环境造成的具体危害性仍有待深入探讨。
4 结 论
浸泡在好氧池和厌氧池中的PET和PE微塑料表面均有生物膜附着,但生物膜量存在差异。微塑料是一种独特的微生物载体,其上可形成不同于背景环境的微生物群落。环境对微生物群落结构的形成具有重要影响,在不同环境中培养的微塑料会形成不同的细菌群落结构,且丰富度和多样性存在差异。此外,微塑料还可能会成为致病菌的载体,协助致病菌的传播与扩散。

