降解玉米赤霉烯酮菌株的筛选、降解机制及特性研究
吴宗芮, 丁 轲,, 余祖华,, 李 旺, 李元晓, 曹平华, 何万领, 贾艳艳, 刘 宁
(河南科技大学功能微生物与精准营养实验室1,洛阳 471003) (洛阳市活载体生物材料与动物疫病防控重点实验室2,洛阳 471003)
玉米赤霉烯酮(Zearalenone,ZEN)是一种非甾体类真菌毒素,也称F-2毒素[1]。ZEN主要由禾谷镰刀菌产生,广泛存在于谷类作物及其副属产品中,如玉米、花生及商业性饲料等,从而影响饲料的产量和质量[2]。这些镰孢属物种主要生长在温带地区的植物上,在温度为20~25 ℃、湿度大于20%的环境下,ZEN可以在3周内产生[3-5]。ZEN化学结构类似于雌二醇,可竞争性的与雌激素受体竞争性结合,引起早情、流产和死胎等,从而影响动物的生产性能[6]。研究表明,低剂量的ZEN可引起细胞增殖,表现出致癌性,高剂量的ZEN通过凋亡或坏死诱导氧化应激、DNA损伤、线粒体变性以及引起细胞最终死亡[7-10]。因此,ZEN严重影响食品安全和畜牧业,给人类和动物的健康和经济带来严重的危害。
ZEN去除方法主要分为3种:物理法、化学法和生物降解法。物理法降解ZEN是通过热处理和吸附作用,热处理虽然会达到高效的降解率,但经热处理后会破坏食品和饲料的营养物质。吸附剂处理是利用活性炭、铝硅酸盐类等吸附降解ZEN,但各种吸附往往具有特异性,降解效果并不理想。化学法主要是采用臭氧、双氧水或碳酸钠浸泡等处理降解ZEN,但化学试剂的添加会造成二次污染等弊端。而生物降解法是通过微生物分泌的酶和菌体吸附达到对ZEN的降解,这种方法耗费成本低,安全性高,并且不会破坏食品或饲料的营养物质[11-13]。因此,生物降解法是解决ZEN污染问题的最具前景的措施。已有报道很多微生物对ZEN均有一定的降解效果,但要达到一定降解效率方可有应用价值,所以必须从大量的样品中进行筛选。Risa等[14]从42株红球菌属中发现1株可以降解90%以上的ZEN。Yu等[15]从土壤中分离出1株不动杆菌,用胞外酶在培养基里处理12 h后,未发现ZEN和雌激素样的代谢物,Tan等[16]从土壤中分离出2株假单胞菌,在含有2 μg/mL ZEN的培养基中培养72 h后,分别能够降解68%和51%的ZEN。尽管微生物降解ZEN是一种较理想的方法,但所筛选微生物必须是国家允许使用的菌种。本实验拟以ZEN为唯一碳源,从发霉饲料、土壤及动物粪便中筛选能够高效降解ZEN的菌株,为利用该菌株降解不同原料中的ZEN提供了生物材料基础。
1 材料与方法
1.1 实验材料与设备
1.1.1 样品采集
河南省洛阳市某养殖厂发霉饲料、动物粪便、土壤样品。
1.1.2 主要试剂
ZEN标准品、ZEN常规ELISA检测试剂盒、细菌基因组提取试剂盒,其他化学试剂均为分析纯。
1.1.3 主要仪器
酶标仪(Multiskan-FC)、凝胶成像系统(GelDoc XR System) 、PCR 扩增仪(9700T) 。
1.1.4 培养基
初筛培养基:KH2PO41.5 g,Na2HPO42.5 g,(NH4)SO40.5 g,MgSO4·7H2O 0.2 g,CaCl20.05 g,pH调至7.0,蒸馏水1 L,高压灭菌锅中121 ℃灭菌30 min,降至室温后加入终质量浓度为1 μg/mL的ZEN。
LB固体培养基:胰蛋白胨10 g,NaCl 10 g,酵母提取物5 g,琼脂粉10 g,pH调至7.0,蒸馏水1 L,高压灭菌锅121 ℃灭菌30 min。降至室温后加入终质量浓度为1 μg/mL的ZEN。
LB液体培养基:胰蛋白胨10 g,NaCl 10 g,酵母提取物5 g,pH调至7.0,蒸馏水1 L,高压灭菌锅121 ℃灭菌30 min。降至室温后加入终质量浓度为1 μg/mL的ZEN。
1.2 方法
1.2.1 样品的处理
将发霉饲料,动物粪便和土壤分别取约5 g置于200 mL锥形瓶里,加入100 mL的无菌水,于37 ℃、200 r/min振荡1 h,静置30 min后,取上清液备用。
1.2.2 ZEN降解菌株的初筛
取200 μL上清液加入含有终质量浓度为1 μg/mL 的ZEN的初筛培养基里,于37 ℃、200 r/min振荡3 d,取上清液进行10倍梯度稀释至10-7倍,分别取100 μL涂布于终浓度为1 μg/mL的ZEN的LB固体培养基,置于37 ℃培养24 h。
1.2.3 ZEN降解菌株的纯化
挑取LB固体培养基不同形态的菌落划线于终浓度为1 μg/mL的ZEN的LB固体培养基里,反复划线纯化菌株。
1.2.4 ZEN降解菌株的复筛
将纯化过的菌株接于LB液体培养基里,37 ℃、200 r/min振荡24 h,取200 μL培养液接种于终质量浓度为1 μg/mL的ZEN 5 mL LB液体培养基里,取5 mL LB液体培养基加入终质量浓度为1 μg/mL的ZEN作为空白对照,每个菌株做3个重复,于37 ℃ 200 r/min振荡24 h。根据玉米赤霉烯酮ELISA试剂盒对检测培养液中的ZEN含量,按照下列公式计算ZEN的降解率,筛选降解率较高的菌株。
ZEN降解率=(Po-Pn)/Po×100%
式中:Po为对照组ZEN的残留量;Pn为每个菌株发酵液中ZEN的残留量。
1.2.5 ZEN降解菌株的鉴定
1.2.5.1 形态学鉴定
将上述降解效果较好的菌株接种于LB固体培养基上,于37 ℃恒温培养24 h,观察菌落形态,挑取单菌落进行革兰氏染色,观察菌体的显微形态。
1.2.5.2 16S rDNA的鉴定
利用细菌基因组提取试剂盒提取菌株的基因组DNA,以DNA为模板,采用杆菌科细菌通用引物,上游引物27F:5’-AGAGTTTGATCCTGGCTCAG-3’,下游引物1492R:5’-GGTTACCTTGTTACGACTT-3’,进行PCR反应,PCR反应体系为:Premix Taq 12.5 μL,模板1 μL,上游引物、下游引物各1 μL,加ddH2O至25 μL。PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃再延伸10 min;4 ℃保存。扩增后的PCR产物进行测序。将测序结果在NCBI上进行BLAST比对,选取较高的同源性序列,运用MEGA6.0软件中Neighbor-Joining法构建系统进化树。
1.2.6 菌株降解机制的验证
将菌株接种于LB液体培养基,于37 ℃、200 r/min振荡24 h,菌液分成2份,1份放4 ℃冰箱,另1份121 ℃灭菌30 min。将2组菌液离心后分离上清和菌体,菌体用无菌PBS洗涤2次后重悬,用超声细胞破碎仪破碎菌体,获得细胞内容物。在上述实验发挥主要降解作用的部分进行处理:加蛋白酶K(65 ℃,水浴2 h);加蛋白酶K和1% SDS(65 ℃,水浴2 h);热处理(100 ℃水浴2 h)。菌体于37 ℃、200 r/min振荡30 min,其余各处理组振荡24 h,以终质量浓度为1 μg/mL的ZEN的等量PBS作为对照,每个样品设置3个重复,用玉米赤霉烯酮ELISA试剂盒检测各处理组中ZEN残留量。
1.2.7 不同条件对菌株降解ZEN的影响
分别研究ZEN降解菌株的不同时间(12、24、36、48、72 h)、不同温度(28、35、37、40、42 ℃)、不同pH(3.0、4.0、5.0、6.0、7.0)和不同接种量(1.0%、2.0%、3.0%、4.0%、5.0%)对ZEN降解能力的影响,优化其发酵条件。
1.2.8 菌株对不同原料中ZEN的降解
称取可溶性淀粉、玉米粉和豆粕粉各0.2 g,分别置于50 mL离心管内,加入10 mL蒸馏水,将pH调至优化值,121 ℃灭菌30 min,降至室温后加入终质量浓度为1 μg/mL的ZEN。将预先培养好的菌液以优化的接种量接入各样品中,以终质量浓度为1 μg/mL 的ZEN的等量各个饲料样品作为对照,每个样品设置3个重复。37 ℃、200 r/min培养优化的时间后取样,按照ZEN ELISA检测试剂盒测定各样品中ZEN的含量。
1.2.9 菌株G-6的安全性实验
将10只8周龄左右雄性健康的昆明小鼠分为实验组和对照组2组,每组各5只。将G-6菌株培养过夜后,经活菌测定菌株的活菌数为7.83×108cfu/mL。对照组灌喂无菌生理盐水,实验组灌喂G-6菌株,每只小鼠灌胃1.0 mL/d,连续灌胃为3 d,然后对小鼠为期1周的观察,每天察看并记录小鼠的精神状态、采食量、饮水量、粪便及死亡情况等。最后对小鼠进行处死、解剖,观察小鼠脏器是否出现病理变化。
2 结果与分析
2.1 ZEN降解菌株筛选结果
从样品中分离出96株菌,将初筛分离的菌以ZEN为唯一碳源的初筛培养基进行培养,初步分离出14株菌,其中6株来自于发霉饲料,分别为M-3、L-12、L-6、M-19、G-6、P-17,4株来自于土壤,分别为G-4、P-12、P-21、M-17,4株来自于动物粪便,分别为P-6、M-11、P-25、M-7。
2.2 ZEN降解率的测定结果
将筛选得到的14株菌接种于含有1 μg/mL ZEN的LB液体培养基中发酵培养,ELISA检测ZEN毒素含量。由表1可知,来自发霉饲料中分离的G-6菌株降解效果最好,降解率达到81.19%,其余13株分离菌的降解效率均低于51%,因此,选择G-6菌株进行后续的研究。

表1 分离菌株对ZEN降解率
2.3 G-6菌株的形态特征
由图1可见,菌株的菌落形态为表面粗糙,边缘不整齐,不透明,中间隆起。菌株的显微形态为革兰氏阳性,杆状,中等大小,单个存在,少数呈双链状。具端生芽孢。
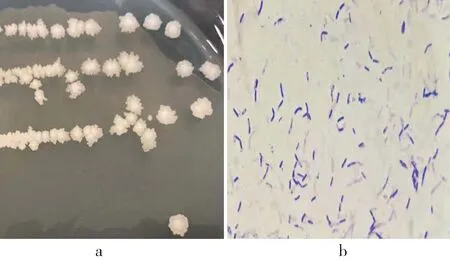
图1 菌株G-6的菌落特征(a)和镜检特征(b)
2.4 G-6菌株16S rDAN PCR扩增及测序结果
以菌株G-6的DNA为模板,经PCR扩增后,产物电泳在约1 450 bp处有一条特异性条带,与预期大小相符,见图2。经测序获知该序列为1 424 bp(GenBank登录号为SUB10218507)。

图2 菌株G-6的16S rDNA PCR扩增结果
2.5 基于G-6菌株16S rDNA序列系统进化树结果
将测序结果去NCBI进行BLAST比对,挑选同源性高于99%的菌株,通过MEGA6.0软件构建系统发育树,由图3可知,G-6菌株与解淀粉芽孢杆菌在同一分支上,亲缘性最近。因此,鉴定G-6菌株为解淀粉芽孢杆菌。

图3 菌株G-6基于16S rDNA序列系统进化树
2.6 G-6菌株降解机制的验证
菌株的细胞壁对ZEN有吸附作用。活细胞的降解率为56.17%,灭活细胞降解率为38.1%。分析的原因可能是在热处理的过程中使活细胞的吸附位点失活,从而减少对ZEN的吸附能力。
由图4可知,菌株无细胞上清的降解率明显高于细胞内容物,说明菌株降解ZEN的能力主要发生在无细胞上清,菌株降解ZEN的活性物质主要发生在胞外。对菌株无细胞上清进行不同处理,加蛋白酶K处理后,菌株降解ZEN的效率下降至35.17%;加蛋白酶K和1% SDS共同处理后,菌株降解ZEN的效率下降至13.14%;100 ℃水浴2 h后,菌株的降解效率下降至8.31%。

图4 菌株不同活性成分对ZEN降解能力
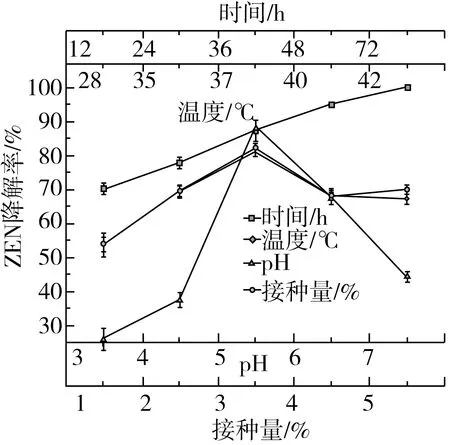
图5 温度、pH、接种量、时间对菌株降解效率的影响
2.7 G-6菌株降解ZEN的不同条件的影响
由图5可知,温度对菌株降解ZEN有一定影响,在28 ℃降解率最低,降解率为53.74%。随着温度的升高,在37 ℃降解率最高,降解率为81.19%。当温度继续升高至42 ℃时,降解率产生了下降,温度的升高或降低都会对降解率产生影响。可能是在不同温度的培养下,菌株的生长受到了一定抑制,使菌株活性下降,降解率也随之下降。
pH对菌株降解ZEN有显著影响,pH为3.0时,降解率最低,降解率为25.88%。随着pH的上升,降解率升高,pH为5.0时降解率最高,降解率为88.47%。当pH大于5时,降解率下降,pH的升高或降低都会对降解率产生影响。因此在pH为5.0时菌株能发挥最大的降解率。
接种量对菌株降解ZEN的能力有一定影响,接种量为1%~3%时,随着接种量的增加,降解率也增加,接种量为3%时降解率最高,降解率为81.98%。当接种量继续增加时,降解率出现了下降,接种量的升高或降低都会对降解率产生影响。可能是由于接种量太小,不能达到菌株活性的高度,但太多的接种量会消耗培养基里的营养物质,使菌株活性下降。
随着发酵时间的延长,菌株的降解率也随之增加。可能在前期ZEN抑制了菌株生长,使菌株活性低,但随着发酵时间的延长,菌株的活性逐渐上升,72 h在LB培养基中达到100%降解。
2.8 G-6菌株对不同原料中ZEN的降解
将温度、pH、接种量、时间调至优化值,在发酵72 h的不同饲料中ZEN含量的采用ELISA检测试剂盒测定,在72 h后,菌株能在可溶性淀粉、玉米粉、豆粕粉中达到100%降解。
2.9 G-6菌株的安全性实验结果
实验结果发现,2组小鼠的精神状态、采食量、饮水量、粪便均无异常,且没有出现死亡和发病现象。此外,将小鼠处死后观察发现小鼠脏器未出现任何异常变化,说明该菌株无毒性和致病性。
3 讨论
ZEN是最常见的真菌毒素之一,严重危害人类食品安全和动物饲料安全,筛选切实可行的办法降解ZEN对保障我国食品和饲料安全具有重要意义。一般在筛选降解菌株需注意:从样品上应选择发霉饲料、动物粪便和土壤去筛选,很多高效降解的菌株是在极端的生长条件发现的[17],由于菌株在极端条件下长期生存,经过大自然驯化,菌株产生了高耐受性,从而形成了有降解活性的微生物;从筛选方法上从培养基内加入ZEN或是结构相似的环戊酮为唯一碳源进行筛选,金博文等[18]以环戊酮为唯一碳源从粪便中筛选到了1株高效降解ZEN的多食鞘氨醇杆菌,为样品和方法上进行定性筛选提供了途径。本研究以ZEN为唯一碳源,从发霉饲料中筛选到了1株高效降解ZEN的解淀粉芽孢杆菌,37 ℃24 h内从培养基降解了81.19%的ZEN。
解淀粉芽孢杆菌为益生菌,关于益生菌降解ZEN已有报道。Ragoubi等[19]发现保加利亚乳酸菌在37 ℃24 h内从MRS培养基去除57%的ZEA;Keller等[20]发现酿酒酵母可在30 ℃2 d内清除培养基里90%的ZEN;耿海荣等[21]筛选出1株枯草芽孢杆菌在50 ℃36 h可降解93%的ZEN。本实验筛选到的解淀粉芽孢杆菌经条件优化后降解率均高于这些益生菌,由于菌种之间的差异性以及菌株之间不同的培养条件会影响菌株的生长活性,从而在降解率上表现出了不同差异,当菌株在生长环境适宜,营养条件充分的情况下,菌株生长活性高,才能充分降解ZEN。本研究对菌株在不同饲料原料中的降解进行了验证,调至各优化值在可溶性淀粉、玉米粉、豆粕粉降解了100%的ZEN,均高于Fu等[22]和潘丽婷等[23]筛选到的芽孢杆菌在玉米粉中去除ZEN的降解率,解淀粉芽孢杆菌可作为饲料添加剂去使用,以改善消化,增加营养吸收,优化动物的饲料效率,为维护动物机体健康提供了安全保障。
对上清液、细胞内容物、菌体细胞进行降解ZEN的研究,菌株上清液降解率均高于细胞内容物和菌体细胞,初步认为主要降解ZEN的活性物质是胞外酶。提取菌株胞外酶降解霉菌毒素已有报道,Qin等[24]从枯草芽孢杆菌克隆了染料脱色过氧化物酶,并在大肠杆菌中成功表达,重组的酶基因可降解多种霉菌毒素,王壬丰等[25]将粉红黏帚霉中的ZEN降解酶ZHD101成功在马克斯克鲁维酵母表达,并且能降解发霉玉米样本中的ZEN。虽然有些微生物能对霉菌毒素产生降解,但由于产生的降解毒性或菌株本身并不是国家认定的安全菌株,并不能直接投入到生产中去,然而它们提供的酶基因为预防霉菌毒素提供了另一种选择。
4 结论
本研究以ZEN为唯一碳源进行分离筛选,从发霉饲料里筛选出1株高效降解ZEN的菌株G-6,其降解率为81.19%。通过形态学和16S rDAN的鉴定,鉴定G-6为解淀粉芽孢杆菌。菌株主要通过胞外酶发挥降解作用,同时菌株细胞壁也有吸附作用。G-6菌株最佳降解ZEN的条件为:温度37 ℃,pH5.0,接种量3%,培养时间72 h。G-6菌株在终质量浓度为1 μg/mLZEN的可溶性淀粉、玉米粉、豆粕粉中达到100%降解,菌株的安全性实验证明本菌株无毒。

