玉米储藏过程中真菌群落结构的影响因素分析
岳晓禹, 郭明璋, 张天琪, 李长滨, 张 华, 许文涛
(河南牧业经济学院食品与生物工程学院1,郑州 450046) (北京工商大学食品与健康学院2,北京 100048) (中国农业大学营养与健康系3,北京 100091)
农作物在生长过程中经常受到真菌、细菌、病毒等病原体的侵染,其中真菌病原体所占的比例最大。尽管植物对某些真菌病原体具有免疫力[1],但真菌孢子很难被彻底消灭,容易残留在农作物表面,在适宜条件下可再次萌发[2],尤其是谷物类作物,在长期仓储过程中若环境条件未进行严格控制,孢子极易萌发造成真菌污染。谷物真菌污染后会产生黄曲霉毒素、赭曲霉毒素、玉米赤霉烯酮和脱氧雪腐镰刀菌烯醇等真菌毒素[3],若被人类直接食用,会导致肾毒性、肝中毒、生殖异常和免疫反应抑制,若被牲畜食用,也会通过食物链(牛奶,肉,鸡蛋)而间接进入人体,同样会对人体造成危害,因此真菌毒素污染的谷物无法被利用,造成严重的经济损失,并危害粮食安全。根据联合国粮农组织的调查,全球每年约有25%的谷物受到真菌毒素的污染。真菌毒素污染一旦发生便难以被完全脱除,预防真菌毒素污染的关键是防止谷物的真菌污染。
研究仓储谷物中真菌污染规律,建立谷物真菌污染在时间和空间上发生发展模型,是预防谷物真菌污染的有效方法。本研究团队在之前的研究中应用变性梯度凝胶电泳技术(Denaturing Gradient Gel Electrophoresis,DGGE)探究了玉米储藏过程中的霉菌群落时空分布特征[4],然而由于DGGE对真菌微生物群落图谱的分辨率有限,该研究不足以为模型建立提供足够的数据。近年来,高通量测序技术的出现使真菌群落的高分辨率图谱分析成为可能。高通量测序方法研究微生物多样性具有免培养,灵敏度高,准确率高等优势,已被广泛应用于各类样品的真菌群落研究中[5-11]。本研究将继续以仓储玉米为对象,采集中国两大粮食主产区(河南省和黑龙江省)的玉米样品,通过高通量测序技术以探讨不同产地、仓储时间、仓储位置、仓储深度等因素对真菌组成的影响,旨在为谷物真菌污染模型建立提供更有效的数据。
1 材料与方法
1.1 材料与试剂
玉米样品采自河南省和黑龙江省,样品编号及相关信息如表1所示。
PCR扩增采用Phusion超保真DNA聚合酶;高通量测序建库采用TruSeq DNA PCR-Free Library Preparation Kit试剂盒。
1.2 仪器与设备
KQ-250B超声波振荡器,H1850R低温高速离心机,聚合酶链式反应(PCR)扩增仪,高通量测序仪HiSeq2500 PE250。

表1 玉米样品编号及相关信息
1.3 方法
1.3.1 玉米中真菌基因组DNA提取
采用改良的十六烷基三甲基溴化铵(Cetyltrimethyl ammonium bromide,CTAB)法提取玉米的真菌[12-14]。具体提取方法与之前的文献中报道的玉米中真菌提取方法相同[4]。
1.3.2 PCR扩增及高通量测序
PCR扩增及高通量测序主要委托公司完成。具体方法为利用带有标签的ITS1区通用引物(ITS5-1737F:GGAAGTAAAAGTCGTAACAAGG和ITS2-2043R:GCTGCGTTCTTCATCGATGC)对样品真菌基因组DNA进行扩增。PCR产物使用2%琼脂糖凝胶进行电泳检测,根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用胶回收试剂盒回收产物。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用HiSeq2500 PE250进行测序。
1.3.3 生物信息学分析及统计分析
原始数据根据标签序列信息进行拆分,得到每个样品序列信息。序列经过去除标签序列、去除引物序列、序列拼合、去除低质量序列后,得到有效序列。有效序列利用QIIME软件[15,16]进行97%相似度的可操作单元(OTUs)聚类,代表序列提取,基于GreenGene数据库对代表序列进行注释,得到每个样品中每种OTU的序列数量。利用PAST软件[17]对每个样品中真菌群落OTU数据进行非度量多维尺度分析(NMDS),相似性分析(ANOSIM),Simpson多样性指数分析。利用Draw Venn Diagram在线工具对样品中真菌群落OTU数据进行韦恩图分析。利用在线分子生态网络分析工具(MENAP)[18]对玉米真菌群落中各物种的关联性进行分析。利用LDA Effect Size (LEfSe)[19]在线工具对不同组之间有显著差异的真菌种类进行分析。
2 结果与分析
2.1 仓储玉米的真菌群落组成的一般特征
高通量测序技术可以深入分析仓储玉米中真菌微生物群落的组成规律[20]。黑龙江和河南仓储玉米的真菌微生物群落组成均以子囊菌门(Ascomycota)和担子菌门(Basidiomycota)生物为主,除样品EN2013以外,其余样品中子囊菌门和担子菌门生物量占群落生物总量的比例均在97%以上(图1a)。粮食中常见的产毒素真菌如曲霉、木霉、青霉、镰刀菌等均属于子囊菌门或担子菌门,当这些产毒素真菌丰度升高时,仓储玉米被真菌毒素污染的风险也随之升高,因此控制仓储玉米中真菌群落的变化是减少仓储玉米真菌污染的有效方法。在属分类水平,从数量上看,镰刀菌属(Fusarium)、赤霉菌属(Gibberella)、念珠菌属(Candida)、球壳孢属(Sphaeropsis)是所有样品中平均丰度最高的属;从生态位上看,基于分子生态网络分析的结果显示仓储玉米真菌群里中木霉属(Trichoderma)、地丝霉属(Geomyces)、毛喙壳属(Chaetomidium)占据核心生态位位置(图1b),尽管这些微生物属在数量上并非最高,但可能与其他微生物种类有较强的物质或信号分子的交换,因此在仓储玉米真菌微生物群落中有更加重要的生态地位。
2.2 不同省份仓储玉米中真菌群落的比较
河南和黑龙江两地仓储玉米真菌微生物群落存在较大差异。在门水平上,如图1a所示,黑龙江仓储玉米(样品ES1~M3)子囊菌门生物所占比例更高(84.9%~99.6%),而担子菌门生物所占比例较低(0.3%~13.9%);河南仓储玉米(样品M2013~WN2014)担子菌门生物所占比例(16.2%~37.6%)显著高于黑龙江仓储玉米样品中担子菌门生物比例(图1A,P<0.05)。在属水平上,黑龙江仓储玉米中镰刀菌属、赤霉菌属、念珠菌属、枝孢菌属(Cladosporium)为丰度最高的微生物属,河南仓储玉米样品中念珠菌属、球壳孢属、侧耳属(Pleurotus)为丰度最高的微生物属。另外,从多样性上看,黑龙江仓储玉米样品中真菌微生物群落的多样性,从OTU数目、Simpson指数、Shannon指数指标来看,均高于河南样品中相应指数(图1c)。表明不同省份仓储玉米真菌群落可能存在较大差异,建立仓储玉米真菌群落模型,需考虑到仓储玉米所在地域的因素。
2.3 玉米储藏时间对其中真菌群落结构的影响
仓储玉米储藏年限一般为3~15年,储藏时间可能是影响仓储玉米真菌微生物群落结构的重要因素[21,22],尤其是仓储的前2~3年,是真菌微生物群落发生发展的关键时期。本研究比较了储藏2年的仓储玉米样品(M2014、EN2014、ES2014、WN2014、WS2014)和储藏3年的仓储玉米样品(M2013、EN2013、ES2013、WN2013、WS2013),结果表明,储藏2年的仓储玉米真菌微生物群落与储藏3年的仓储玉米真菌微生物群落具有明显差异,在NMDS图谱上(图2a),储藏不同年份的仓储玉米真菌微生物群落分别聚类,根据ANOSIM分析结果可知,这种差异聚类具有显著性(P<0.05)。另外,储藏3年的仓储玉米中微生物群落的在各样品间差异性更大,即β多样性更高。为了找出随仓储年份变化而丰度发生显著变化的真菌种类,对数据进行了LEfSe分析,结果如图2b所示,与储藏2年的仓储玉米样品微生物群落相比,储藏3年的仓储玉米样品微生物群落中,念珠菌属、毛霉属(Mucor)、Mrakia属的生物丰度更高,而青霉属(Penicillum)、篮状菌属(Talaromyces)、Meyerozyma属、肉座菌属(Hypocrea)、帚枝霉属(Sarocladium)以及3个未知属的生物丰度变低。存储时间是影响仓储玉米中真菌微生物群落结构的重要因素,微生物群落是动态演替的,在仓储的早期,收割或晾晒过程中的环境真菌附着在玉米表面,构成了仓储玉米的最初真菌群落,而随着仓储时间的延长,适于仓储环境条件和玉米营养组成的真菌丰度逐渐提高,导致真菌群落结构的整体变化,直至真菌群落结构趋于动态稳定。因此,玉米仓储时间对真菌群落组成的影响可能是真菌群落动态演替的表现。

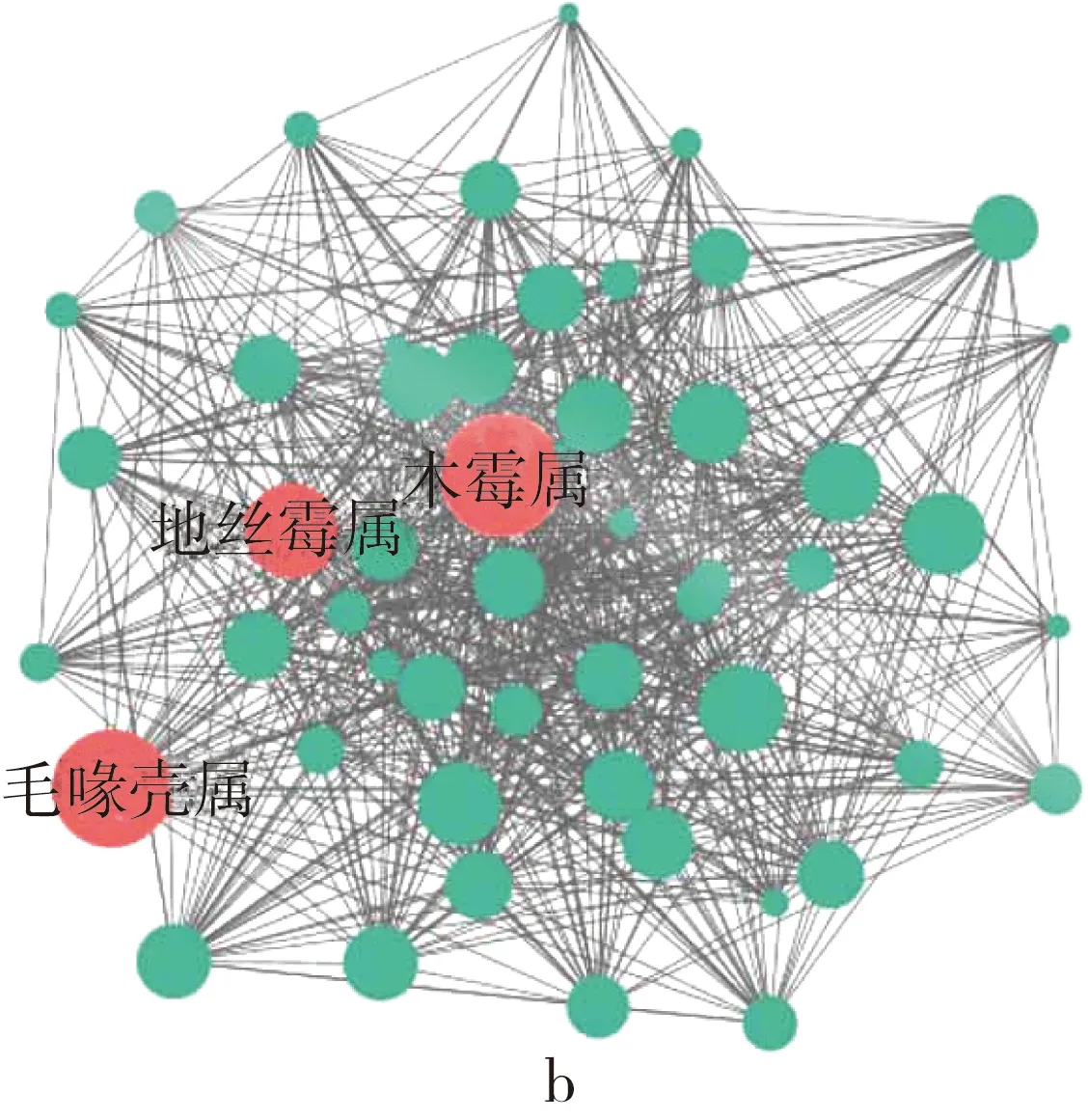

图1 仓储玉米中真菌群落结构的整体分析


图2 仓储玉米真菌群落的时间变化规律
2.4 玉米储藏深度对其中真菌群落结构的影响
仓储玉米通常会堆积放置以节省空间,这导致了不同堆积位置的玉米所处的环境条件(如氧气含量、温度、湿度等)有所差异。采集了堆积在表层(M1、ES1、EN1、WS1、WN1),中层(M2、ES2、EN2、WS2、WN2),深层(M3、ES3、EN3、WS3、WN3)的仓储玉米样品,比较其微生物群落结构的差异[19]。NMDS分析结果如图3a所示,整体而言,微生物群落在图谱上是随着采样深度而呈现梯度分布的,位于表层的样品微生物群落与中层、深层样品的微生物群落具有显著的差异聚类(ANOSIMP<0.05),但中层、深层样品的微生物差异聚类未达到显著水平(ANOSIMP=0.06)。差异菌群的热图分析也证实了这一点(图3b),样品聚类结果表明表层样品基本聚类在同一个分枝上,而中、深层样品分布较为分散。尾孢菌属(Cercospora)的样品在表层样品中的丰度更高,另外11个属在中深层玉米样品的丰度更高,这可能与这些微生物对含氧量、温湿度的偏好性有关。
2.5 玉米在粮库内储藏位置对其中真菌群落结构的影响
为了研究粮库内储藏位置对玉米真菌群落结构是否有影响,本研究从河南和黑龙江两地的仓库中分别取了位于仓库中部(命名中字母为M)、东南方位(ES)、东北方位(EN)、西南方位(WS)、西北方位(WN)的玉米样品进行真菌微生物群落结构分析。依据图2a和图3a的结果所示,相同的方位的样品并未发生在NMDS图谱上的聚集情况,这表明仓库中不同位置因素对玉米真菌群落结构的影响小于存储时间和存储深度2个因素的对玉米真菌群落结构的影响,这可能是由于储粮仓库中不同位置的环境条件比较均一所导致的。


图3 仓储玉米堆积深度对真菌群落的影响
3 讨论
微生物群落研究技术经历了培养法阶段、分子生物学技术阶段和高通量测序技术阶段,每次技术的革新都使研究者能够更加灵敏、准确地分析微生物群落组成。针对仓储玉米微生物群落结构特征,本团队也曾利用分子生物学技术中的梯度变性凝胶电泳技术进行研究,共得到了20种微生物的丰度图谱,而在本研究的高通量测序结果中,共得到了451个OTU的微生物丰度图谱。高通量测序技术的助力,使本研究结果的准确性得到了大幅度的提升。在基于梯度变性凝胶电泳技术的研究中,仓储玉米真菌群落的变化与储藏时间具有较强的相关性,而与其在粮库中的空间位置相关性较小,这一主要结论与本研究是基本一致的。在此基础上,本研究更精确地分析出11种微生物随储藏时间变化而发生显著变化,这是灵敏度较低的梯度变性凝胶电泳技术所难以实现的。
本研究的结果表明采样地域(省份)、储存时间和储存深度对仓储玉米中微生物群落具有较大的影响,而仓储玉米在仓库中的位置对仓储玉米微生物群落影响较小。因此在建立仓储玉米微生物群落的发生发展模型时,可以忽略仓库内部方位的因素,而将整个仓库视为一个整体,以时间和深度为主要参数进行建模,而在不同地域(省份),可能需要建立不同的数学模型来预测真菌微生物群落变化情况。另外,玉米样品初始入库时所携带的真菌孢子情况也可能会对真菌微生物群落具有重要影响,具体的影响规律有待于进一步的研究。
4 结论
仓储玉米的真菌微生物群落在门水平上以子囊菌门和担子菌门真菌为主,在属水平上以镰刀菌属、赤霉菌属、念珠菌属、球壳孢属真菌为主。不同省份仓储玉米真菌微生物群落存在差异,黑龙江仓储玉米中子囊菌门真菌所占比例更高显著高于河南省,而担子菌门真菌所占比例显著低于河南省。储藏时间、储藏深度等因素对仓储玉米中的真菌群落组成有较大影响,而粮库内储藏位置对仓储玉米中的真菌群落组成影响较小。

