基于网络药理学和生物信息学的长春新碱治疗乳腺癌分子机制研究
蒋正立 陈 静 夏爱晓 戴丹平
乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤。根据肿瘤的分期和患者身体状况,可采用手术、化疗、内分泌治疗、靶向治疗及中医药辅助治疗等多种手段,而化疗方案中常用药物有蒽环类、紫杉醇类以及长春新碱等。长春新碱(vincristine,VCR)治疗乳腺癌具有较好的临床疗效[1-3]。本文基于网络药理学和生物信息学方法,通过相关数据库筛选VCR 治疗乳腺癌的靶点,分析其生物学功能和作用信号通路,从而探讨VCR 治疗乳腺癌的分子作用机制。
1 资料与方法
1.1 长春新碱相关靶点预测 VCR 是夹竹桃科植物长春花中提取出的生物碱,以“Vincristine”及其结构为关键词,分别从Drugbank、Swiss Target Prediction、Stitch 数据库预测筛选VCR 相关靶点。
1.2 GEO 基因芯片数据分析乳腺癌相关靶点 从GEO(https://www.ncbi.nlm.nih.gov/geo/)数据库下载编号GSE29044 的基因芯片数据原始文件,采用Geo2r在线工具进行差异基因分析,以|logFC|≥2 和P<0.05为筛选条件进行筛选,绘制前50 个差异基因热图。
1.3 乳腺癌相关靶点获取 以“Breast cancer”为关键词,分别通过CTD(http://ctdbase.org/)和OMIM(http://www.omim.org/)数据库查找乳腺癌相关靶标。并与GEO 基因芯片数据分析得到乳腺癌相关靶点合并删除重复,即为乳腺癌疾病靶点。
1.4 VCR 治疗乳腺癌相关靶点PPI 网络建立及核心靶点获取 将预测得到VCR 靶点与乳腺癌靶点导入Venny 在线工具取交集,即为VCR 治疗乳腺癌相关靶点,导入String 数据库,建立VCR 治疗乳腺癌相关靶点PPI 网络,将结果导入Cytoscape3.7.1 软件,对网络进行拓扑学分析,筛选核心靶点。
1.5 GO 功能和KEGG 通路富集 为进一步阐明VCR 治疗乳腺癌相关机制,将VCR 治疗乳腺癌潜在靶点通过DAVID(https://david.ncifcrf.gov/)数据库进行GO 功能和KEGG 通路富集分析,并用Prism 软件和在线绘图站Ehbio 将结果绘制成柱状图与气泡图。
1.6 分子对接 采用分子对接方法研究受体蛋白EGFR、TP53、AKT1 与ACR 配体小分子之间的结合模式,以结合能≤-5.0 kJ/mol 为标准,评价VCR 与相关靶点结合作用。
2 结果
2.1 长春新碱作用靶点 从Drugbank(https://go.drugbank.com/)数据库中得到15个靶点,Swiss Target Prediction 数据库中获得10 个靶点,Stitch 数据库中获得100 个靶点,删去重复靶点,共得到124个VCR 作用靶点。
2.2 乳腺癌相关基因分析与检索 筛选出319 个明显影响和改变的差异表达基因,通过CTD 和OMIM数据库共筛选得到718 个疾病靶点。两者合并,删除重复,共得到1003 个乳腺癌靶点。
2.3 长春新碱治疗乳腺癌靶标分析共得到26 个(映射率为2.4%)VCR 治疗乳腺癌潜在靶标(图2),包括表皮生长因子受体(EGFR)、肿瘤抑制蛋白p53(TP53)、RAC-α 丝氨酸/苏氨酸-蛋白激酶(AKT1)、周期蛋白A2(CCNA2)、90kDa 热休克蛋白αA1(HSP90AA1)、雌激素受体基因(ESR1)、雷帕霉素靶蛋白(MTOR)、B 淋巴细胞瘤-2 基因(BCL2)、非受体酪氨酸激酶(SRC)、多药耐药性蛋白(ABCB1)等。
2.4 VCR 治疗乳腺癌相关靶点PPI 网络建立 通过String 数据库建立PPI 网络,包含26 个节点和133 条相互作用关系(见图2),进一步拓扑学分析,发现其中点度中心性(DC)、接近中心性(CC)和中介中心性(BC)大于均值(点度中心性=10.23,中介中心性=15.85,接近中心性=0.025)的关键节点有10 个,占总节点数的38.5%,其中度值前三为:表皮生长因子受体(EGFR)、肿瘤抑制蛋白p53(TP53)、RAC-α丝氨酸/苏氨酸-蛋白激酶(AKT1),提示它们在整个网络中发挥较为重要的作用。
2.5 GO 功能和KEGG 通路富集 采用DAVID 数据库对VCR 治疗乳腺癌潜在靶点进行GO 富集分析,共得到140 个显著条目(P<0.05),如图3 所示,包括生物过程95 个,主要涉及蛋白质自磷酸化、磷脂酰肌醇介导的信号传导等;细胞组成11 个,主要涉及质膜、磷脂酰肌醇3-激酶复合物、核等;分子功能34 个,主要涉及ATP 结合、一氧化氮合酶调节剂活性、激酶活性等。KEGG 富集结果共得到65 条显著通路(P<0.05),排名前20 条通路如图4 所示,主要涉及磷脂酰肌醇3 激酶/蛋白激酶B(PI3K-Akt)、表皮生长因子受体(ErbB)、缺氧诱导因子-1(HIF-1)等信号通路。
2.6 分子对接 采用分子对接的方法研究受体蛋白EGFR、TP53、AKT1 与ACR 配体小分子之间的结合模式。EGFR 与与VCR 配体小分子结合能为-7.66 kJ/mol,TP53 与VCR 配体小分子结合能为-7.89 kJ/mol,AKT1 与与VCR 配体小分子结合能为-5.07 kJ/mol,由此可见VCR 与三个靶蛋白结合能均小于-5 kJ/mol,表明具有较好的结合能力。见表1。
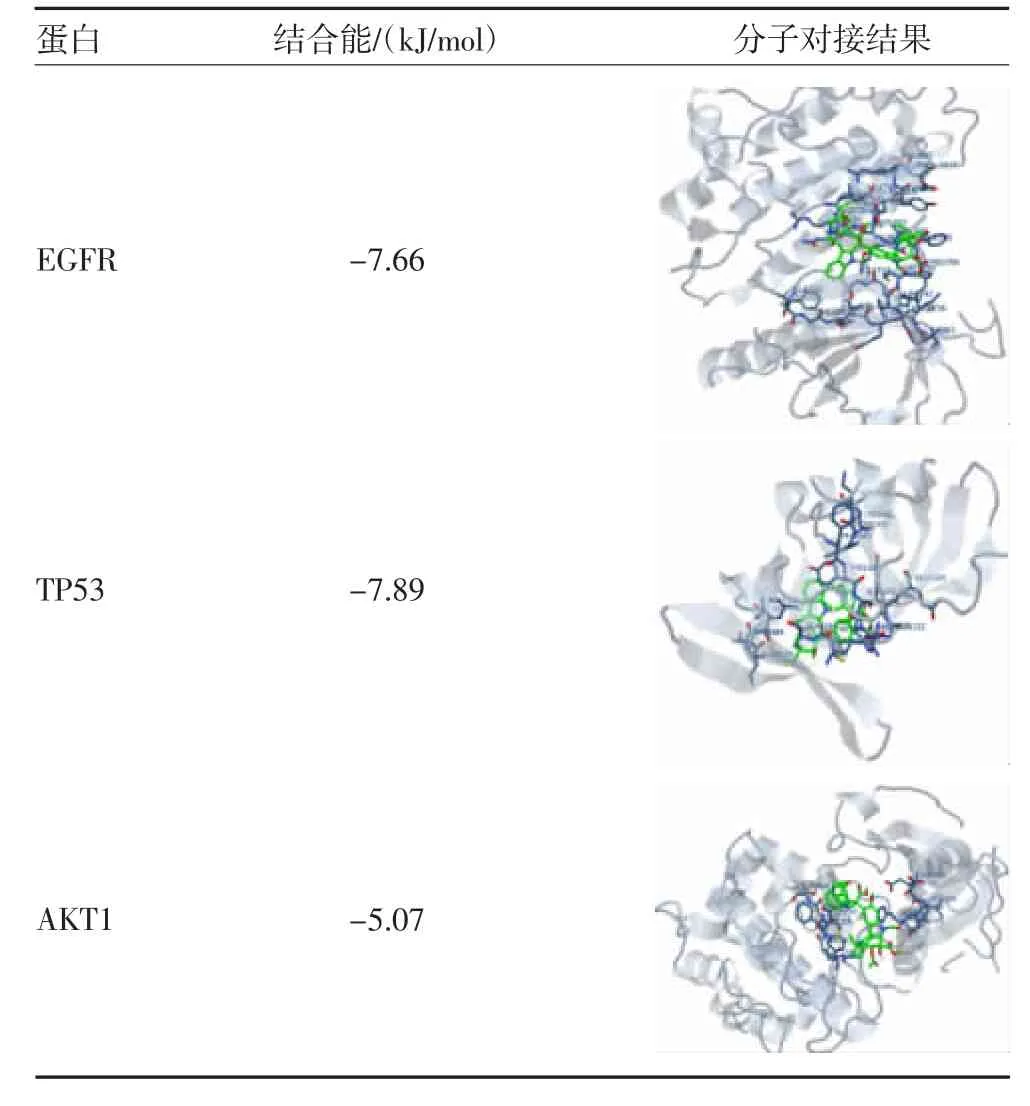
表1 长春新碱与核心靶点分子对接结果
3 讨论
近年来,从基础研究到临床观察多项证据显示,VCR 对于治疗乳腺癌显示了一定效果,不良反应未见升高,可改善患者的生存质量[4-5],特别是VCR新型给药系统的研究开发,如靶向制剂的研制,可降低VCR 毒副作用,提高治疗效果[6-8]。
本 文 从Drugbank、Swiss Target Prediction 及Stitch 数据库共得到124 个成分靶点,通过GEO 基因芯片数据、CTD 和OMIM 数据库共得到1003 个乳腺癌靶点,因此得到26 个VCR 治疗乳腺癌潜在靶标,建立PPI 网络进行拓扑学分析,获得关键节点10个,分别是EGFR、TP53、AKT1 等。同时,对前三个核心治疗靶点与VCR 进行分子对接,提示VCR 可能通过这些靶点起到治疗乳腺癌的作用。EGFR 靶点对肿瘤生长、发展以及肿瘤干细胞的维持有着非常重要作用,EGFR 表达与乳腺癌患者肿瘤大小、淋巴结转移、病理学分型相关[9-10],在三阴型乳腺癌中的阳性表达率最高[11],高表达也提示乳腺癌组织的恶性程度更高、侵袭性更强。TP53 能调节细胞周期和避免细胞癌变发生,VCR 作用于乳腺癌p53 靶点,mRNA 和蛋白水平升高[12],p53 参与乳腺癌的生物进程与信号通路,使其作为治疗乳腺癌的生物标志物和治疗靶点成为可能[13-14]。AKT1 参与多种生物学过程,在乳腺癌浸润进展过程中发挥重要作用[15],虽未见文献报道VCR 与此关键基因相关性,基于分子对接结果,很可能参与VCR 的体内作用效应机制。采用DAVID 数据库对VCR 治疗乳腺癌潜在靶标进行GO 功能和KEGG 富集分析,得到140 个显著条目和65 条显著通路,主要涉及PI3K-Akt、ErbB、HIF-1 等信号通路。PI3K-Akt 信号通路涉及细胞增殖、分化、凋亡等多种功能的调节,过度激活的PI3K-Akt 信号通路在乳腺癌的发生、发展中发挥重要作用,为治疗的新兴靶点。多个研究提示,PI3K-Akt 通路为治疗乳腺癌的潜在靶标[16-17]。以上的关键靶点如EGFR、AKT1 等可通过PI3K-Akt 通路,抑制细胞凋亡,VCR 可通过抑制PI3K-Akt 通路,可提高实体肿瘤对VCR 的敏感性[18-19]。ErbB 也是乳腺癌的一个重要分子标志物和治疗靶点,其异常激活可引起细胞生长增殖失控、恶性转化及肿瘤浸润转移[20],乳腺癌c-ErbB-2 阳性表达率较高,与淋巴结转移和肿瘤标志物水平相关[21]。HIF-1 也参与肿瘤细胞的增殖、对抗凋亡和耐药等重要过程[22],是VCR 治疗乳腺癌潜在靶点的信号通路,尚需实验验证。
综上所述,本研究筛选了VCR 作用靶点和乳腺癌靶点,得到VCR 治疗乳腺癌的靶点,分析了VCR治疗乳腺癌的生物学功能和作用信号通路,为进一步探讨VCR 抗乳腺癌作用分子机制及靶点提供思路。

