脐带血清促进牙髓干细胞增殖作用研究
谭金娣 姜建平 何佳英
骨组织工程技术就是将机体分离的扩干细胞(种子细胞)在体外进行培养、扩增,然后与细胞支架材料结合后再植入机体骨缺损部位,从而再生出新骨来修复骨组织缺损,其研究内容主要涉及以下三方面:(1)种子细胞来源;(2)生物载体支架选择;(3)微环境构建[1]。目前已证实的成体多能干细胞由非牙源性干细胞、牙源性干细胞两大类构成,其中牙源性干细胞由于具有很强的自我更新和分化能力,在实验研究和临床上被广泛使用[2]。研究显示,对牙源性干细胞施以体外特定诱导,其可向多种功能细胞分化[3-4]。而在体外研究中,细胞的体外培养、扩增、分化和冻存等一般都需使用含胎牛血清(fetal bovine serum,FBS)或小牛血清制品,外源性物质的加入,使得细胞在骨组织工程及临床应用中存在人畜共患疾病传播和免疫排斥的风险[5-6]。本研究旨在观察人脐带血清(umbilical cord blood serum,CBS)促进人牙髓干细胞(dental plup stem cell,DPSC)增殖作用,报道如下。
1 实验材料
1.1 材 料 实验所取离体牙为杭州市中医院口腔科19~29 岁健康成年人正常拔除的完整且无龋坏的第三磨牙;拔除后的牙放到培养瓶(内含5 倍双抗培养液)里,4 ℃温度下,密封存储。实验所需CBS 为杭州市中医院手术室内无菌条件下,抽取健康胎儿离体脐带中脐带血(未抗凝),并注入无菌玻璃瓶,放到培养箱(37 ℃)内静置备用。FBS 购于上海吉泰生物;本研究符合《赫尔辛基宣言》涉及人类受试者医学研究伦理原则。
1.2 试剂及仪器 胰酶(中国碧云天生物技术研究所),DMEM F/12 培养基(美国Hyclone 公司),培养板、培养皿(美国Corning 公司),塑料细胞培养瓶(美国Costar 公司),超净工作台(中国苏州净化设备厂),倒置相差显微镜(日本Olympus 公司),培养箱(美国Sheldon 公司),离心机(德国Hettich 公司)。
2 实验方法
2.1 分离培养人DPSC(1)有效清洁超净工作台,同时借助紫外灯实施0.5 h 杀菌处理。(2)打开超净工作台,打开上部通风开关用于将实验过程中产生的污染气体抽离。将离体牙于临时培养基(DMEM F/12 培养基)中取出,用酒精棉球擦拭牙体表明的血渍,去除牙体表面残存的牙周膜等软组织,将离体牙置于培养皿A 中。(3)通过无菌PBS 对培养皿A 内牙体组织进行冲洗,2 mL/次,共3 次。(4)将适量Ⅰ型胶原酶滴入另一个无菌的培养皿B 中(一般1 颗磨牙需1 mL Ⅰ型胶原酶)。(5)用灭菌的手排钻将离体牙纵向劈开(注意钻头不要碰到牙髓组织),暴露牙髓组织,用无菌眼科剪将根尖部牙髓组织剪掉并将剩余牙髓组织用无菌镊子置于培养皿B 中。(6)用眼科剪将牙髓组织剪碎(1 mm3/块)。(7)用一次性吸管将牙髓与Ⅰ型胶原酶混合液移入无菌离心管中,吹打混匀后密封。(8)将离心管放置于37 ℃水浴摇床中消化1 h。(9)取回消化的离心管,于超净工作台上用一次性吸管吸弃上清液,放入3~5 mL 的DMEM F/12 培养基,先经吹打使之充分混合,再管口密封,移至离心机内,设置为1000 r,作用5 min。(10)取回离心管,于超净工作台上用一次性吸管吸弃上清液,添加3~5 mL 内含20% FBS 的DMEM F/12 培养液,待吹打混匀,封管口,移至离心机内,1000 r 下计时5 min。(11)取回离心管,于超净工作台上用一次性吸管吸弃上清液,加入含有20% FBS 的DMEM F/12培养液5 mL,吹打混合后将组织悬浮液移入无菌培养瓶中。(12)将存有组织悬浮液的培养瓶置于培养箱中培养(37 ℃,5% CO2),观察细胞贴壁后每隔3 d换液1 次。(13)借助倒置相差显微镜查看细胞形态与数目,待培养瓶内细胞覆盖率达80%,用胰酶消化传代。
2.2 传代培养人DPSC(1)有效清洁超净工作台,同时借助紫外灯实施0.5 h 灭菌处理。(2)借助倒置相差显微镜查看细胞形态与数目,再移至超净工作台上,将其中培养基清除掉,用PBS 实施3 遍清洗。(3)向培养瓶里放入1~2 mL 胰酶,接着将此瓶移至培养箱里,停留0.5 min。(4)从培养箱内把培养瓶取出,借助倒置相差显微镜查看细胞形态,待其显示圆形,马上结束消化。(5)于超净工作台上,将胰酶清除掉,再放10 mL 含15% FBS 的DMEM F/12 培养液,接着借助吸管吹打贴壁细胞,使其脱落。(6)分别取两个新的无菌培养瓶,用吸管分别吸取5 mL 细胞悬液置于新的培养瓶中,再分别加入5mL 培养液。(7)再次置于培养箱里培养(5% CO2、37 ℃)。
2.3 人脐带血清(hCBS)制备 手术室内无菌条件下,抽取健康胎儿离体脐带中脐带血(未抗凝),并注入无菌玻璃瓶内,放到培养箱(37 ℃)内静置,计时120 min,待血凝块充分析出后,无菌环境中于超净工作台将血清移至离心管内,1000 g、4 ℃下,离心20 min,弃沉淀,仅留上清,-20 ℃保存。取部分血清做细菌、真菌、衣原体、支原体、乙型肝炎和丙型肝炎病毒、人类免疫缺陷病毒及梅毒、EB 病毒、巨细胞病毒等各项病原微生物测定,将各项测定结果皆显示阴性的人CBS 用做培养。使用前56 ℃水浴灭活30 min,存放于4 ℃下备用。
2.4 不同培养条件下的人DPSC 增殖能力(1)种板、接种细胞:取呈良好状态的第3 代DPSC,先在37 ℃温度下用胰蛋白酶(0.5%)消化,再借助倒置相差显微镜查看细胞形态,待其显示圆形,通过DMEM F/12 培养液(内含10%FBS)马上结束消化,弯头吹打,即得单细胞悬液。取细胞的第3 代以4×103个/孔接种在96 孔培养板中,实验分为四组,其中10%FBS培养DPSC 作为对照组,设置其余三组实验组。首先在四组中分别加入200 μL 的DPSC 单细胞悬液,待细胞贴壁生长后,对照组继续加10%FBS 培养,其他三组分别加入5%、10%、20% hCBS 继续培养。每板各浓度种6 孔,每孔体积200 μL。FBS 加入细胞的悬液外一圈,以确保湿度。置于5% CO2中过夜。(2)于37 ℃、饱和湿度、5% CO2时培养,测定的时间节点为1、3、5、7 与9 d,添加0.02 mL 的MTT 试剂,于37 ℃中进行4 h 孵育,将孔里培养基、MTT 试剂吸除干净,再每孔加入15 μL DMSO,作用10 min 后,将培养板放入脱色摇床振荡5~10 min,借助自动酶标仪检测各孔OD490 nm 值。(3)绘制细胞生长曲线,进行统计分析。
2.4 人DPSC 多向分化能力(1)取MTT 法得出增殖速度最快的一组第三代的DPSC 细胞。(2)成脂肪细胞诱导的培养液为50 μmol/L indomethacin 0.5 μmol/L isobutylmethylxanthine 和0.5 μmol/L dexamethasone,培养2 周。(3)用于诱导成软骨细胞的培养液是6 μg/mL Insulin,10 ng/mL TGF-β1,95 μmol/mL dexamethasone,37 mg/mL vitamin-C-phosphate,0.8 μM sodium Pyruvate,6 μg/mL 转铁蛋白,进行3 W 培养。(4)用以诱导OB 的培养液是5 mM β-glycerophosphate,50 mg/mL vitamin-C-phosphate 和2 mM Lglutamine,培养3 周。(5)Oil Red O 染色测定向脂肪细胞的诱导状况;甲苯胺蓝染色测定向成软骨细胞的诱导状况;Alizarin Red S 测定向OB 的诱导状。
2.5 流式细胞仪测定细胞表面标志物(1)取呈良好状态的第3 代DPSC,用PBS 行3 遍洗涤,通过胰酶消化为单细胞,再移入离心管(15 mL)内,待细胞显示圆形,用含10% CBS DMEM-F12 培养液立即终止消化,弯头吹打,配成单细胞悬液。(2)于1500 r/min 行15 min 离心,留存沉淀,PBS 洗涤3 次,分别取1×105个细胞悬液100 μL 加入6 支离心管中,其中1 支为对照组,其余分别加入抗体CD90、CD75、CD45、MSCA-1 和CD34,5 μL,轻晃,避光下放入4℃里1 h。(3)待取出,将2 mL 的PBS 直接加入,于1500 r/min 下离心,计时5 min,将未结合抗体清除掉,借助FCM 测定抗体表达量。
2.6 统计学方法 应用SPSS 19.0 统计软件,实验所得数据计量资料采用Shapiro-Wilk 法进行正态性检验,得出细胞计数服从正态分布(P 均>0.05),故采用均数±标准差()表示,多组间比较采用单因素方差分析(ANOVA),就各时间节点两组组间差异采用LSD 法进行比较,以P<0.05 认为差异有统计学意义。
3 实验结果
3.1 细胞培养结果 原代培养DPSC,待至第4 天发现细胞贴壁生长,到第7 天时,产生克隆细胞团,同时显示出典型性成纤维细胞(FIB)样形态。培养至第14 天,克隆细胞统一性更明显,可观察到平行分布的成纤维形态与长细胞突,待数目达到,开始传代。传代后,显示细胞快速增殖。见图1。
3.2 10% FBS 与不同浓度hCBS 促进DPSC 增殖能力比较 在横、纵轴参数为“时间”“OD 值”下,完成生长曲线的绘制。由此曲线可知,在培养时间增加下,DPSC 数量提高,同时于第3 天显示快速生长。四组DPSC 在第1~9 天内均呈现不同程度的生长状态,且呈线性增长,10% hCBS 组促进DPSC 增殖明显。见表1,图2。
表1 10% FBS 与不同浓度hCBS 促进DPSC 增殖能力比较(,n=24)
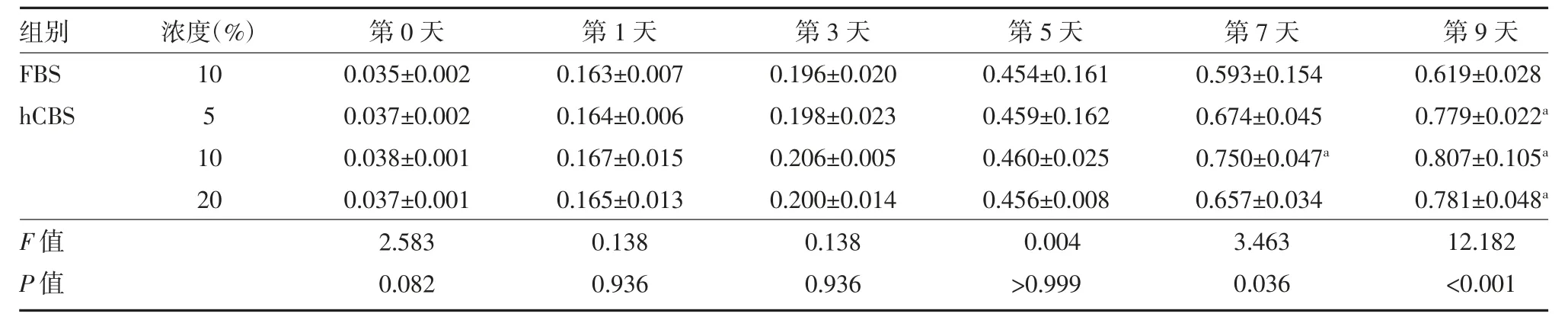
表1 10% FBS 与不同浓度hCBS 促进DPSC 增殖能力比较(,n=24)
注:FBS 为胎牛血清;hCBS 为人脐带血清;与10%FBS 组同期比较,aP<0.05
3.3 体外鉴定DPSC 多向分化能力 图3A 所示,DPSC 的成骨诱导3 W 后的矿化结节产生情况,可发现成功矿化。图3B 所示,经过2 W 的细胞成脂肪诱导培养,Oil Red O 染色得到中央为空泡的Fatcell。图3C 所示,经过3 W 细胞成软骨诱导培养的结果,甲苯胺蓝染色显示蓝色结节。
3.4 流式细胞仪鉴定 流式细胞技术检测显示,其中间充质干细胞CD90 抗体的阳性表达率74%,CD75 抗体的阳性表达率65%,MSCA-1 抗体阳性表达率0.5%。CD34、CD45 造血干细胞抗体阳性表达率<5%。见图4。
4 讨论
在细胞培养方面,FBS 的应用率最高,其可满足细胞诸多生物学行为的激素、生长因子与营养等生物活性物质所需。但其因可能存在安全、科学与伦理方面的问题,在临床应用中受限。主要采用动物血清的干细胞培养体系现今已极大阻碍到干细胞技术向临床转化,相关细胞疗法进行的基础为,一种无异种血清的人间充质干细胞(MSC)培养体系的构建[7]。由于hCBS 富含生长因子被推荐用来取代FBS。国内外均有研究,CBS 或血浆内富含细胞存活与生长必需的细胞因子,对骨髓或其他来源的人MSC 体外生长与增殖具促进作用[8-10]。结果发现,不同浓度的CBS促进DPSC 增殖的作用不尽相同,前期预实验研究证实CBS 对DPSC 增殖的促进作用具有浓度依赖性,体积分数1%~10%的CBS 明显提高DPSC 的增殖活性,其中10%CBS 组促进增殖能力最强。本研究通过用5、10 与20%浓度CBS 与10%FBS 培养牙髓干细胞对比可以得出,在1、3、5、7、9 d 的细胞周期中,DPSC 数量均有增加,并在第3 天呈快速生长,在整个细胞培养周期,体积分数5%、20%CBS 对DPSC的促增殖作用基本相同(P>0.05)。至中后期,在促进DPSC 增殖方面,高浓度CBS 组则有所下降,可见一定浓度区间内,DPSC 增殖活性和CBS 存在浓度依赖性表现,高浓度CBS 对DPSC 增殖具有抑制性。这可能和前者所含血清成分相关,血清所含的一些成分对血小板生长因子(PDGF)可能具抵抗效能。其中10%CBS 组与10%FBS 组比较,从培养第5 天起,CBS 比FBS 更能促进DPSC 增殖(P<0.05),而且经CBS 培养后的DPSC 在适宜条件的诱导下,DPSC 可较容易地完成向成骨细胞、软骨细胞、脂肪细胞的转化,体现出多向分化活性。
目前通常采用三类特征鉴定间充质干细胞:(1)体外培养贴壁生长,显示梭状。(2)条件适宜时可诱导得到成骨细胞、软骨细胞、脂肪细胞等。(3)免疫表型 :CD31、CD105、CD45、CD73、CD34、CD106、CD14与CD29 等[11-12]。同上述3 项相符的细胞即可认为所培养的细胞为间充质干细胞。本实验中CBS 体外培养体系获得的DPSC 具有间充质干细胞的一般生物学特性,细胞为典型的成纤维细胞样,呈漩涡状贴壁生长;体外扩增至四代,细胞形态不发生明显改变。将CBS 培养后的第三代DPSC 诱导培养,呈现出了不同分化能力,证明CBS 培养前后的DPSC 生物学特性并未改变。另外,实验采用阳性标记与阴性标记组合方式,对DPSC 展开鉴别,选择CD73、CD90、CD45 与CD34 和这4 类细胞表面抗原标志物,前两者可高表达,后两者则不表达。同时,有报道使用MSCA-1 作为选择分离间充质干细胞的有效标志物[12]。Tomlinson J 等[13]认为,MSCA-1 也是一种潜在的特异性标记牙髓干细胞的物质,并用MSCA-1 检测DPSC,得出MSCA-1 表达率1.2%。本研究中取培养的第三代DPSC,MSCA-1 表达率为0.5%。仍有待确定MSCA-1 是否为DPSC 特异性标志物。
综上所述,虽然FBS 是最常用于体外细胞扩增的血清,但它的动物来源限制了它的使用,尤其用于临床中时有较大争议。本研究结果表明,(1)CBS 可促进DPSC 增殖;(2)CBS 与FBS 培养相比较,10%CBS 在促进DPSC 增殖方面优于10% FBS;(3)CBS培养所得DPSC 存在多向分化活性;(4)借助FCM 检测CBS 培养所得DPSC 与干细胞表面标记特性相符。总之,CBS 可替代FBS 用于体外DPSC 扩增。因为脐血易于获取,操作简便,能够取代动物血清用于人间充质干细胞的分离培养,同时维持此细胞的生物学特性,与构建临床级人间充质干细胞扩增的条件相符,所以,现阶段依然是一类比较理想的非动物来源的血清补充物。

