2型糖尿病患者新型脂肪因子血清内脏脂肪素和内脏脂肪特异性丝氨酸蛋白酶抑制因子的表达水平与左心室肥厚的关系
马艺欣 张仲迎 佀思聪 罗鸿宇 赵 欢 杨 伟
(首都医科大学宣武医院老年医学综合科,北京 100053)
左心室肥厚(left ventricular hypertrophy,LVH)是2型糖尿病(type 2 diabetes mellitus,T2DM)患者常见的并发症之一。LVH会影响心肌的收缩和舒张功能,导致心肌收缩不同步,严重者可能会出现心力衰竭甚至心源性猝死[1]。目前有学者[2]认为,胰岛素抵抗、高脂血症和糖尿病肾损害等可能是T2DM诱发LVH的危险因素。但也有研究[3]显示,在调整了血糖控制情况、血脂水平、尿白蛋白排泄率和胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)等相关危险因素后,LVH仍然与T2DM密切相关。因此,探讨T2DM导致LVH的相关机制,有助于降低LVH在T2DM患者中的发病率,改善T2DM患者预后与生存质量。
内脏脂肪特异性丝氨酸蛋白酶抑制因子(vaspin)最早是由日本学者Hida 等[4]在2005年发现的一种脂肪因子,从 OLETF 大鼠(持续高血糖动物模型)的内脏脂肪中分离出来的,属于丝氨酸蛋白酶抑制剂 serpin 家族的新型脂肪因子,vaspin只在肥胖的 OLETF 大鼠白色内脏脂肪中特异性表达,在其他脂肪组织中,如皮下脂肪、棕色脂肪、非脂肪组织、 LETO 大鼠白色内脏脂肪中均未发现其表达。并且研究[5]还显示,vaspin 不在间质内皮、血管内皮细胞中表达,只表达在内脏脂肪组织的脂肪细胞中。vaspin与 T2DM、肥胖、胰岛素抵抗及炎性反应等关系密切,胰岛素抵抗会导致血清和脂肪组织中的vaspin浓度升高。Vaspin的分泌受多种因素的影响,既往vaspin相关研究[5]主要集中在肥胖及糖尿病相关的代谢综合征,之后逐渐转移至心血管系统疾病,但是,vaspin在代谢紊乱患者中的确切作用和潜在调节机制仍未明确,且vaspin是否与糖尿病人群的病理性心肌肥厚有关,目前还未有相关研究报道。
内脏脂肪素(visfatin)是一种由脂肪组织分泌的蛋白质因子,由Fukuhara等[6]在2005年首次发现。它是一种高表达于内脏脂肪组织的脂肪细胞因子,visfatin由内脏白色脂肪中的巨噬细胞释放,有类似胰岛素的生物学效应,可作为胰岛素受体的配体,参与机体的新陈代谢、炎症和应激反应。有文献[7]显示visfatin除了在脂肪组织中高度表达,在骨髓、肝脏和肌肉、心脏、胰腺和活化的淋巴细胞中也均有表达。近来的研究[8]显示,visfatin与冠状动脉粥样硬化性心脏病(以下简称冠心病)、糖尿病、急慢性炎性反应性疾病等多种疾病的发生过程有关。
目前血清vaspin和visfatin表达水平在合并LVH的T2DM患者中的研究较少。本研究通过检测LVH合并T2DM患者血清中vaspin和visfatin的表达水平,分析vaspin和visfatin与其他临床指标的关系,探讨vaspin、visfatin在T2DM诱发LVH过程中的作用和影响因素,为早期合并LVH的T2DM患者的诊治提供临床依据。
1 对象与方法
1.1 研究对象
本研究经首都医科大学宣武医院伦理委员会批准,伦理审批号:临研审[2018]112号,临研审[2022]140号。共纳入首都医科大学宣武医院老年医学科于 2017 年10月至2018年10月收治的93例T2DM患者,所有入组者已签署知情同意书。将其中确诊为LVH的45例患者作为病例组,未被诊断为LVH的48例患者作为对照组。
①入组标准:T2DM的诊断标准符合《中国2型糖尿病防治指南(2017年版)》[9]。②排除标准:I型糖尿病、糖尿病酮症酸中毒、合并恶性肿瘤、急性感染、中重度瓣膜心脏病、继发高血压、肝肾功能不全、严重心律失常、糖尿病肾病、伴有甲状腺功能亢进、甲状腺机能减退、肾上腺疾病、长期口服调脂药物或噻唑烷二酮类药物等。
1.2 资料收集及方法
(1)一般临床资料:身高、体质量、腰围(waist circumference,WC)、臀围、年龄、性别、合并疾病情况。
(2)实验室检查指标:空腹血糖(fasting plasma glucose,FPG)、空腹胰岛素(fasting insulin,FINS)、糖化血红蛋白(glycosylated hemoglobin type A1c,HbA1c)、超敏C反应蛋白(hypersensitive C-reactive protein,Hs-CRP)、血清C肽、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、同型半胱氨酸(homocysteine,Hcy)、尿酸(uric acid,UA)。使用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定血清vaspin和visfatin浓度。计算HOMA-IR,HOMA-IR=FPG× FINS/22.5。
(3)评估心脏结构:根据美国超声心动图学会(American Society of Echocardiography,ASE)的成人心腔定量评估指南[10]测定心脏相关指标,所有操作均由超声科高年资主治医师及以上进行。采用Devereux公式计算左心室心肌质量(left ventricular myocardial ,LVM)及LVM指数(LVM inden ,LVMI),以男性LVMI>115 g/m2、女性LVMI>95 g/m2为LVH的诊断标准。
1.3 统计学方法
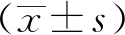
2 结果
2.1 病例组与对照组临床资料分析
病例组人群的平均年龄、合并冠心病比例、HOMA-IR、腰臀比(waist-hip ratio,WHR)、UA的浓度均高于对照组,HDL-C低于对照组,上述差异均有统计学意义(P﹤0.05),详见表1。
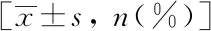
表1 2型糖尿病人群左心室肥厚的单因素分析
2.2 血清visfatin、vaspin的表达水平与左心室肥厚的关系
表2结果显示,病例组血清visfatin、vaspin浓度均高于对照组,差异有统计学意义(P<0.05),表明血清visfatin、vaspin的表达水平与左心室肥厚有关联。
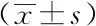
表2 两组血清visfatin、vaspin的表达水平对比
2.3 血清visfatin的表达水平与左心室肥厚的关系的多因素分析
以左心室肥厚为因变量,将上述单因素分析中T2DM合并LVH相关的因素(性别、吸烟、年龄、合并冠心病、HDL-C、visfatin、vaspin、UA、WHR和HOMA-IR)为自变量,进行多因素Logistic 回归分析。结果显示,在控制了其他干扰因素的作用后,血清visfatin浓度仍然与 LVH 有关联(P<0.05),但vaspin与LVH无关联(P=0.068),随着visfatin浓度升高,2型糖尿病患者左心室肥厚的危险性增大,此外冠心病是LVH的危险因素,HDL-C是LVH的保护因素,详见表3。

表3 血清visfatin的表达水平与左心室肥厚的关系的多因素分析
2.4 Visfatin与糖脂代谢指标的相关性分析
以糖脂代谢相关指标[FPG、BMI、HOMA-IR、TG、TC、HDL-C、LDL-C、载脂蛋白B(apolipoprotein B,APOB)、UA及WHR]为自变量,visfatin为因变量,进行Spearman相关分析,结果显示visfatin浓度与HOMA-IR(r=0.416)和UA(r=0.298)呈正相关;HDL-C(r=-0.305)与visfatin呈负相关(P<0.05),上述差异有统计学意义。详见表4。

表4 血清visfatin的表达水平与糖脂代谢指标的相关性
3 讨论
随着糖尿病发病率的增加,全世界糖尿病患者的数量将在2025年翻倍至3亿[11]。弗莱明翰(Framingham)心脏研究[12]结果显示,糖尿病将男性心血管疾病发生风险增至2倍,女性增至3倍。糖尿病的心脏并发症主要是冠心病和糖尿病性心肌病。有学者[13]提出,糖尿病可以通过引起糖脂代谢障碍、氧化应激、胰岛素信号转导异常、细胞膜电位及离子通道改变、微血管病变、自主神经病变及微RNA改变导致心肌细胞肥大、凋亡及间质细胞纤维化。T2DM患者左心室构型改变以向心性重塑为主,并与不良心血管事件有关,可能的机制为心肌的脂肪变性及能量代谢异常[14-15]。左心室心肌肥厚可以诱发心肌缺血、心律失常、充血性心力衰竭和心源性猝死[16-17]。因此,糖尿病人群的左心室结构和功能异常的初期检查变得尤为重要。
性别、年龄、BMI、血压、血糖、血脂等众多因素均可影响心脏结构和功能。在血糖水平正常的状态下,心脏收缩利用能量来源于葡萄糖和游离脂肪酸(free fatty acid,FFA)代谢。在高血糖水平,由于发生胰岛素抵抗抑制葡萄糖转运蛋白在心肌转录等因素,心肌的能量供应主要依赖于FFA生产底物[18]。糖尿病的“心脏代谢性重构”会导致心脏血管并发症,主要指异常的糖及脂质代谢引起心肌原本能量利用途径发生变化,使心脏构架和机械功能反常[19]。脂肪组织不仅仅是能量储存库,现在已经被看作是人体最大的内分泌器官,分泌多种被称为脂肪因子的蛋白因子,例如脂联素、抵抗素和vaspin等。脂肪因子作为新的心血管活性物质在心血管疾病的发病过程中扮演重要角色,参与多种生物功能调节,包括机体的免疫反应、糖脂代谢及炎性反应等过程。Visfatin是一种具有葡萄糖调节和促炎性反应特性的细胞因子,最初被确定为前B细胞集落增强因子,它在许多组织包括心脏和血管中表达[20]。临床研究[21-22]证明,visfatin可以促进炎性反应并加重动脉粥样硬化,是不稳定型心绞痛的炎性标志物。由于visfatin在炎性反应、血管损伤以及内皮功能紊乱等病理过程发挥着重要作用,提示其可能参与心肌肥厚及心脏衰竭发病过程。但目前visfatin对血管及心脏功能的影响仍尚有争议。有研究[23]显示冠心病患者腹部和心外膜脂肪组织的visfatin表达水平明显高于健康人,且visfatin浓度与心外膜脂肪厚度呈正相关。而在另一项研究[24]中在两组间的visfatin表达水平差异无统计学意义。目前visfatin在合并LVH的T2DM患者的研究亦不多见,因此血清visfatin是否能有效预测糖尿病心血管病的风险,成为评估T2DM合并LVH的标志物,仍是现阶段亟待解决的问题。
Visfatin与糖脂代谢密切相关,研究者[8]从visfatin的角度探索糖尿病及其慢性血管并发症的发病机制,本研究结果显示T2DM患者存在心脏功能及结构改变,且visfatin在T2DM合并LVH患者中的表达水平更高,说明两者可能在该病的发生、发展过程中起着至关重要的作用。目前关于visfatin表达与T2DM患者是否发生LVH的相关研究较少,具体机制尚不清楚。本研究中visfatin与糖脂代谢因素的相关性分析显示T2DM可以加速动脉粥样硬化,诱发心血管疾病。有学者[25]推测,T2DM患者在动脉高压发展的早期阶段,心脏血管的并发症与促炎性和反炎性的脂肪细胞因子之间的失衡表达有关,从而影响心脏结构和功能的变化。Visfatin 与靶细胞表面的胰岛素受体结合,通过受体酪氨酸亚基的磷酸化激活下游胰岛素信号通路(Erk-1/Akt 和 p38 MAPK),介导了 STAT3 信号通路介导增殖反应,并显著诱导炎症增加促炎细胞因子(白细胞介素-6、肿瘤坏死因子α )的水平[26]。依据先前的理论研究推断,Visfatin可能通过血管紧张素Ⅱ的协同作用促进心肌肥厚导致心脏功能改变[27]。而且本研究发现,T2DM合并LVH的人群在HDL-C的表达水平、胰岛素抵抗指数及是否合并冠心病等因素与无LVH的人群中存在差异。Visfatin与HDL-C呈负相关性。Visfatin在LVH人群中呈高表达状态,这与HDL-C恰好相反。HDL-C目前已被认为是心血管疾病的保护因子,且HDL-C的代谢与二氢尿嘧啶脱氢酶(nicotinamide adenine dinucleotide,NAD)密切相关,而visfatin是一种细胞内与NAD代谢相关的酶。Visfatin具有类胰岛素样作用影响糖脂代谢,这也提示在T2DM合并LVH人群中visfatin与脂质代谢之间存在着某种相关性。Visfatin也为T2DM合并LVH的发病机制研究增加了新内容。目前visfatin对于影响LVH的具体机制还有待于进一步探讨,它在与糖脂代谢及动脉粥样硬化等的关系上还需要进一步阐明。
本研究存在一些局限性,由于本研究为病例对照研究,尚无法明确相关因素的因果关系。且先前的研究[28]显示vaspin在糖代谢、肥胖及动脉粥样硬化中均有作用,而本研究显示T2DM患者vaspin浓度与LVMI无相关性,本研究目前样本量偏小,且为单中心研究,未进行随访,仍需扩大样本量和多中心进行反复检验。且在本研究中涉及到相关的自变量较多,虽已有较为严谨的排除标准,但不除外存在共线性可能。本研究提示HDL-C浓度、冠心病在T2DM合并LVH中相关,visfatin作为新型脂肪因子,未来的研究应聚焦于脂肪因子、心肌代谢产物的变化和动脉粥样硬化病理改变在合并LVH的T2DM患者中的变化和相关机制。
综上所述,本研究显示T2DM人群visfatin浓度与LVH关系密切,且HDL-C、冠心病及胰岛素抵抗等因素也参与其中,有可能visfatin通过影响糖脂代谢、心肌损伤、缺血等因素导致心肌细胞肥厚,进一步介导心肌重构。这为临床T2DM人群合并LVH的诊断、治疗提供了新的靶点和思路。
利益冲突所有作者均声明无利益冲突。
作者贡献声明马艺欣:实验、数据收集和论文撰写;张仲迎:论文把关和审订;佀思聪、罗鸿宇:数据的获取、提供与分析;赵欢:数据收集;杨伟:研究设计和论文指导。

