hERG1a突变H70R对hERG1a单源四聚体和hERG1a/hERG1b二源四聚体通道功能的影响
冯 莉 杨佳雪 李 新 贾长琪 蒋晨曦
(首都医科大学附属北京安贞医院心内科, 北京 100029)
先天性长QT综合征(congenital long QT syndromes, LQTs)属编码心肌细胞离子通道基因缺陷致心室复极延长的心电生理疾病,具有静息心电图QT间期延长、恶性室性心律失常发生、心脏结构正常及家族分布性和遗传倾向等特征。临床症状可表现为心悸、黑朦,典型心律失常发作时呈现尖端扭转性室速,可诱发晕厥和心源性猝死。自1995年首例LQTs致病基因突变位点发现以来,目前已确认致病基因17个,均为离子通道/通道复合体蛋白编码基因[1]。依据致病基因,LQTs临床上分为17型,其中LQT2最为常见,约占所有LQTs的35%~40%。相关致病基因KCNH2编码心肌细胞快速延迟整流钾离子通道(rapidly activating delayed rectifier K+channel, IKr)α亚基(the human ether-à-go-go-related gene,hERG),全长1 159个氨基酸,包含6个跨膜结构域、N末端和C末端两个细胞内结构域。传统观念认为Ikr结构为单源四聚体结构,通道主体由4个a亚基(hERG1a)构成(图1),目前相关致病突变功能学研究结果多源自hERG1a单源四聚体通道。
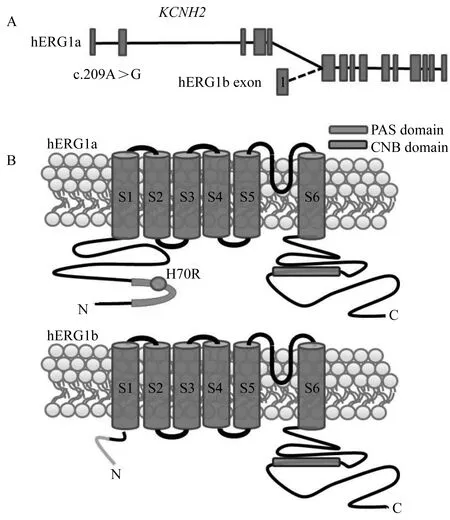
图1 KCNH2、hERG1a、 hERG1b结构简图
1997年,Lees-Miller等[2]和London等[3]同年分别证实了人、犬心肌中均存在KCNH2的其他转录本:hERG1b,提示组成IKr通道四聚体存在hERG1a/hERG1b二源四聚体可能。hERG1b转录起始于KCNH2外显子5与外显子6之间,形成特有hERG1b 外显子1,其氨基酸构成相对于hERG1a缺少其N末端340氨基酸[4-5](图1)。hERG1b的发现推动IKr通道结构研究进入另一个新的阶段。2008年,Sale等[6]通过体外共转染hERG1a/hERG1b,发现IhERG1a/hERG1b较IhERG1a通道在激活、失活后恢复以及灭活速度方面显著加快,更接近IKr生理特性;且hERG1b独有突变亦可致LQT2发生, 表明了hERG1b参与形成的二源四聚体对维持IKr生理功能的重要性。后续研究[7-8]相继证明了IhERG1a/hERG1b二源四聚体通道是人体心肌细胞IKr电流调控的重要靶点,并参与心力衰竭等病理过程中心律失常的发生。既往LQT2致病基因功能学研究多围绕hERG1a单源四聚体通道(IhERG1a),鲜有致病突变对hERG1a/hERG1b二源四聚体通道(IhERG1a/hERG1b)功能影响的研究。McPate等[9]对hERG突变N588K功能学的研究显示,该突变对IhERG1a和IhERG1a/hERG1b功能学影响存在差异,提示hERG突变相关研究,应同时考虑突变表达hERG1a/1b通道功能的影响。
KCNH2c. 209核苷酸位点 A>G杂合子错义突变,导致第70位密码子由组氨酸替换精氨酸(H70R),位于hERG1b缺失的340氨基酸内,hERG1a独有的PAS结构域内。已有研究[10-11]显示,H70R可导致IhERG电流密度下降,且可能加快通道灭活。因H70R属hERG1a特有突变,变异不影响hERG1b编码,对IhERG1a/hERG1b二源四聚体功能的影响尚不清楚。本研究旨在已有报道研究的基础上,进一步对H70R二源四聚体功能进行探讨,比较hERG1a特有突变对二源四聚体与单源四聚体功能的影响。
1 材料与方法
1.1 实验材料
DMEM 高糖培养基及胎牛血清(Gibco公司,美国);Lipo-fectamineTM2000 试剂(Invitrogen 公司,美国)。细胞内外液试剂(NaCl、KCl、CaCl2、MgCl2、D-glucose、HEPES、NaOH、EGTA、MgATP、KOH)(Sigma 公司,美国)。携带KCNH2 c. 209 A>G突变pcDNA3.1质粒及野生型KCNH2 cDNA的pcDNA3.1质粒(美国Wisconsin大学CMARP实验组赠予),Axopatch 700B膜片钳放大器(Axon公司,美国),Digidata 1322数模转换器(Axon公司,美国)。Sutter p-97微电极拉制仪(Sutter公司,美国),MF-830微电极抛光仪(Narishige公司,日本)。
1.2 突变诱导,载体表达
应用定点突变诱导试剂盒,对携带有野生型KCNH2 cDNA的pcDNA3.1进行c. 209 A>G突变诱导。突变诱导后进行DNA测序证实c. 209 A>G突变存在。采用脂质体转染技术,应用人胚肾(human embryonic kidney, HEK)293细胞分别转染入KCNH2(c. 209 A>G)突变型、野生型KCNH2-1a、KCNH2-1b质粒;应用pEGFP基因与目的基因共转染作为荧光指示剂。
1.3 全细胞膜片钳记录
在HEK293细胞瞬时转染后24~48 h,采用全细胞膜片钳记录细胞IKr通道电流,并分析通道功能。应用Axopatch 700B放大器记录通道电流;Digidata1322数模转化器对采集电流进行转换(采样频率 50 kHz,滤波 5 kHz);所有实验均在室温(20 ℃~24 ℃)下进行。以pClampex 10.0软件设计电压刺激程序、采集电流数据;设定钳制电压为-80 mV,在不同去极化电压-80~60 mV之间钳制4 s,以10 mV阶跃,使通道激活,记录通道激活电流; 阶跃后保持电压-50 mV持续5 s,记录尾电流。灭活曲线记录:钳制电压-80 mV,短暂去极化至+40 mV并自-40 mV~-110 mV以-10 mV阶跃获得不同激活电压尾电流。电极阻抗于2~4 MΩ。电流密度以电流值除以细胞电容得出。细胞外液(mmol/L):NaCl 135、KCl 5.4、CaCl21.8、MgCl21、D-glucose 10和HEPES 10,用NaOH液将pH值调至7.4,细胞内液(mmol/L): KCl 130、MgCl2l、HEPES 5、EGTA 10、MgATP 5,用KOH液将pH值调至7.2。
1.4 统计学方法
应用pClampex 10.0和Orgin 6.0软件拟合分析数据并绘图。稳态激活曲线应用Boltzmann方程拟合获得:I-V=Gmax×(V-Erev)/(1 + exp(V-V)/k),Gmax代表最大电导,Erev代表反转电位,V代表半激活电压,k为斜率因子。应用SPSS 11.5统计学软件进行数据分析,所有数据以均数±标准差表示,采用t检验或方差分析(组间两两比较采用Tukey检验),以P<0.05为差异有统计学意义。
2 结果
2.1 H70R突变对IhERG1a单源四聚体通道功能的影响
分别瞬时转染野生型hERG1a(WT)以及突变型hERG1a(H70R)质粒入HEK293细胞。利用全细胞膜片钳记录IhERG1a电流,结果显示,H70R突变型IhERG1a较野生型峰电流密度[(27.55±6.69)PA/PFvs(48.56 ±9.45)PA/PF]及尾电流密度[(24.09±7.08)PA/PFvs(60.46±9.19)PA/PF,P<0.001]显著降低约42%(图2)。稳态激活曲线分析显示IhERG1a(H70R)曲线较IhERG1a(WT)明显左移,统计分析结果显示,IhERG1a(H70R)显著降低半激活电压[IhERG1a(H70R): (-15.07±0.59) mVvsIhERG1a(WT):(-7.05±0.51)mV,P< 0.05],通道动力学参数详见表1。
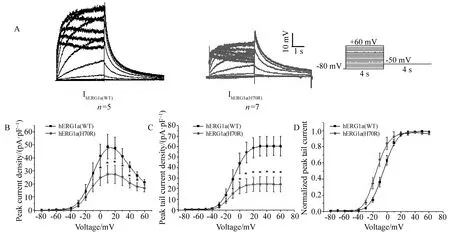
图2 HEK293细胞表达KCNH2 (H70R)正常对照电流图及I-V曲线
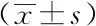
表1 hERG通道动力学激活/灭活参数
2.2 H70R突变对IhERG1a/hERG1b二源四聚体通道功能的影响
分别共转染野生型hERG1a(WT)/hERG1b及突变型hERG1a(H70R)/hERG1b质粒入HEK293细胞。全细胞膜片钳记录Ikr电流结果显示,突变型IhERG1a(H70R)/hERG1b较野生型IhERG1a(WT)/hERG1b峰电流密度[(44.31±15.24) PA/PFvs(130.41 ±13.75) PA/PF)]及尾电流密度[(42.07 ±12.42) PA/PFvs(97.10 ±7.28) PA/PF])显著降低约61%(图3)。稳态激活曲线分析显示突变型IhERG1a(H70R)/hERG1b较野生型IhERG1a(WT)/hERG1b通道左移,半激活电压显著下降[(-15.14± 0.72) mVvs(-8.77±1.36) mV]。
图3 HEK293细胞表达KCNH2 (H70R)及正常对照 hERG1a/1b二源四聚体通道电流图及I-V曲线
2.3 H70R突变对IhERG1a与IhERG1a/hERG1b灭活动力学研究
应用全细胞膜片钳记录IKr灭活曲线(图4A),结果显示,H70R对IhERG1a与IhERG1a/hERG1b灭活速度无显著影响,快速及缓慢灭活时间常数差异无统计学意义。IhERG1a/hERG1b较IhERG1a灭活速度显著加快,快速及缓慢灭活时间常数显著缩短(图4B,C,D)。

图4 HEK 293细胞表达hERG通道灭活电流曲线
3 讨论
LQT2是最早发现的LQTs之一,已有超过200个以上KCNH2突变证实与LQT2发病相关,我国目前报道LQT2相关KCNH2突变10余个[12]。致病突变往往影响IKr功能,通过负显性效应或单倍体不足最终导致患者心肌细胞IKr电流减弱,复极时间延长而致病。目前LQT2发病机制归纳为四类:(1)突变影响hERG1转录/翻译,至IKr表达减少,电流减弱。(2)突变影响蛋白结构,无法转运至细胞膜,滞留并降解于内质网;(3)突变造成通道动力学障碍,直接导致电流减弱;(4)突变致通道对钾离子通透性降低,电流减弱[13]。约40%的LQT2相关突变属于无意突变、移码突变、插入、缺失或形成截短蛋白影响hERG合成或翻译属于1类机制。错意突变占LQT2已知突变的约60%,往往通过改变hERG单个氨基酸造成hERG转运障碍或通道动力学改变致病,属2,3,4类机制。
IKr为单源/二源四聚体结构,通道主体由4个a亚基(hERG1)构成。其全长转录本hERG1a含有1 159个氨基酸,包含6个跨膜结构域以及N末端、C末端2个细胞内结构域。N末端含有PerArntSim结构域(PASD)并含有PAS帽,形成EAG钾通道所特有的保守“EAG”结构域[14]。C末端包含环核苷酸结构域(cyclic-nucleotid-binding-domain,CNBHD),以及C 末端内质网滞留信号结构域(ER retention signal,RXR)和卷曲螺旋结构域(coiled-coil,CCD)。
目前对PAS结构域突变致病机制尚存在争议,1999年Chen等[10]对8个PAS结构域突变(F29L、 N33T、 G53R、 R56Q、 C66G、 H70R、 A78P、 L86R)利用爪蟾卵母细胞进行体外表达,全细胞膜片钳研究结果提示,8个突变(包括H70R)均显著加速IKr电流灭活,部分突变同时减慢了IKr失活后恢复速度,从而认为PAS结构域功能参与调节IKr灭活速度。2011年, Gianulis 等[11]应用HEK293细胞表达体系对11个PAS突变的膜片钳研究结果显示,包括H70R在内的3个突变致病机制为HERG转运障碍,对IKr通道灭活速度无影响。同样作为IKr的a亚基hERG1a和hERG1b最大区别之处即为是否含有PAS结构域, hERG1b全长890个氨基酸,缺少N末端PAS结构域。IKr单源四聚体与二源四聚体最主要不同为PAS数量,hERG1a单源四聚体含有4个PAS结构域,hERG1a/hERG1b二源四聚体可含1~3个PAS结构域。PAS结构域具有高度保守特点,其功能学研究一直是IKr功能的重点[15]。本研究突变H70R位点位于PAS结构域内,因此推测H70R可能仅导致hERG1a异常,进而出现IKr单源四聚体与二源四聚体功能的改变不同。且已有研究[9]显示,HERG突变对IKr单源四聚体与二源四聚体功能影响存在不一致性。因此本研究进一步比较了已知hERG1a突变H70R对hERG1a单源四聚体及hERG1a/hERG1b二源四聚体通道功能改变的影响。
结果显示,H70R可显著抑制IhERG1a及IhERG1a/hERG1b峰电流及尾电流密度;对IhERG1a/hERG1b电流抑制程度更为显著。H70R可使IhERG1a及IhERG1a/hERG1b稳态激活曲线左移,均显著降低半激活电压。对IKr灭活功能分析结果显示,hERG1a(H70R)对IhERG1a及IhERG1a/hERG1b灭活无显著影响,而IhERG1a/hERG1b较IhERG1a灭活显著加快。与既往研究相比,本研究结果显示,H70R并不加快hERG1a单源四聚体灭活,与Gianulis 等[11]报道一致,支持H70R致LQT2机制为转运障碍。进一步对hERG1a/hERG1b二源四聚体功能的研究显示,H70R对IhERG1a/hERG1b与IhERG1a功能的改变趋势一致,但更显著抑制IhERG1a/hERG1b电流密度(61%vs42%;P<0.001),此结果是对H70R致LQT2机制的重要补充。本研究的局限性在于体外转染HEK293细胞不能准确表达hERG1a与1b的生理状态比例,无法精确控制表达探索杂合状态H70R对HERG二源四聚体功能的改变,这也是异源表达系统的局限性限制。2006年人类多能诱导干细胞衍化成功奠定了建立自体细胞模型的基础,LQT1、 LQT2 hiPSC-CMs模型功能学研究结果先后被报道,证实了患者特异hiPSC-CM LQTs模型在表型模拟和机制研究中的可靠性[16-17],包括药物治疗和进一步功能探索也有进展[18-19],望今后能通过同源表达系统进一步明确此机制。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明冯莉: 研究设计,主要膜片钳实验,论文撰写; 杨佳雪: 细胞培养,转染, 参与论文撰写投稿; 李新: 基因信息检索, 细胞培养; 贾长琪: 临床咨询, 论文撰写; 蒋晨曦: 研究设计, 论文撰写。

