一种鸡抗猪丁型冠状病毒阳性血清的制备方法
李晶梅,张飞雁,王焕君,柏 娇,于义娟,王碧群,朱 薇,郑良益,李婷婷,冯 钊,石宝兰,漆世华,谢红玲
(国药集团动物保健股份有限公司,武汉 430075)
阳性血清是免疫学方法鉴定病原体的重要生物材料,可应用阳性血清建立中和实验、琼扩、血凝、ELISA、胶体金等方法鉴定病原体并诊断疫病[1]。阳性血清还是兽用生物制品质量控制所需的重要生物材料。用阳性血清中和毒种、活疫苗中的活病毒,再接种生物组织,从而对毒种、活疫苗做鉴别检验和外源病毒检验,监控疫苗产品质量。猪病种类多,仅病毒病就包括猪瘟、猪繁殖与呼吸障碍综合症、猪伪狂犬、猪圆环、猪口蹄疫、猪传染性胃肠炎、猪流行性腹泻等,针对不同疫病需制备相应的阳性血清用于疫苗质量控制。
虽然科研人员常用猪[2-4]、羊[5-6]、兔[7-9]制备猪病阳性血清,但赵华娥用鸡制备猪流感阳性血清也获得了成功[10],并且用鸡制备鸡病阳性血清[11-13]有诸多成功经验可供借鉴。本研究尝试用SPF鸡制备猪丁型冠状病毒(PDCoV)阳性血清,为鸡制备猪病阳性血清积累经验。
1 材料和方法
1.1 毒种、细胞 猪丁型冠状病毒(PDCoV)、PK1细胞,由国药集团动物保健股份有限公司保存。
1.2 实验动物 3~4周龄SPF鸡,购自北京梅里亚维通实验动物技术有限公司。
1.3 主要试剂 DMEM培养基、胎牛血清,为BI公司产品;胰液素(3.75 mg/mL)、BEA、FITC标记的兔抗鸡抗体,为SIGMA公司产品;胰酶,为Solarbio 公司产品;注射用白油,为道达尔公司产品;司本-80,吐温-80,购自上海浩鼎贸易有限公司。
1.4 疫苗制备
1.4.1 PDCoV抗原制备 用细胞生长液(DMEM培养基+7%胎牛血清+终浓度100单位双抗)将PK1细胞培养至单层。换病毒维持液(DMEM培养基+终浓度10 μg/mL胰酶、1%胰液素、100单位双抗),接种PDCoV,当出现80%细胞病变时,收集细胞培养上清,超滤浓缩至原体积的1/10,加入终浓度5 mmol/L的二乙烯亚胺(BEI,BEA加NaOH环化获得)37 ℃灭活24 h,无菌检验、灭活检验合格后备用。
1.4.2 水相制备 取PDCoV抗原96份,向其中加入灭菌吐温-80 4份,充分搅拌,直到吐温-80完全溶解。
1.4.3 油相制备 取注射用白油94份,向其中加司本-80 6份,加热、搅拌至混合均匀,高压灭菌。
1.4.4 疫苗制备 水相与油相1∶2混合,在剪切机中以10000 r/min乳化10 min,制备成油包水型疫苗。
1.4.5 检验 参考《中华人民共和国兽药典》2020年版三部附录[14]方法对疫苗的外观、剂型、黏度、稳定性、纯净性(无菌)进行检验,检验合格备用。
1.5 免疫、采血 疫苗免疫3~4周龄SPF鸡10只,0.5 mL/只。每间隔2周或适当时长加强免疫一次,剂量同首次免疫。颈背部皮下、胸部肌肉、腿部肌肉交替接种疫苗。收集免疫前的鸡血清,一免、二免、三免…后14 d或适当时长的每只鸡的血清,作为被检血清。
1.6 检测 按1.7项方法分别检测被检血清中和效价,计算鸡血清中和抗体的几何平均值。选择中和效价较高的血清混合,作为阳性血清;免疫前的鸡血清混合,作为阴性血清。按1.8项的IFA方法将血清用于检测PDCoV;检测阳性血清对猪传染性胃肠炎、猪流行性腹泻中和效价;IFA方法检测阳性血清与猪瘟、猪繁殖与呼吸障碍综合症、猪伪狂犬、猪圆环、猪细小、猪传染性胃肠炎、猪流行性腹泻是否存在特异性结合。
1.7 中和效价测定 参考《中华人民共和国兽药典》2020年版三部中和试验法[14]建立如下PDCoV中和效价测定方法。
1.7.1 准备中和用病毒 将PDCoV用病毒维持液稀释至100 TCID50/0.1 mL。
1.7.2 准备被检样品 用DMEM培养基将阴性血清、被检血清4倍系列稀释。将适宜稀释度的血清分别与1.7.1项100 TCID50/0.1 mL 的PDCoV等体积混合,37 ℃中和1 h。
1.7.3 稀释中和用病毒 将1.7.1项PDCoV用维持液做10倍系列稀释,即100、10-1、10-2、10-3稀释待用。
1.7.4 测定 96孔板中长成单层的PK1细胞,弃去细胞生长液。各孔加入0.1 mL DMEM培养基,弃去。1.7.2项各稀释度被检样品接种PK1细胞,每个稀释度接种6孔,0.2 mL/孔;1.7.3项各稀释度的中和用病毒接种PK1细胞,每个稀释度接种6孔,0.1 mL/孔;同时设置正常PK1细胞对照6孔,加入维持液,0.1 mL/孔。37 ℃、5% CO2培养箱孵育1 h,弃去孔内溶液,加入维持液0.1 mL/孔。37 ℃、5% CO2培养箱培养3 d判定结果。
1.7.5 判定结果 中和用病毒为30~300 TCID50/0.1 mL,正常细胞对照健活,试验成立。记录各稀释度无细胞病变孔数,按Reed-Muench法计算其半数保护量(PD50),计算各时间点PD50的几何平均数,PD50几何平均数的对数为平均中和效价。
1.8 IFA检测PDCoV
1.8.1 准备细胞 96孔板中长成单层的PK1细胞,弃去细胞生长液。各孔加入0.1 mL DMEM培养基,弃去。
1.8.2 接毒 将PDCoV用病毒维持液稀释至50 TCID50/0.1 mL,接种1.8.1的细胞,0.1 mL/孔。同时设置正常PK1细胞对照,加入维持液,0.1 mL/孔。37 ℃、5% CO2培养箱孵育1 h,弃去孔内溶液,加入维持液0.1 mL/孔。37 ℃、5% CO2培养箱培养3 d用于IFA检测。
1.8.3 IFA检测 阴性、阳性血清用PBS做10倍系列稀释,阴性血清10-1、10-2,阳性血清10-2、10-3、10-4、10-5稀释待用。1.8.2项中培养3 d的96孔板,80%丙酮固定,PDCoV感染孔、正常PK1细胞孔分别加入稀释的阴性、阳性血清,0.1 mL/孔,37 ℃孵育1 h,PBS洗3次,加FITC标记的兔抗鸡抗体,37 ℃孵育1 h,PBS洗3次,荧光显微镜下用蓝色激发光(波长490 nm)观察。有完整的细胞形态并发出特异性绿色荧光的视为IFA阳性孔。
2 结果与分析
2.1 抗原制备及检测 用PK1细胞扩繁PDCoV抗原约1 L,经测定其病毒含量为108.3TCID50/mL。将PDCoV抗原超滤浓缩至100 mL,加入0.2 mol/L的BEI 2.5 mL,37 ℃灭活24 h,加入1 mol/L的Na2S2O3溶液0.5 mL中和BEI。将灭活后的抗原接种PK1细胞并盲传1代,未见细胞病变,判定抗原灭活完全;将灭活后的抗原做无菌检验,各培养基均无菌生长,说明超滤浓缩可保证无菌。
2.2 疫苗制备及检验 100 mL水相与200 mL油相混合,乳化后获得300 mL疫苗。疫苗外观为乳白色乳剂、剂型为油包水型、粘度为65.8 cP、稳定性为10 mL疫苗经3000 r/min离心15 min未见分层且管底无水相;将疫苗做无菌检验,各培养基均无菌生长。说明疫苗质量合格,可用于免疫实验鸡。
2.3 免疫、采血 结合中和效价检测结果确定免疫时间、免疫次数、采血时间,实际免疫程序见表1。每次免疫后14 d采血,四免后35 d、四免后52 d、五免后44 d采血。

表1 免疫程序Tab 1 Immunization procedure
2.4 血清中和效价 表2结果显示,免疫前血清(阴性血清)有“中和效价”,平均为14.32,分析是因为血清中和了维持液中的胰酶、胰液素使PDCoV失去感染细胞的能力产生了“中和效价”。免疫前血清最高PD50为2.5 log4,说明PD50>2.5 log4的免疫后血清为特异性中和。血清中和效价随免疫次数增加逐渐增高,四免14 d血清平均中和效价高于1000,五免后未见显著增加。四免、五免14 d效价达到高峰后下降。
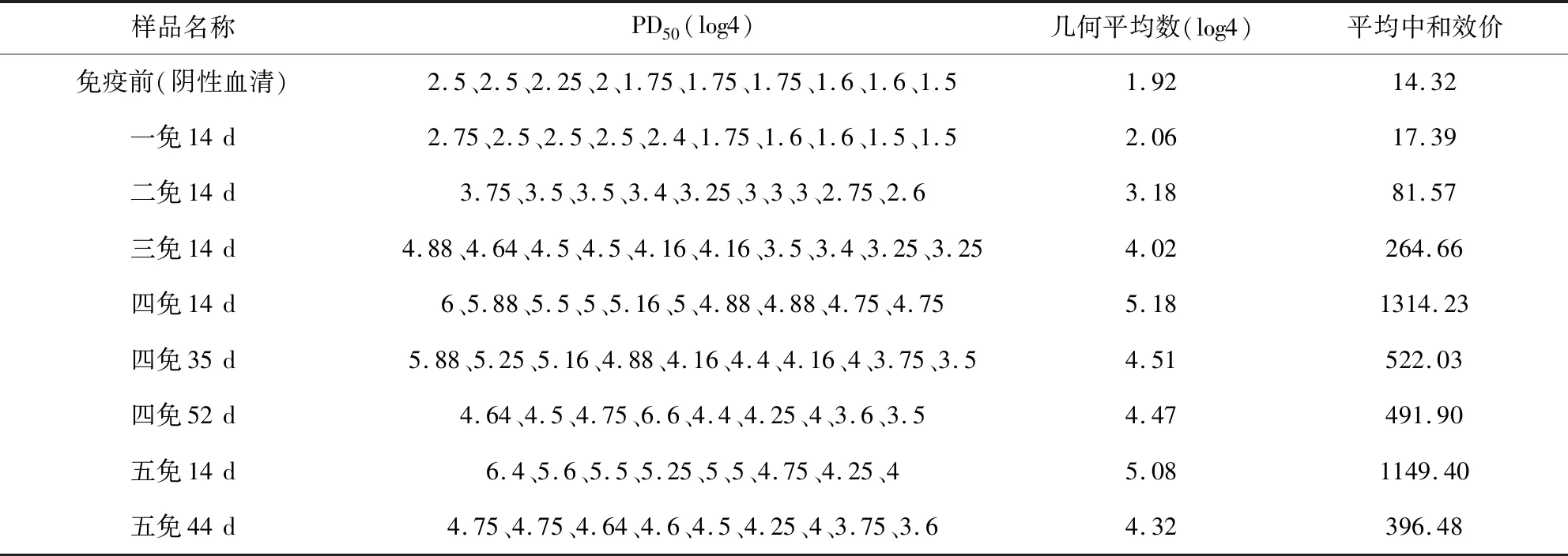
表2 血清中和效价Tab 2 neutralization titer of the sera
2.5 IFA检测PDCoV 四免14 d效价为4.88 log4~5.16 log4的5份血清混合作为阳性血清用于IFA检测PDCoV。阴性血清与PDCoV、PK1细胞有非特异性反应,10-1有淡绿色荧光(图1A、B),但10-2无可见荧光(图1C、D)。PDCoV与PK1细胞用10-2、10-3、10-4稀释的阳性血清检测,PDCoV明显比PK1细胞更亮(图1E、F、G、I、J、K),PDCoV是特异性荧光,判为阳性孔;PDCoV与PK1细胞用10-5稀释的阳性血清检测,均无特异性荧光(图1H、L)。鉴于10-3阳性血清检测PDCoV可见明亮的特异性绿色荧光并完整展现细胞形态,将其定为本批血清IFA检测PDCoV的最适稀释度。

A、B:PDCoV、PK1细胞,阴性血清10-1稀释;C、D:PDCoV、PK1细胞,阴性血清10-2稀释;E~H:PDCoV,阳性血清10-2~10-5稀释;I~L:PK1细胞,阳性血清10-2~10-5稀释A/B:PDCoV/PK1 cells,10-1diluted negative serum;C/D:PDCoV/PK1 cells,10-2diluted negative serum;E~H:PDCoV,10-2~10-5diluted positive serum;I~L:PK1 cells,10-2~10-5diluted positive serum图1 IFA检测PDCoV(100×)Fig 1 Detection of PDCoV infection by IFA(100×)
2.6 特异性检验 PDCoV阳性血清对猪传染性胃肠炎、猪流行性腹泻中和效价,均低于最低检测值(<1∶16)。IFA检测,PDCoV阳性血清对猪瘟病毒(CSFV)感染的ST细胞、猪繁殖与呼吸障碍综合症病毒(PRRSV)感染的Marc145细胞、猪伪狂犬病毒(PRV)感染的ST细胞、猪圆环病毒2型(PCV2)感染的PK15细胞、猪细小病毒(PPV)感染的IBRS-2细胞、猪传染性胃肠炎病毒(TGEV)感染的ST细胞、猪流行性腹泻病毒(PEDV)感染的Vero细胞无特异性反应(图2)。
3 讨论与结论
3.1 PDCoV阳性血清的应用 PDCoV感染可引起仔猪呕吐、腹泻等症状[15-16],严重影响猪群的生长发育。PDCoV阳性血清可在ELISA、IHC、IFA等检测方法中应用[17-19],从而建立猪丁型冠状病毒病的诊断方法。

A:CSFV-CSFV单抗;B:CSFV-PDCoV阳性血清;C:PRRSV-PRRSV单抗;D:PRRSV-PDCoV阳性血清;E:PRV-PRV单抗;F:PRV-PDCoV阳性血清;G:PCV2-PCV2单抗;H:PCV2-PDCoV阳性血清;I:PPV-PPV单抗;J:PPV-PDCoV阳性血清;K:TGEV-TGEV单抗;L:TGEV-PDCoV阳性血清;M:PEDV-PEDV单抗;N:PEDV-PDCoV阳性血清A:CSFV- McAb of CSFV;B:CSFV- positive serum of PDCoV;C:PRRSV- McAb of PRRSV;D:PRRSV- positive serum of PDCoV;E:PRV- McAb of PRV;F:PRV- positive serum of PDCoV;G:PCV2- McAb of PCV2;H:PCV2- positive serum of PDCoV;I:PPV- McAb of PPV;J:PPV- positive serum of PDCoV;K:TGEV- McAb of TGEV;L:TGEV- positive serum of PDCoV;M:PEDV- McAb of PEDV;N:PEDV- positive serum of PDCoV图2 IFA检测PDCoV阳性血清的特异性(100×)Fig 2 Specificity of PDCoV positive serum detected by IFA(100×)
阳性血清还可用于毒种和活疫苗的鉴别检验、纯净性检验,从而进行疫苗的质量控制。PDCoV在无胰酶、胰液素时,在ST、Vero、PK15等细胞上不产生细胞病变[20-21],根据2020版兽药典,具有此特性的PDCoV毒种做外源病毒检验可不进行中和,但仍需制备阳性血清用于毒种鉴别检验[14]。
3.2 用鸡制备猪病阳性血清的优势和可行性 ①用猪制备猪病阳性血清,需筛选抗原、抗体阴性猪,鸡不感染猪病毒病,血清中不含各种猪病的抗体,还有供应充足、来源稳定的商品化SPF鸡可用;②鸡属于小型实验动物,饲养于隔离器中便于控制疫病感染,饲养管理比猪、羊更有优势;③矿物油佐剂制备的油包水型疫苗免疫动物后产生比其他佐剂疫苗更高的抗体[22-24],但哺乳动物对矿物油副反应大[22,25-26],鸡可耐受矿物油佐剂,可使用油包水型疫苗免疫[14],从而获得高效价抗体。
3.3 技术经验总结分析 BEI属于烷化剂类灭活剂,这类灭活剂能破坏病毒核酸芯髓,使病毒完全丧失感染力,而又不损害其蛋白衣壳、保留其保护性抗原[27],因而比甲醛灭活制备的疫苗免疫原性更好,抗体效价更高。所以免疫用的PDCoV疫苗的抗原使用了BEI灭活。
PDCoV抗体效价在4次免疫后达到高峰,随后下降较快,加免后效价再次达到高峰。分析原因,可能是鸡非PDCoV的自然宿主,不能快速产生特异性抗体且效价下降较快。
3.4 成果及展望 本研究用SPF鸡制备出PDCoV阳性血清,最高平均中和效价大于1000。1000倍稀释的阳性血清用于IFA检测PDCoV,感染PDCoV的细胞荧光显微镜下显示特异性亮绿色荧光。阳性血清不与PDCoV外的主要猪病病原体反应,特异性良好。所以,制备的PDCoV阳性血清可用于中和法、IFA鉴别检验PDCoV,为疫苗研发奠定基础。本研究为制备方法的前期研究,阳性血清保存条件、保存期等尚需深入研究。
猪病疫苗是生物制品企业的主要产品,企业对各种猪病阳性血清均有需求。猪病阳性血清属于标准品,与疫苗、诊断制品相比,其用量少、经济价值低,暂无稳定、批量供应各类猪病阳性血清的生产企业。如需使用,多为生物制品企业自行制备,或研究机构少量提供。所以,如能建立通用、简易、可操作性强、质量稳定的猪病阳性血清制备方法,将降低猪用疫苗生产企业质控成本、提高质控质量。用鸡制备PDCoV阳性血清方法成立,用鸡制备其他猪病的阳性血清也有成功的可能,可对不同疫病做针对性、细致研究,以期将鸡应用于更多猪病血清的制备。

