高效液相色谱法测定兽药伊维菌素注射液含量的不确定度评定
陈锡龙,赵 贵,杨 强,周泽晓,孙真峥,王庆红,谢丽丽
(贵州省兽药饲料检测所,贵阳 550003)
伊维菌素(Ivermectin,IVM) 是大环内酯类抗寄生虫药,用途极为广泛。国内临床上常用于治疗牛、羊、骆驼、猪等多种家畜的寄生虫病,也被用于治疗鱼类中华鳋、锚头鳋、车轮虫感染等疾病[1-4]。一些非洲国家则使用伊维菌素来治疗人的疟疾、疥疮以及传染性寄生虫病[5-7]。新冠肺炎暴发后,伊维菌素还被用于预防和治疗新冠病毒[8-9]。兽药伊维菌素注射液被收载于《中华人民共和国兽药典》一部中,目前,关于伊维菌素含量测定不确定度的评定鲜有报道。而测量不确定度评定是日常检验工作的重要组成部分,可为进一步提高检测数据的质量提供技术支撑,对实验室管理和质量控制具有重要意义。本实验参考JJF 1059.1-2012《测量不确定度评定与表示》和CNAS-GL006-2019 《化学分析中不确定度的评估指南》的要求,采用标准曲线定量,对高效液相色谱法测定伊维菌素注射液含量实验过程中的不确定度来源进行分析评估,以期为实验室科学、准确测量伊维菌素注射液的含量提供质量控制依据。
1 材料和方法
1.1 仪器设备 Thermo Scientific Ultimate 3000高效液相色谱仪配DAD检测器(美国赛默飞公司);BP211D型电子分析天平(感量:0.01 mg,德国塞多利斯公司);电子分析天平(感量:0.1 mg,瑞士梅特勒-托利多公司);Milli-Direct-Q8UV-R去离子水发生器(美国Millipore公司)。
1.2 材料和试剂 伊维菌素对照品(批号:K0192007,含量92.0%,中国兽医药品监察所);伊维菌素注射液(贵州省兽药饲料检测所监督抽检样品,由C公司生产,批号:20200301;规格:按伊维菌素(H2B1a+H2B1b)计算5 mL:50 mg);甲醇为色谱纯(德国Merck公司);水为超纯水;其他试剂均为分析纯。
1.3 实验方法
1.3.1 色谱条件 色谱柱:Zorbax SB C18(5 μm,4.6×250 mm);柱温为30 ℃;流动相:水-甲醇-乙腈(12∶35∶53);流速为1.0 mL/min;检测波长为254 nm;进样体积为20 μL。
1.3.2 对照品溶液的制备 精密称取伊维菌素对照品54.24 mg,置50 mL量瓶中,加甲醇溶解并定容,混匀,即得伊维菌素为0.9980 mg/mL对照品贮备液。精密量取伊维菌素对照品贮备液1.00、2.00、3.00、5.00、10.00和25.00 mL,分别置于25 mL容量瓶中,加甲醇稀释至刻度,即得伊维菌素浓度为0.03992、0.07984、0.11976、0.1996、0.3992和0.9980 mg/mL的标准工作曲线系列溶液。
1.3.3 供试品溶液的制备 精密吸取伊维菌素注射液样品5.00 mL,置50 mL量瓶中,加甲醇稀释至刻度,混匀。另取上述稀释液5.00 mL,置25 mL量瓶中,加甲醇稀释至刻度,混匀,即得。
1.3.4 数学模型和不确定度来源分析 本实验的数学模型为:

根据数学模型,可知不确定度来源主要包括:对照品溶液配制引入的不确定度;标准工作曲线拟合引入的不确定度;样品前处理引入的不确定度;样品重复测量f重复测量引入的不确定度。
2 结果与分析
2.1 对照品溶液配制引入的不确定度
2.1.1 对照品贮备液配制浓度c0引入的不确定度

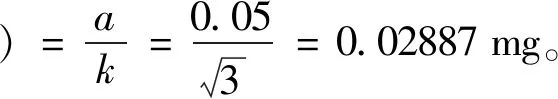


1.578×10-3mg

3.156×10-5
称取对照品质量合成标准不确定度u(m0)的计算:

由于称取对照品质量需要通过两步操作才能完成,即回零和称样,故:

2.1.1.4 对照品含量引入的不确定度urel(ρ) 根据标准物质证书提供的信息,对照品伊维菌素(H2B1a+H2B1b)的含量为92.0%。使用前无需干燥。开封后一次使用。包装及装量:棕色安瓿装,每支约100 mg;贮存条件:严封,避光,5 ℃以下保存。测定时使用的对照品为新购入且按贮存条件保存的未开封对照品,未给出不确定度量值,故不考虑含量引入的不确定度。
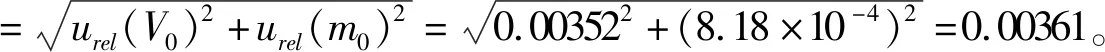
2.1.2 配制标准工作曲线系列溶液引入的不确定度 配制标准工作曲线系列溶液引入的不确定度包括对照品贮备液量取、稀释定容引入的不确定度。其中稀释定容(共5次),即分别用适当的单标线吸量管量取相应体积的对照品贮备液置25 mL量瓶中,然后稀释定容得到std1~std5共5个标准曲线系列溶液,std6实际上只是转移,不涉及定容,此处不会引入不确定度。




表1 不同规格单标线吸量管吸取对照品贮备液引入的不确定度Tab 1 Uncertainty from preparation of working standard solutions with different pipette

4.02×10-3mL。
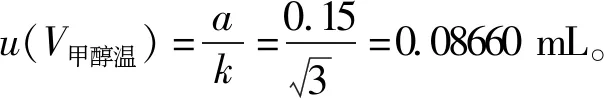


表2 标准曲线拟合引入的不确定度Tab 2 Uncertainty from working curve fitting
2.3 样品前处理引入的不确定度 样品前处理引入的不确定度包括样品取量、稀释定容及温度变化引起的液体体积膨胀引入的不确定度。样品的处理:取15支同一批号的伊维菌素注射液倒入一清洁小烧杯中,混匀,用5 mL单标线吸量管吸取5.00 mL置50 mL容量瓶中,加甲醇稀释定容至刻度,混匀;另取上述稀释液5.00 mL,置25 mL量瓶中,加甲醇稀释定容至刻度,混匀,即得。
2.3.1 样品前处理引入的不确定度分量分析 样品前处理引入的不确定度包括第一次吸取伊维菌素注射液并定容及第二次吸取稀释液并定容引入的不确定度。

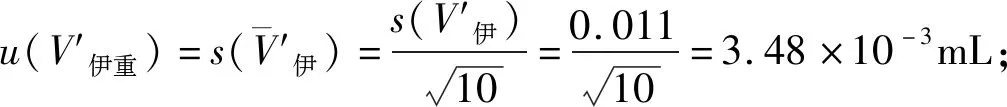



2.4 样品测量重复性引入的不确定度 在重复性条件下,对伊维菌素注射液分别取样测量10次,每次进样3针。测量结果见表3。

表3 样品测量重复性引入的不确定度结果Tab 3 Uncertainty of samples measuring repeatability
2.5 合成相对标准不确定度及扩展相对标准不确定度

2.5.2 扩展相对标准不确定度 取置信水平p=95%,k=2。则扩展相对标准不确定度Urel=2×1.46×10-2=2.92×10-2。

2.6 主要不确定度来源及相对贡献 主要不确定度来源及相对贡献统计结果见表4。

表4 主要不确定度来源及相对贡献Tab 4 Components of relative standard uncertainty
由表中可以看出,不确定度主要来源于标准工作曲线系列溶液的配制、样品前处理及对照品贮备液配制环节。
3 结论与讨论
本研究依据《中华人民共和国兽药典》2020年版一部兽药伊维菌素注射液含量测定的高效液相色谱法,采用标准曲线定量,对高效液相色谱法测定伊维菌素注射液含量的实验过程中的不确定度来源进行分析评定。参考不确定度评估相关要求,构建不确定度评估模型,分析了不确定度的来源,并对其进行评定,计算了各分量的相对不确定度,同时给出扩展相对不确定度。通过分析不确定度的相对贡献可知,不确定度主要来源于标准工作曲线系列溶液的配制、样品前处理及对照品贮备液配制环节,测量过程中应重点关注并严格控制检测风险。


