应重视对糖尿病肾病(DKD)患者的血压管理
首都医科大学附属北京朝阳医院 那开宪
北京市朝阳区小红门社区卫生服务中心 杨海燕
慢性肾脏病(CKD)是危害人民身体健康的常见慢性疾病,而我国2012年的抽样调查显示我国约有1.195亿CKD人群。CKD患者的高血压患病率远远高于无CKD人群。糖尿病肾病(DKD)占全球慢性肾脏病(CKD)病例的40%以上。高血压是DKD进展以及发生心血管疾病和死亡的主要危险因素。因此,管理好高血压对延缓DKD进展和降低心血管疾病风险至关重要。在治疗时对降压药物的选择不仅要看降压效果,还要考虑到降压药物对心脏、脑、肾脏等重要的靶器官进行保护。因此,对糖尿病肾病合并高血压患者不仅要控制血糖,还要考虑到降压效果以及降压药对糖代谢、胰岛功能和肾功能的影响。然而,在临床实践过程中,国内外对糖尿病肾病患者的血压管理却差距甚远。
病例
赵先生,78岁,身高1.74米,体重88公斤,有烟酒嗜好及喜食用油腻食品30余年,发现糖尿病20年。20年前单位组织体检无意中发现空腹血糖高(8.2mmoL/L),低密度脂蛋白胆固醇及甘油三酯偏高。次日,赵先生到三甲医院内分泌科看病,经检查诊断为二型糖尿病、高脂血症,给予二甲双胍、舒降之治疗。医生嘱咐他,戒烟、限酒、减肥及少吃油腻食品。赵先生服药后血糖、血脂得以满意控制。赵先生曾经几次尝试戒烟,每次仅仅维持1-2个月,均以失败告终。在家属的监督下能够节制油腻食品及限酒。5年后一天早上,赵先生无任何原因感到头晕、头沉,到医院看病测量血压高(180/100mmHg),医生立即给予他硝苯地平缓释片含服,不久后血压降至正常,做头部CT正常,医生嘱咐他,回家后常测量血压,如果高就服用硝苯地平缓释片。赵先生回家后多次测量血压均正常,也没有服药。一天晚上,赵先生起床解小便,感到头晕,测量血压160/100mmHg,自己认为血压高与憋尿有关,休息就会好转。次日,赵先生晨起测量血压150/90mmHg,起床到户外活动后再测量血压正常。因血压正常赵先生未理会,但是他把这个情况告诉了爱人,其爱人是一个有心人,连续几天清晨都给赵先生测量血压,血压均在150/90mmHg左右。在家属催促下,赵先生到医院看病,做24小时血压监测示夜间高血压,血压从晚上10点开始升高,至次日凌晨4-5时下降至正常。医生给予硝苯地平缓释片10mg,嘱咐他每晚睡前服用。服药后一周,再次做24小时血压监测夜间血压恢复正常。尔后,赵先生一直坚持每天晚上睡前服用一片硝苯地平缓释片。两年后一天中午,赵先生无任何原因感到头晕、头沉,测量血压高(160/100mmHg),立即到医院看病,做24小时血压监测示凌晨开始血压高,持续至夜间11时。医生建议早晚服用硝苯地平缓释片,每次一片(10mg)。服用降压药物后,赵先生多次测量血压并做24小时血压监测,血压控制满意。因血压、血糖控制满意,赵先生放松了对血压、血糖的监测。三年后,赵先生到医院做例行检查发现餐前血糖(7-8mmoL/L),餐后血糖(12-13.6mmoL/L),糖化血红蛋白7.5%,24小时血压监测示凌晨至上午10时血压高(160/90mmHg左右),下午5时至11时血压高(150-160/80-90mmHg),做尿白蛋白/肌酐比值(ACR)>30mg/g,肝肾功能正常。医生给予二甲双胍及亚莫利降血糖,拜新同及引达泊胺降压。服药后赵先生血压、血糖得以控制,但是多次复查ACR>30mg/g。赵先生多次问医生如何消除尿微量白蛋白,医生告诉他微量白蛋白尿是糖尿病及高血压所致,必须把血糖及血压控制好,才能够消除微量白蛋白尿,这需要较长时间治疗,不能着急。三年间赵先生曾经多次在当地找过医生看病,均同意目前治疗方案。两年后赵先生多次检查ACR>200-300mg/g,肾小球滤过率(eGFR)<55ml·min-1·(1.73m²)-1,餐后血糖13.8mmoL/L、糖化血红蛋白7.6%,做24小时血压监测示凌晨4时开始血压高(140-150/90-100mmHg)至上午10时许。医生考虑患者血压以凌晨高血压为主,血糖表现餐后高,蛋白尿、肾功能受损,给予二甲双胍、亚莫利及格列喹酮降糖,拜新同早晚各一片,睡前服用盐酸特拉唑嗪2mg。服用药物后患者血糖、血压控制达标,多次检查ACR及eGFR均无变化。赵先生及其家属十分着急,在朋友介绍下找笔者看病。在细致查看了他所有检查及其治疗药物之后,笔者告诉他,根据我国近期糖尿病指南及糖尿病肾病指南,笔者将他原先治疗方案做一些较大变动,建议给予二甲双胍、达格列净及西格列汀降低血糖,给予沙库巴曲缬沙坦、螺内酯及络活喜降压,阿托伐他汀降脂治疗。笔者依据指南耐心给他及家属讲解新的治疗方案,为什么有这么大的变动以及每一个药物的作用。他们听了笔者的讲述后,同意这个治疗方案。经过近两年的治疗,患者血糖、血压、血脂控制满意。多次检查ACR>90-100mg/g,肾小球滤过率在正常范围内。
教训
①糖尿病肾病合并高血压降压及降糖药物选择一定要遵循以下原则:糖尿病肾病合并高血压患者在选择降糖及降压药物时,应优先考虑具有心脏、肾脏获益证据的药物,同时应充分考虑患者的心、肾功能情况,并根据eGFR调整药物剂量;尽量避免使用血糖风险较高的药物;还应考虑其他并发症、体重、经济状况及患者偏好等因素。
②对于血压高患者紧急降压禁忌应用硝苯地平或硝苯地平缓释片含服,因这种药物短时间内使血压急剧下降,可致心、脑、肾供血不足,致心血管事件发生。
③24小时动态血压监测应作为血压高患者的常规监测手段,对于诊断高血压,判断高血压类型,指导治疗及评估治疗效果具有极其重要的地位。该患者如果尽早进行24小时动态血压监测,就不会漏诊夜间高血压。
④该患者糖尿病肾病合并高血压,降压药物应优先选择ACEI或ARB对肾脏、心脏有保护作用的药物,联合治疗时应选择包含一种ACEI/ARB,联用形式包括不同药物自由联合或单片复方制剂。
⑤该患者体胖,应优先选择能够减体重、避免血糖风险高、降低蛋白尿,对肾脏、心脏有保护作用的药物。格列喹酮、亚莫利均增加体重,引达泊胺使血糖增加。
糖尿病肾病发生高血压的机制
糖尿病患者易患高血压的主要机制比较复杂,与多种因素有关,主要包括以下几个方面:胰岛素抵抗;钠排泄障碍导致细胞外液容量负荷过重;RAS系统异常激活,兴奋交感神经系统;交感神经系统兴奋导致血管收缩效应,刺激肾素分泌等因素。这些因素中RAS系统异常激活及胰岛素抵抗是其主要原因。由于RAS系统异常激活及胰岛素抵抗导致交感神经系统亢进、水钠储留,引起血压升高。长期高血糖可致肾功能损伤进而引起高血压,初发糖尿病者如并发高血压应视为肾病发生的一个易感标志。研究发现,约20%-60%的糖尿病患者都会发生DKD,并且进行性发展,75%的2型DKD患者在20年内进展至终末期肾病。从全国CKD患者高血压流行病学调查中可以发现,男性CKD患者高血压患病率高达76.4%,女性为65.7%。CKD患者高血压患病率随着年龄增长显著增加(P<0.05)。
糖尿病肾病与高血压二者的关系
众所周知,血压是DKD整个过程中一个决定性因素,高血压是糖尿病肾病进展的重要危险因素,高血压作为危险因素与肾病发生发展有密切关系,持续高血压会加重肾脏负担,促进糖尿病肾病进展。高血压不仅是DKD的一种临床表现,也是加重DKD的促发因素。长期高血压可引起肾脏损伤,绝大多数糖尿病肾病患者均伴有不同程度的高血压。临床上高血压与DM并存十分常见,2型糖尿病(T2DM)患者高血压的患病率为20%-60%,与非DM人群相比,DM高血压的患病率高2-3倍,且DM和高血压互为因果,均可损害肾脏,导致糖尿病肾病(DN)发生。高血压可使肾小球血流压力升高,肾小球滤过压及GFR增高,从而导致白蛋白滤过增加,进而出现系膜肾小球硬化症和蛋白尿,肾脏病变又可加重高血压而形成恶性循环,故高血压是糖尿病肾病发生发展的一个重要因素。糖尿病患者心血管病变的危险性是健康人群的2倍,一旦并发高血压则增至4倍,并会加速心血管病、视网膜病,尤其是肾病的进程,是引起终末期肾衰竭的重要原因。糖尿病肾病是糖代谢异常引起的以微血管病变为基础的肾脏并发症,在临床上属于晚期2型糖尿病的常见并发症。微量白蛋白尿、高血压与持续性蛋白尿等症状是此病的主要表现。患者一旦发生持续性蛋白尿,则提示患者的肾脏出现损伤,如果不进行干预,会很快进入终末期肾衰竭阶段,这是导致患者死亡的主因。同时高血压是造成肾功能损害的独立危险因素,若糖尿病患者合并高血压,发生糖尿病肾病和肾功能恶化的概率无疑会比无高血压者明显增加,糖尿病肾病合并高血压发生ESRD的风险相当高。国外的大样本研究发现,以理想的血压为参考,正常高值血压发生ESRD风险增加1.9倍,随着高血压分级的增加,发生ESRD的风险显著增加。研究还表明,高血压和糖尿病肾病共同促进心血管疾病的发生、发展。在CKD发生、发展的不同时期会出现水钠潴留、肾小球硬化、高尿酸血症、内皮细胞损伤,动脉弹性减退及自主神经调节异常等病理改变,这些病理改变使糖尿病肾病和高血压成为互为因果的关系。糖尿病肾病会引起贫血、系统炎症、电解质紊乱、代谢性酸中毒及矿物质代谢异常的症状;高血压也会引起血管阻力增加、左心室肥厚、动脉闭塞及血管重建等病理变化。这些改变致糖尿病肾病合并高血压是导致心血管疾病和ESRD死亡的重要原因。
糖尿病肾病血压管理十分重要
对糖尿病肾病(DKD)患者而言,高血压是蛋白尿、肾功能恶化、终末期肾脏病(ESRD)和心血管疾病的主要可逆性危险因素。T2D患者的高血压患病率是健康患者的3倍,高血压是DKD进展以及发生心血管疾病和死亡的主要危险因素。研究表明,血压从115/75mmHg开始,每增加20/10mmHg,心血管终点事件发生率翻倍,心肌梗死和脑卒中风险增加8-10倍。糖尿病患者群体中,高血压与任何心血管疾病事件风险增加57%和全因死亡风险增加72%相关。在T2D合并高血压患者中,微血管和大血管并发症明显高于无高血压患者。管理好高血压对延缓DKD进展和降低心血管疾病风险至关重要,控制血压已被证实有利于DKD患者肾脏保护。所以有效地控制血压、减少蛋白尿、保护肾功能是延缓糖尿病肾病患者病情进展的重要手段。血压是除血糖之外的又一个重要原因,高血压在糖尿病肾病的发生和发展中起到重要的作用。积极降压可明显减少糖尿病患者心、脑、肾事件的发生。2021年11月13日,于《柳叶刀》发表的一项系统回顾和meta分析显示:降低血压,除外已知的可预防2型糖尿病(T2DM)的血管并发症外,其本身也可以预防糖尿病的发病。收缩压每降低5mmHg,糖尿病风险相应降低11%。英国前瞻性糖尿病研究(UKDPS)发现,严格控制血压可使糖尿病相关性病死率明显降低32%,微量白蛋白尿发生率下降29%,蛋白尿发生率下降39%,微血管终点事件(视网膜疾病和肾病)减少37%,大血管复合终点事件(心肌梗死、猝死、脑卒中和外周血管疾病)发生率减少34%,而强化控制血糖仅使糖尿病相关终点事件下降12%。因此,对于糖尿病或糖尿病肾病患者,降压治疗对减少心血管事件的作用优于降糖治疗。欧洲收缩压试验(SYSTEur)研究亦指出,接受降压治疗的糖尿病高血压患者,发生蛋白尿的风险显著下降了71%,与非糖尿病患者相比,糖尿病患者在这方面的受益更大。同样,Bakris等行荟萃分析提示,积极降压可显著延缓糖尿病及非糖尿病患者慢性肾脏病进展速度。国内外研究证实在糖尿病肾病患者中,严格控制血压至130/80mmHg以下可有效减少蛋白尿,对于预防和减缓肾脏并发症有非常重要的作用。抗高血压治疗是减缓以及阻止糖尿病肾病发展的有效手段。
糖尿病肾病合并高血压降压的目标值
根据患者糖尿病类型、肾功能情况以及患者年龄将个体化的降压目标总结于表1中。
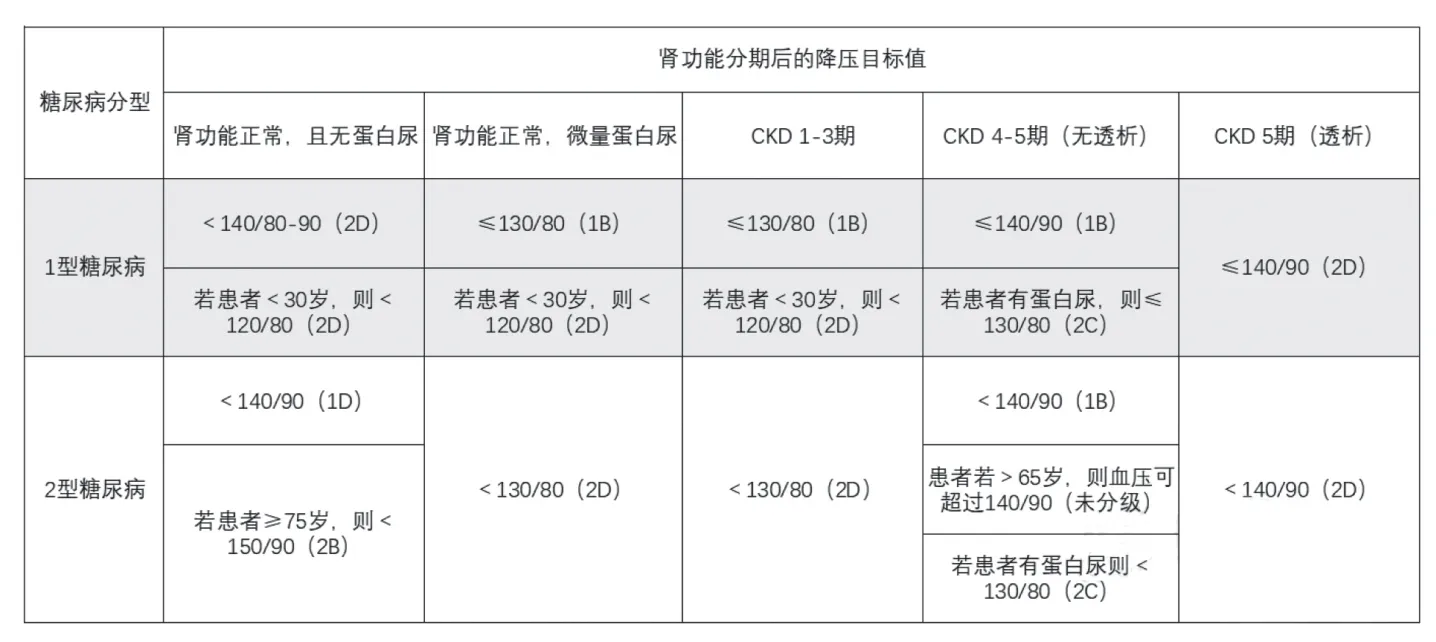
表1 糖尿病肾病合并高血压降压的目标值
当前我国糖尿病肾病高血压管理存在的问题
最近,在JAMA net work Open上的一篇研究表明,尽管糖尿病患者CKD患病率较高,但患者未服用对肾脏有益的药物,相反,许多患者服用了肾毒性药物。该研究表明,约1/8的CKD患者患有蛋白尿,同时,只有1/5的患者服用肾素-血管紧张素系统抑制剂,更重要的是超过1/3的患者服用了非甾体抗炎药或质子泵抑制剂,即肾毒性药物。从我国CKD患者高血压流行病学调查中可以发现,男性CKD患者高血压患病率高达76.4%,女性为65.7%。由此可见,我国CKD患者高血压患病率相当可观,但是血压的控制率较低。根据我国CKD患者高血压流行病学调查显示:我国CKD住院患者血压控制率并不理想,33.1%的患者血压控制在140/90mmHg以下;14.1%的患者血压控制在130/80mmHg以下。随着CKD分期增加,血压控制率下降(P<0.05)。分析其血压控制率低的原因,该调查报告归纳起来主要有以下3个方面原因:①利尿剂使用不足;②联合降压药物治疗比例低;③降压药物治疗方案不合理。ACEI/ARB是CKD人群降压治疗的基础用药。高血压合并糖尿病肾病患者降压药物的选择除了需要注意普遍适用的降压疗效、安全性及依从性外,还需要综合考虑是否合并糖尿病、蛋白尿、心肾保护作用,以及对特殊人群如血液透析、肾移植、妊娠、老年等药物选择方面的注意事项。在临床实践过程中,笔者发现有的医生在对糖尿病肾病合并高血压患者治疗中往往忽视了上述应用降压药物的宗旨。就高血压疾病而言,它是一种可治疗的危险因素。但从目前的知晓率、治疗率及达标率的统计数据来分析,中国乃至全世界各个国家的情况都不尽如人意。应积极使用合理的降压药物及采取有效降压方案是完全可以控制CKD患者的血压,进而延缓患者的肾功能减退。
经典降压药物治疗糖尿病肾病合并高血压应注意的问题
经典的抗高血压药包括血管紧张素转换酶抑制剂(ACEI)、血管紧张素受体阻滞剂(ARB)、钙通道阻滞剂(CCB)、噻嗪类利尿剂、盐皮质激素受体拮抗剂(MRA)和β受体阻滞剂这5类。临床选择降压药物时需要考虑多种因素,如共病、年龄、糖尿病类型、CKD分期、eGFR、心肾保护、副作用等。国内外指南强烈建议将ACEI或ARB作为高血压、糖尿病、慢性肾病和冠状动脉疾病患者的一线治疗用药,并一致推荐ACEI或ARB作为糖尿病合并严重蛋白尿(白蛋白与肌酐比值,ACR>300mg/g)患者血压控制的第一选择,当ACR在30-299mg/g之间时应予以优先考虑,因为它们可以降低肾病进展的风险。研究表明,在标准降压治疗中加入螺内酯可以降低糖尿病合并糖尿病肾病患者的蛋白尿水平、延缓eGFR下降。此外,与在相同剂量的ACEI中添加氯沙坦相比,在最大剂量的赖诺普利中添加螺内酯可提高糖尿病肾病患者的肾保护作用。使用噻嗪类利尿剂(如氯沙利酮)治疗可能会导致高血糖,因为药物特性会影响胰岛素抵抗。不推荐大多数β受体阻滞剂作为糖尿病患者的一线治疗,因为它们对心脏代谢有负面影响,如增加甘油三酯水平、降低高密度脂蛋白胆固醇水平、隐藏低血糖症状和损害胰岛素敏感性。此外,β受体阻滞剂也可能增加患糖尿病的风险,尤其是在高体重患者使用时。近年来,经过对药物类别的深入分析发现,不同类别的降压药对于糖尿病风险,表现出了截然不同的影响:ACEI和ARB分别降低了新发糖尿病风险16%;相反,噻嗪类药物增加了20%的糖尿病风险,β-受体阻滞剂增加了48%的糖尿病风险;钙通道阻滞剂则对于糖尿病事件的发生没有影响。故指南认为ACEI、ARB、CCB和噻嗪类利尿剂都是糖尿病患者可接受的初始降压治疗方案。但需要强调的是,并非所有β受体阻滞剂都对葡萄糖稳态产生如此不利的影响。卡维地洛、奈比洛尔、拉贝洛尔不仅能阻断β-肾上腺素受体,而且还具有促进血管舒张的其他特性,对代谢的不良影响较小。CKD患者高血压的发生涉及多个发病机制,常常需要联合使用2种或2种以上降压药物。对血压≥160/100mmHg或高于目标血压20/10mmHg的高危人群,初始治疗即需要应用2种降压药物。对于CKD患者,初始治疗联用方案中应包含一种ACEI/ARB,联用形式包括不同药物自由联合或单片复方制剂。单片复方制剂使用方便,可改善治疗的依从性及疗效,是联合治疗的新趋势,2020ISH指南中明确推荐单片复方制剂应作为优先选择。
哪一些新兴“降压药”能够有益于糖尿病肾病血压管理
除了上述降压药物外,还有许多新药显示出额外的降压特性,而这些特性对糖尿病肾病患者尤其有利。①非奈利酮:非奈利酮是一种新型非甾体盐皮质激素受体激动剂,相比螺内酯和依普利酮具有更高的选择性和活性。它可以防止醛固酮激活盐皮质激素受体,有助于减少重塑、纤维化和炎症过程,尤其是在心脏、肾脏和外周血管系统中。非奈利酮主要用于心力衰竭治疗,可使NT-proBNP水平下降。除此之外,由于非奈利酮能够减少蛋白尿,因此可以使用非奈利酮治疗难治性高血压和糖尿病肾病。由于非奈利酮的高选择性,因此不会导致血清钾水平显著升高。FIDELIO-DKD、FIGARO-DKD等多项试验证明了非奈利酮在治疗糖尿病肾病患者中的有益作用。②埃沙西林酮(esaxerenone):埃沙西林酮是另一种新型非甾体盐皮质激素受体激动剂,已在日本获批用于治疗高血压和糖尿病肾病。由于与依普利酮和螺内酯相比,埃沙西林酮对盐皮质激素受体的效力和选择性较高,因此对高钾血症、女性乳房发育、闭经和阳萎风险较小。研究表明,埃沙西林酮单药治疗,从基线检查到治疗结束,坐位血压降低-18.5/-8.8mmHg;埃沙西林酮作为肾素-血管紧张素系统抑制剂的附加疗法时,血压降低幅度为-17.8/-8.1mmHg;此外,在2型糖尿病合并微量白蛋白尿患者中进行的三期临床试验表明,在T2D和微量白蛋白尿患者中,在高血压治疗中添加埃沙西林酮可减少蛋白尿的进展。③钠-葡萄糖共转运蛋白-2抑制剂(SGLT-2):SGLT-2是新型的抗糖尿病药物,通过降低SGLT2对葡萄糖的转运,减少肾小管葡萄糖重吸收,加强/修复肾脏致密斑管球反馈和肾小囊腔血流静压,改善肾小球高滤过状态,降低肾小球内压力,减少白蛋白尿和炎症的发生。对伴糖尿病肾病的T2DM患者,推荐在eGFR≥45ml/min/1.73m2的患者中使用SGLT2,以降低糖尿病肾病进展和(或)心血管事件的风险。它还具有体重减轻、降尿酸和降压的益处。④胰高糖素样肽1受体(GLP-1RA):GLP-1类似物主要通过肠促胰岛素效应发挥作用,刺激胰岛素释放,抑制胰高血糖素分泌,延迟胃排空和增加饱腹感,达到降低血糖作用,其利尿和利钠作用起到降压效果。它还能减少糖尿病患者新发大量白蛋白尿的风险,具有广泛的心肾脏保护及体重减轻益处。⑤沙库巴曲/缬沙坦:这是一种新型药物,同时具有脑啡肽酶(NEP)抑制剂—沙库巴曲和血管紧张素II(AngII)AT1受体阻断剂—缬沙坦的双重作用,其通过抑制NEP及(AngII)AT1受体的双重作用机制,导致全身血管扩张、利尿和利钠作用增强,发挥降低血压和改善心力衰竭(HF)症状等重要作用。这种药物又同时干预RAAS和利钠肽系统,因此具有较强的降压作用,且其降压作用随剂量增加而增强,还具有降低蛋白尿、保护肾功能作用。研究还证实这种药物通过改善胰岛素敏感性来改善血糖控制,可明显改善糖尿病和心血管疾病风险。

