石油烃降解菌Mycolicibacterium fluoranthenivorans Y3的筛选鉴定及降解特性研究
郭 岩,马 建,杨宗政,张天宇,孙 炜,吴志国
(1.天津津港基础设施养护运营工程管理有限公司,天津 300456;2.天津科技大学海洋与环境学院,天津 300457;3.天津科技大学化工与材料学院,天津 300457)
0 引言
石油作为运输业重要的动力燃料,其产量与需求量逐年提高。石油生产、储存及使用等过程中难免会泄露于外界环境中[1],因其具有成分复杂、难降解等特点,长期滞留于环境中会导致严重的水、土环境污染[2,3]。石油中包含多种不同的正构、异构烷烃、多环芳烃等[4-5],在众多石油烃污染的修复方法中,生物修复法是清除环境中石油烃污染物最经济、有效的方法,能够通过微生物的特异性代谢作用将石油烃转化成无毒的终产物[6-8]。具有石油烃降解能力的菌株种类繁多,但其中有关分枝杆菌属的报道相对较少,且大多只针对多环芳烃类石油烃进行了研究。例如,刘沙沙等[9]发现微黄分枝杆菌对芘有着良好的增溶与降解作用。Wu等[10]发现结核分枝杆菌能够在以芴和蒽为唯一碳源的培养基中快速生长并起到良好的降解作用。Sun等[11]发现嗜芳族分枝杆菌可通过双加氧酶降解菲。现有研究大多只报道了分枝杆菌的多环芳烃降解能力,对柴油类石油烃的降解研究鲜有报道,因此针对分枝杆菌进行柴油的降解研究对该菌属的降解多样性具有重要的推动作用。
本研究基于含油污泥筛选得到一株柴油降解菌Mycolicibacterium fluoranthenivoransY3,并对其进行系统发育分析,考察菌株的生长特性及以柴油为底物的条件下菌株的柴油耐受程度和降解特性,通过GC-MS进一步研究其降解能力与机制,研究结果可推进分枝杆菌属对石油烃降解的多样性并为石油烃污染的原位修复提供重要种质资源。
1 材料与方法
1.1 试剂、材料与培养基
柴油为车用0#柴油,石油醚为国产分析纯,气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)分析用试剂为高效液相色谱纯,分子生物学试剂购自生工生物工程(上海)股份有限公司。
菌种筛选材料取自天津港南疆污水处理厂(38.97°N,117.77°E),该污水处理厂进水常年以港口、船舶含油污水及生活污水为主,污水中所含石油主要为柴油、燃料油等,污水经斜板隔油+混凝沉淀处理后得到的含油污泥置于晒泥场晾晒,取晒泥场0~10 cm深处油泥作为菌种筛选材料。
(1)无机盐培养基:NaCl 1 g,NH4Cl 1.34g,K2HPO41.5 g,KH2PO40.5 g,MgSO4·7H2O 0.2 g, 1L去离子水,pH 7.0(固体培养基加20 g/L琼脂)。
(2)柴油培养基:无机盐培养基中添加1%(V/V)柴油。
(3)LB培养基:含牛肉膏5 g,蛋白胨10 g, NaCl 5 g,pH为7.0(固体培养基加20 g/L琼脂)。
1.2 实验方法
1.2.1 柴油降解菌的筛选
从天津港南疆污水处理厂采集含油污泥作为菌株筛选材料,称取5 g油泥样品制成油泥水混合液,将其按5%(V/V)接种量加入到柴油含量为0.5%(V/V)的无机盐培养基中,置于30℃摇床上以180 r/min的转速震荡培养3~5 d,待培养液明显浑浊后,将培养液以5%(V/V)接种量转接于新鲜的柴油培养基中(柴油浓度依次为:1%、2%、3%),如此共富集培养三轮,取完成富集的菌液梯度稀释至10-1、10-2、10-3、10-4,10-5、10-6,各吸取200 μL稀释后菌液均匀涂布于含柴油的无机盐固体培养基(无机盐固体培养基表面均匀涂布 200 μL柴油)中,30℃培养2~3 d,挑取不同菌落形态的单菌落连续纯化3次,得到若干株细菌,分别接种于柴油培养基中,5 d后测定柴油的降解率,选择对柴油降解率最高的菌株命名为Y3(初步柴油降解率为42.5%)进行后续实验。
1.2.2 形态学及生理生化鉴定
菌落的生长状况、菌株的形态特征以及菌株的生理生化测试按照《常见细菌系统鉴定手册》进行初步判定,并采用扫描电镜(JSMIT300LV)在10000倍下观察Y3形态。
1.2.3 分子生物学鉴定
采用16S rDNA序列分析方法鉴定Y3菌株,由金唯智生物科技有限公司完成测序工作,测序结果用NCBI Blast程序将拼接后的序列文件NCBI中的已知序列进行同源性比对,利用MEGA 7.0软件构建系统发育树,并在Genebank申请16S rDNA保藏号。
1.2.4 种子液的获取
取保存菌种,于LB平板划线,30℃恒温培养48 h,挑取单菌落接种于20 mL LB培养基中,于30℃、180 r/min摇床培养12 h。
1.2.5 菌株的生长特性研究
将种子液以5%接种量接种至LB培养基中,考察在不同初始pH(5、6、7、8、9)、不同温度(20℃、25℃、30℃、35℃、40℃)、不同NaCl浓度(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L)、不同金属离子(Cu2+、Zn2+、Mn2+、Co2+、Ni2+各 50 mg/L)等因素对菌株生长的影响。各个试验中的固定条件为:pH=7、温度为30℃、无NaCl、无金属离子,NaCl与金属离子不作为生长特性试验的主要条件。实验中以不接菌的LB培养基作为空白对照,测定菌株的OD600表征菌量。
1.2.6 柴油降解曲线
将种子液以5%(V/V)的接种量接种于柴油培养基中,30℃、180 r/min培养7 d,以不接菌的柴油培养基为对照,测定菌株的OD600及柴油降解率。
1.2.7 接种量对柴油降解效果的影响
将种子液分别以1%、3%、5%、10%、15%(V/V)的接种量接种于柴油培养基中,30℃、180 r/min培养5d,以不接菌的柴油培养基为对照,测定菌株的OD600及柴油降解率。
1.2.8 不同条件对菌株Y3降解柴油的影响
将种子液以5%接种量接种至柴油培养基中,考察不同柴油浓度(0.5%、1%、2%、3%)、初始pH(5、6、7、8、9)、温度(20℃、25℃、30℃、35℃、40℃)、外加碳源(葡萄糖、蔗糖、乳糖、碳酸钠、乙酸钠,投加浓度均为100 mg/L)、氮源(氯化铵、酵母浸粉、蛋白胨、尿素、硫酸铵、硝酸钠,投加浓度均为1.34 g/L)等因素对菌株生长和降解效果的影响。各个试验中的固定条件为:柴油浓度1%(V/V)、pH=7、温度为30℃,碳氮源为外加条件,不作为降解试验的主要条件。以不接菌的柴油培养基作为空白对照,测定菌株的OD600及柴油降解率。
1.2.9 菌株Y3降解柴油的组分分析
将种子液以5%接种量接种至柴油培养基,在最优条件下(柴油浓度1%(V/V)、30℃、pH=6)培养5 d,利用正己烷萃取最终发酵液中柴油等有机组分,在萃取液中加入无水硫酸钠直至不再结块,取上清液适当稀释,于气相色谱-质谱仪测定发酵液成分。
1.3 分析测定方法
1.3.1 柴油的测定
以石油醚为萃取剂,采用液液萃取的方法,萃取无机盐液体培养基中的柴油,并采用紫外分光光度法在225 nm处测定其浓度[12]。按式(1)计算柴油降解率。
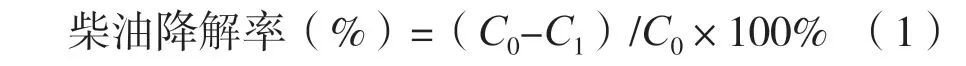
式中:C0—空白培养基柴油的浓度;C1—实验培养基柴油的浓度。
1.3.2 气相色谱-质谱仪分析条件
气相色谱条件(GCMS-QP2020):色谱柱Rxi-5Sil(0.25 mm×30 m×0.25 μm);进样量 1 μL,不分流;柱温升温程序:40℃保持5 min,以10℃/min升至290℃,保持10 min,再以15℃/min升至310℃,保持2 min。
质谱条件:EI源,离子源温度220℃,接口温度200℃。溶剂延迟时间2.5 min,扫描范围35~500 amu,自动调谐。
2 结果与分析
2.1 菌株的分离与鉴定
通过柴油培养基培养、筛选和分离,纯化得到1株高效柴油降解菌株Y3。通过革兰氏染色实验确定菌株Y3为革兰氏阴性菌,其菌落形态为圆形,白色,表面湿滑不透明,边缘整齐,其生理生化特性见表1,扫描电镜照片及菌落形态特征如图1所示。

图1 菌株Y3形态图

表1 菌株的生理生化实验结果
以菌株Y3的DNA为模板,利用通用引物扩增得到1387 bp的16S rRNA基因片段。通过在基因序列数据库中的比对分析发现其与Mycolicibacterium fluoranthenivoransFA-4的同源性达99.78%。将Y3与分枝杆菌进行系统发育分析如图2所示,菌株Y3的16S rRNA基因序列GenBank登陆号为OM149383。
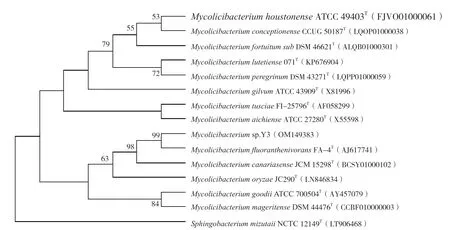
图2 菌株Y3基于16SrRNA基因序列的系统发育分析
2.2 菌株的生长特性
不同温度、pH、NaCl浓度、金属离子对菌株Y3生长的影响,如图3所示。
菌株Y3在20~40℃的温度范围内生长较好,30℃获得了最佳生长,属于中温菌(图3-a)。在6.0~8.0的pH范围内菌株生长良好,pH =6.0条件下菌株获得最佳生长,pH=5.0的条件下菌株生长受到严重抑制,说明菌株Y3适宜在中性偏酸性的环境中生存(图3-b)。Y3在盐度范围为3%以内均可生长,具有良好的耐盐性(图3-c)。菌株Y3在50 mg/L的Zn2+、Mn2+、Cu2+、Ni2+条件下均能生长,与对照组相比Co2+完全抑制了菌株的生长,Ni2+、Zn2+、Cu2+的抑制作用相对较弱,Mn2+则无明显的抑制作用(图3-d)。
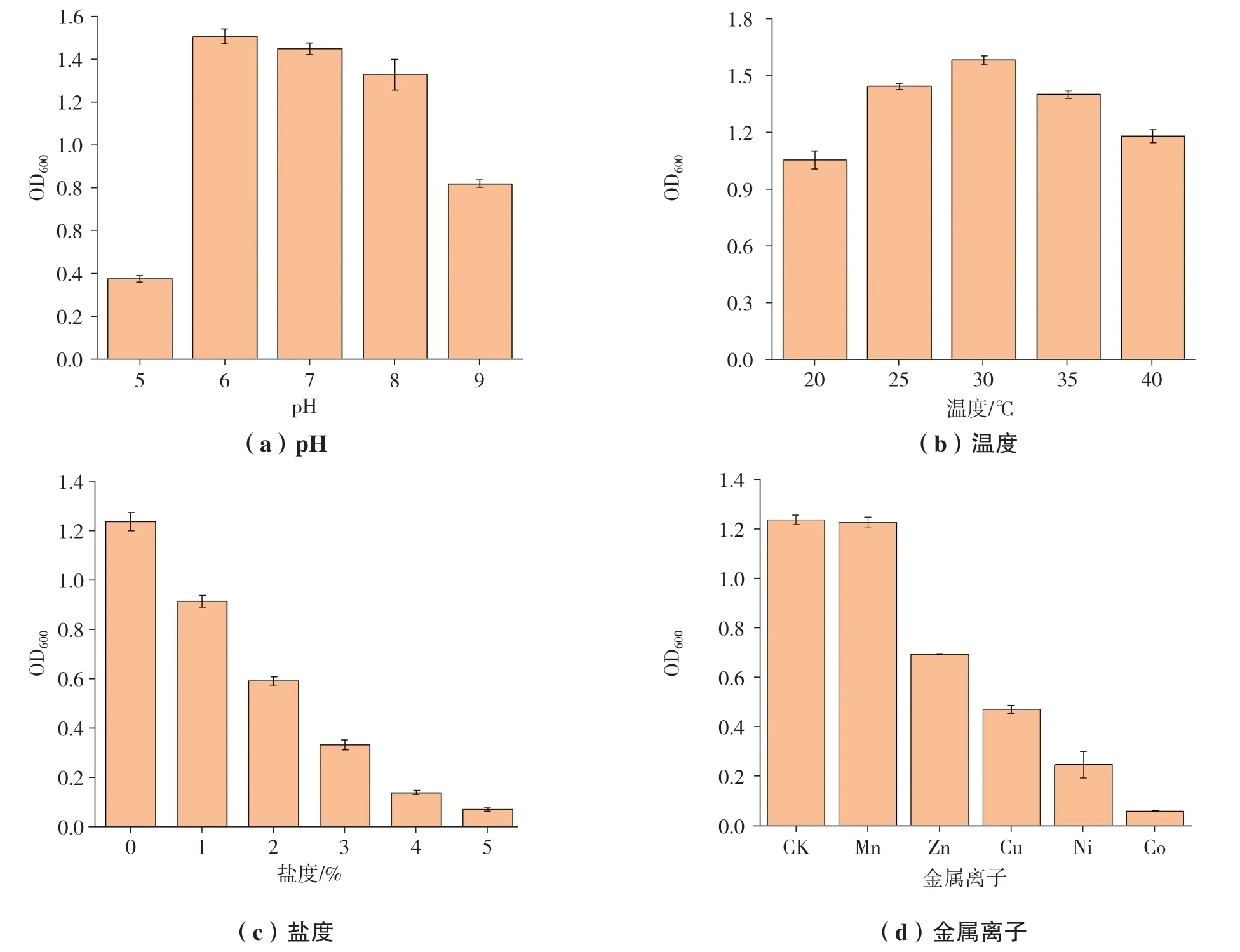
图3 菌株的生长特性
2.3 菌株的柴油降解特性
2.3.1 降解曲线
Y3对柴油的降解曲线,如图4所示。在7 d的培养过程中,菌株Y3持续生长,同时柴油降解率也不断提高,直至第5 d,OD600达到最高值,柴油降解率可达46.7%,随后趋于平稳,因此后续降解实验时长以5 d为宜。
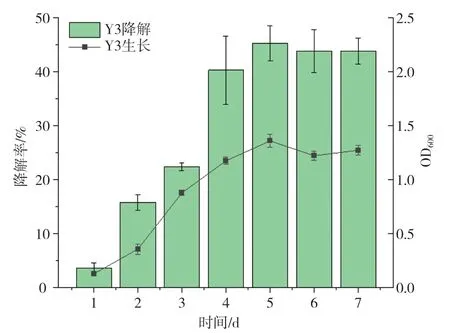
图4 菌株的柴油降解曲线
2.3.2 菌株的降解特性
由图5可知,随着接种量逐渐提高,菌株的OD600和柴油降解率也随之升高,当接种量为10%(V/V)时,菌株的OD600和柴油降解率最高,接种量超过10%(V/V)时,菌株的生长量和柴油降解率略有降低(图5-a)。由此可知,单纯提高接种量并不能显著提升菌株的柴油降解率,接菌量过大,会引起细菌竞争营养物质而使部分细菌死亡[13]。当接种量为5%,柴油浓度在1%(V/V)以内,菌株Y3生长旺盛,对柴油的降解率均在40%以上,而随着柴油浓度的提升,菌株的生长受到抑制,OD600仅为0.7左右,降解率大幅下降,后续实验均选择1%(V/V)柴油浓度进行(图5-b)。菌株Y3在30℃条件下柴油降解率最高,可达48.1%,温度为20℃和40℃时,发酵液相对澄清,Y3的生长与降解能力明显下降 (图5-c)。可见温度过高或过低,都会抑制微生物的代谢活动[14]。在pH为5的高酸性环境,菌株Y3难以生长,对柴油的降解率仅有10%,而在pH为6的弱酸环境下,Y3对柴油的降解效果最好,降解率可达55%(图5-d)。碳酸钠对Y3降解柴油的促进效果明显,柴油降解率由47.2%提升至71.2%(图5-e)。氯化铵为Y3降解柴油过程中的最佳氮源(图5-f)。
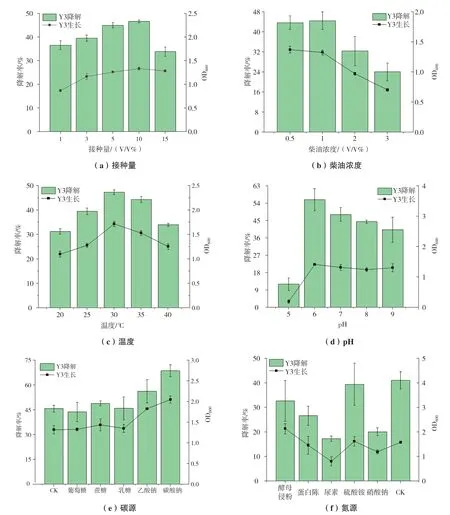
图5 菌株Y3的降解特性
2.4 柴油降解的GC-MS分析
长期的含柴油、燃料油潮湿泥土环境使菌株耐受碳氢化合物污染环境,而柴油富含长链烷烃,且燃料油中约含有52%的芳烃组分,使其很难被生物降解[15],从此环境中筛选得到的菌株Y3也由此具备了良好的碳氢化合物环境耐受性与降解能力。与未接菌的对照CK相比,在最适培养条件下培养5 d后菌株Y3对柴油中各组分(C10-C32)均有一定的降解效果,柴油各单一组分发生明显变化(图6)。菌株Y3对柴油中的直链烷烃具有良好的降解效果,均达到30%以上的降解率,其中正十六烷、正十九烷、正三十二烷的降解率分别达到47.8%、71.2%与51.2%,Y3对支链烷烃也有着一定降解能力,其中2,6,10-三甲基十三烷降解率高达57.6%(图7)。与菌株Y3相比,Ivanovaa等[16]筛选得到的嗜酸分枝杆菌对轻质低粘度油(体积分数为0.5%~1%)的正构烷烃和异烷烃降解率分别为99%和44%, Kim等[17]利用Mycobacterium vanbaalenii-PYR-1菌株对十二烷、十三烷、十六烷、二十烷、二十四烷、二十五烷和二十八烷(体积分数为1%)进行降解,发现其对十二烷、十三烷降解速度最快,分别为62%和68%,而其他烷烃降解率为20%~30%。这与菌株Y3降解特性相似,这种降解趋势在大多数代谢烷烃的分枝杆菌中较为典型[18]。但值得注意的是,以上研究中菌株对烷烃的降解时间分别长达28 d和30 d,而Y3仅用5 d即达到上述水平,可见Mycolicibacterium fluoranthenivoransY3有较高的烷烃降解效率。
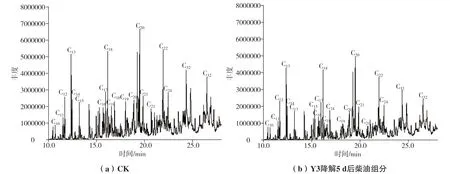
图6 柴油降解的GC-MS分析
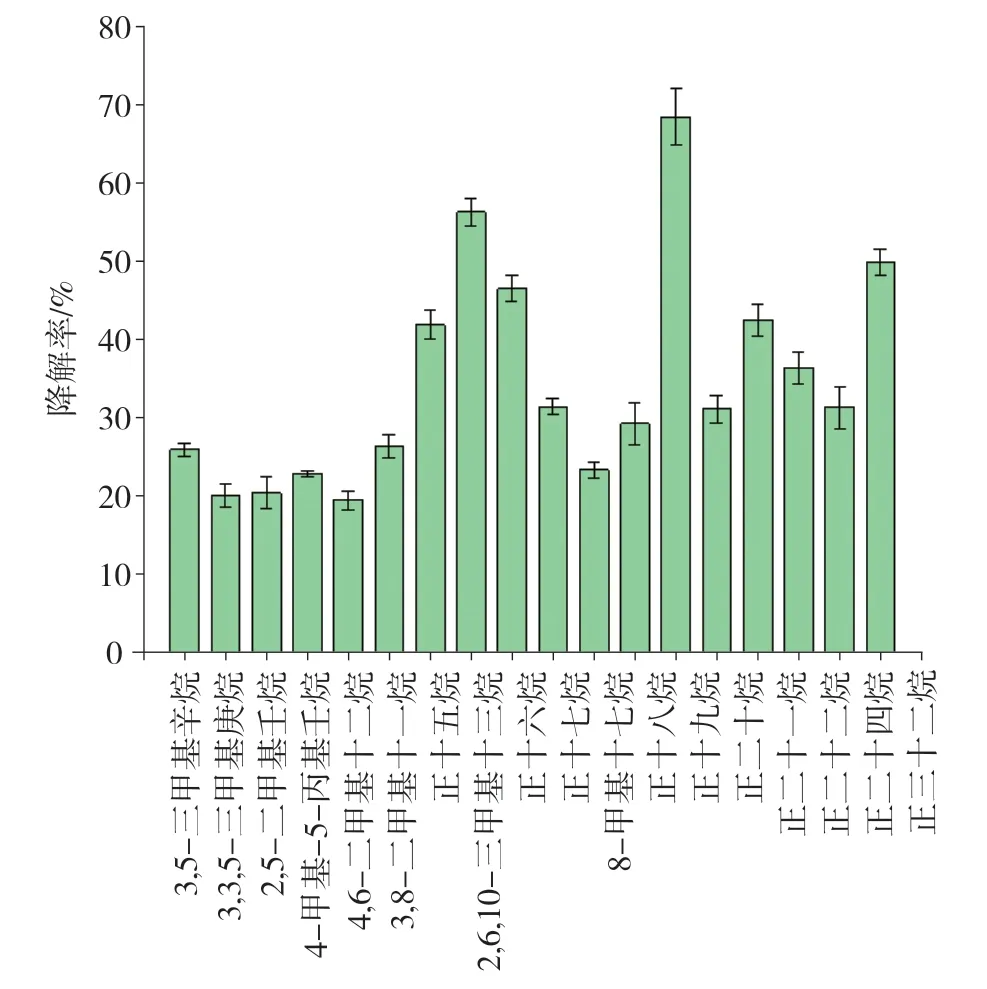
图7 菌株Y3对柴油各组分利用情况
鉴于上述研究的分析比较结果以及分枝杆菌对多环芳烃降解研究的普遍性[19,20],可见MycolicibacteriumfluoranthenivoransY3具有较为独特与高效的石油烃降解能力,同时,萤虫分枝杆菌(Mycolicibacterium fluoranthenivorans)的柴油烷烃降解特性是首次进行研究,填补了分枝杆菌降解柴油相关研究的空白,对分枝杆菌属修复石油烃污染的研究具有重要的推动意义。
3 结论
(1)从天津港南疆污水处理厂含油污泥中筛选得到MycolicibacteriumfluoranthenivoransY3菌株,具有良好的耐盐性以及耐Mn2+的能力。
(2)Y3能耐受3%(V/V)的柴油,在柴油浓度为1%(V/V)、接种量为10%(V/V)、温度为30℃、pH为6.0的条件下,降解柴油第5 d可达50.1%的降解率。
(3)Y3可降解柴油中所有的碳氢化合物(C10-C32),能够较好地利用直链或支链烷烃,在柴油等石油烃污染修复领域具有良好的应用价值。

