枸杞原浆抗氧化及增强免疫活性研究
杨 露 赵 冉 吴镇槐 余建强,2 杨佳美,2
(1. 宁夏医科大学药学院,宁夏 银川 750004;2. 宁夏特色中医药现代化工程技术研究中心,宁夏 银川 750004)
枸杞子(LyciumbarbarumL.)为茄科植物宁夏枸杞的干燥成熟果实[1],富含多糖、黄酮和氨基酸等活性成分,具有抗氧化及增强免疫力等功效[2-3],是中国传统的药食两用中药材。由鲜榨枸杞子制得的枸杞原浆,因其制备工艺可很大程度地避免干燥或熏制等加工方式而导致的营养成分流失和污染,且与传统枸杞泡水或泡酒等方式相比,可更充分地保留枸杞子原有的营养成分而倍受消费者青睐[4-6]。
研究[2-3]表明,枸杞子具有良好的抗氧化及增强免疫力活性。Cristiane等[7]通过秀丽隐杆线虫的存活率探究了枸杞原浆的安全性及抗衰老作用;Liu等[8]采用枸杞汁来调节解毒途径预防DEHP诱导的肝毒性;Wang等[9]采用枸杞汁来调节机体血糖。其中,抗氧化及增强免疫力功效作为人们关注度极高的健康保健作用,目前尚未见报道。
研究拟参考国食药监保化[2012]107号《关于印发抗氧化功能评价方法等9个保健功能评价方法的通知》中抗氧化功能评价方法和《保健食品检验与评价技术规范》(2003版)对华宝枸杞产业有限公司所生产的枸杞原浆进行抗氧化和增强免疫力功效评价,为更好地推广利用枸杞原浆及其制剂提供依据。
1 材料与方法
1.1 动物、材料与试剂
动物:SPF级ICR小鼠,雄性,标准体重,饲养于宁夏医科大学药效平台[温度(23±2) ℃,相对湿度(55±5)%],分笼饲养,自由进食进水并每日更换,宁夏医科大学动物中心;
还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)及总蛋白定量测定试剂盒:南京建成试剂有限公司;
蛋白质羰基测试盒及豚鼠血清:北京索莱宝科技有限公司;
枸杞原浆:华宝枸杞产业有限公司;
绵羊红细胞(2%,10%,20%):广州鸿泉生物科技有限公司;
都氏试剂:厦门海标科技有限公司;
碳酸钠及印度墨汁:上海源叶生物科技有限公司。
1.2 仪器与设备
全自动酶标仪:Thermo 1510型,美国Thermo Fisher Scientific公司;
全自动样品冷冻研磨仪:JXFSTPRP-CL型,上海精信实业发展有限公司;
多功能离心机:Z323K型,德国赫墨公司;
电热恒温水浴锅:DK-S24型,北京长源实验设备厂;
紫外分光光度仪:UV-2501PC型,上海嘉鹏科技有限公司;
电子天平:YP202N型,上海精密科学仪器有限公司。
1.3 方法
1.3.1 抗氧化功效动物试验设计 随机选取30只ICR小鼠进行3 d的适应性喂养后,分为正常组、模型组及枸杞原浆低(8.33 mL/kg)、中(16.67 mL/kg)、高(33.33 mL/kg)剂量组。灌胃45 d,期间正常组与模型组给予0.5 mL生理盐水。最后一次灌胃结束后,除正常组外,其他各组小鼠均在禁食16 h后一次性给予体积分数为50%的食品级乙醇溶液进行灌胃造模处理[10-11],小鼠灌胃量10 mL/kg·BW(0.1 mL/10 g)。造模6 h后将小鼠处死解剖并迅速取出其肝脏组织,于冰冷生理盐水中漂洗并用滤纸吸干表面水分后采用生理盐水将其低温匀浆,制备质量分数为10%肝脏组织匀浆液,2 000 r/min离心10 min,留上清液待测[12]。
1.3.2 抗氧化活性指标测定
(1) GSH、GSH-Px含量:二硫代二硝基苯甲酸显色分光光度法。
(2) MDA含量:硫代巴比妥酸法。
(3) 蛋白质含量:BCA显色分光光度法。
(4) 蛋白质羰基含量:分光光度法[13]。
1.3.3 增强免疫力动物试验设计 选择正常组动物模型[10],随机选取64只ICR小鼠进行3 d的适应性喂养后,分为2个免疫组(其中免疫1组进行迟发变态反应试验和血清溶血素试验,免疫2组进行脏器与体重比值和碳廓清试验),每个免疫组ICR小鼠32只,每个试验组又各设定正常组、枸杞原浆低(8.33 mL/kg)、中(16.67 mL/kg)、高(33.33 mL/kg)剂量组,其中正常组每天灌胃0.5 mL生理盐水。
1.3.4 增强免疫力功能指标测定
(1) 小鼠体质量和免疫器官指数:直接称量法。
(2) 迟发型变态反应:足跖增厚法。
(3) 血清溶血素抗体水平:半数溶血素法。
(4) 碳廓清吞噬指数:校正吞噬指数法[10]。
1.4 数据分析
采用SPSS 23.0统计软件进行数据分析,各组数据均采用均数±标准差表示,多组数据间比较采用单因素方差分析(One-way ANOVA),“n”表示“每组小鼠只数”,以P<0.05为具有统计学意义。
2 结果与分析
2.1 枸杞原浆对小鼠体质量的影响
由表1可知,采用枸杞原浆连续灌胃45 d后,各组小鼠的体重变化均无显著性差异,表明该枸杞原浆对小鼠体重影响不显著。
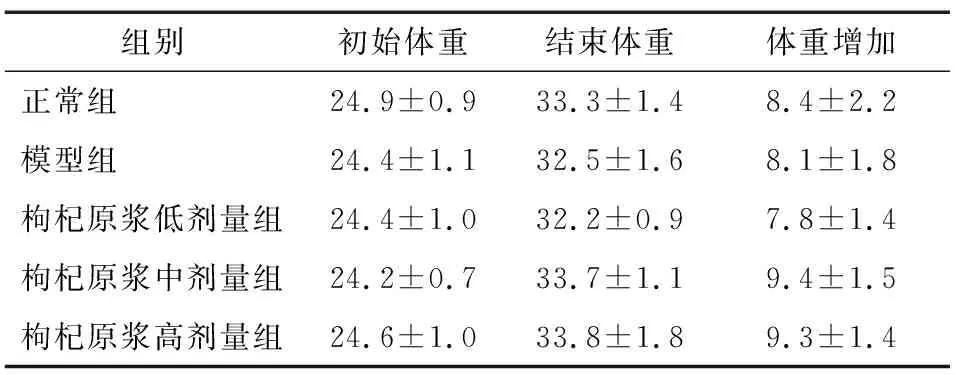
表1 枸杞原浆对不同组别小鼠体重的影响
2.2 枸杞原浆对小鼠抗氧化活性指标的影响
由表2可知,小鼠连续灌胃枸杞原浆45 d后,与正常组相比,模型组小鼠肝脏组织内GSH含量显著低于正常组(P<0.01),MDA和蛋白质羰基含量均显著高于正常组(P<0.01,P<0.001),血清中GSH-Px含量显著低于正常组(P<0.001),表明急性酒精肝损伤动物模型造模成功。枸杞原浆低(8.33 mL/kg)、中(16.67 mL/kg)、高(33.33 mL/kg)剂量组小鼠肝脏组织中GSH含量均显著高于模型组(P<0.05),MDA和蛋白质羰基含量均显著低于模型组(P<0.05,P<0.01,P<0.001),血清中GSH-Px含量均显著高于模型组(P<0.05,P<0.01),表明枸杞原浆可迅速提高肝损伤小鼠体内GSH及GSH-Px含量并降低MDA及蛋白质羰基含量,抗氧化作用良好。GSH可以清除体内过氧化氢及脂质过氧化物,其在体内含量越高说明机体抗氧化活力越强[10,14-16];机体可通过提高GSH-Px这类抗氧化物酶活力来强化机体清除自由基能力[10,17];当机体遭受脂质过氧化时,由于细胞膜内会产生大量不饱和脂肪酸,以致组织损伤[18],其主要产物为具有细胞毒性的MDA,其含量的高低反映了氧化应激的强烈程度且与细胞氧化损伤程度呈正相关[19];机体内氧化剂含量的升高会加速蛋白质的羰基化,致使细胞遭受自由基的攻击与破坏,体内蛋白质羰基含量越高,可间接地反映出机体抗氧化能力越弱[20-21]。
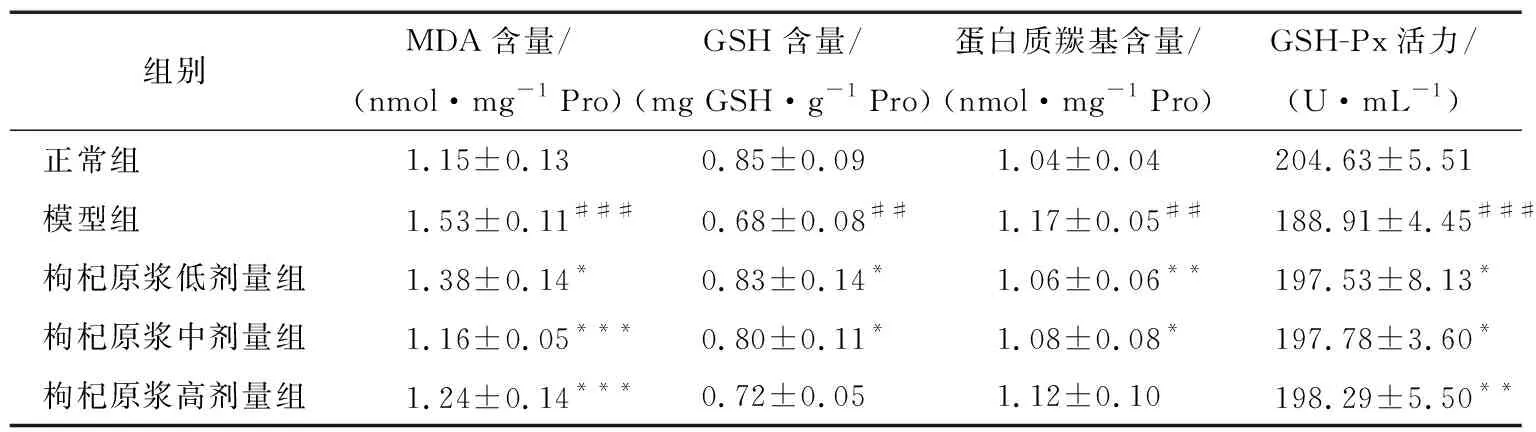
表2 枸杞原浆对小鼠肝组织中MDA、GSH、蛋白质羰基含量及血清中GSH-Px活力的影响†
2.3 枸杞原浆对小鼠免疫力的影响
由表3可知,经口给予小鼠不同剂量枸杞原浆45 d后,与正常组相比,枸杞原浆各剂量组小鼠脏器与体重的比值差异无统计学意义,表明该枸杞原浆不影响小鼠的生长发育。枸杞原浆低(8.33 mL/kg)、中(16.67 mL/kg)、高(33.33 mL/kg)剂量组小鼠足跖的增厚程度、半数溶血值及碳廓清吞噬指数均显著高于正常组(P<0.05,P<0.01,P<0.001),表明枸杞原浆能够提高小鼠足跖肿胀程度、血清抗体水平及碳廓清吞噬指数,具有良好的增强免疫力作用。迟发性变态反应是当机体被致敏性T细胞刺激时产生的一种细胞免疫反应,小鼠足跖的肿胀程度可直观反映出迟发性变态反应的强弱[22];血清溶血素水平通常采用半数溶血值来表示,其水平的高低可反映出机体形成抗体的能力,从而评价机体体液免疫功能能力的强度[23];机体非特异性免疫功能的强弱与巨噬细胞的吞噬能力呈正相关,碳廓清能力指数则代表巨噬细胞的吞噬能力[24]。因此,碳廓清能力的好坏可反映机体对巨噬细胞吞噬能力的强弱[12]。
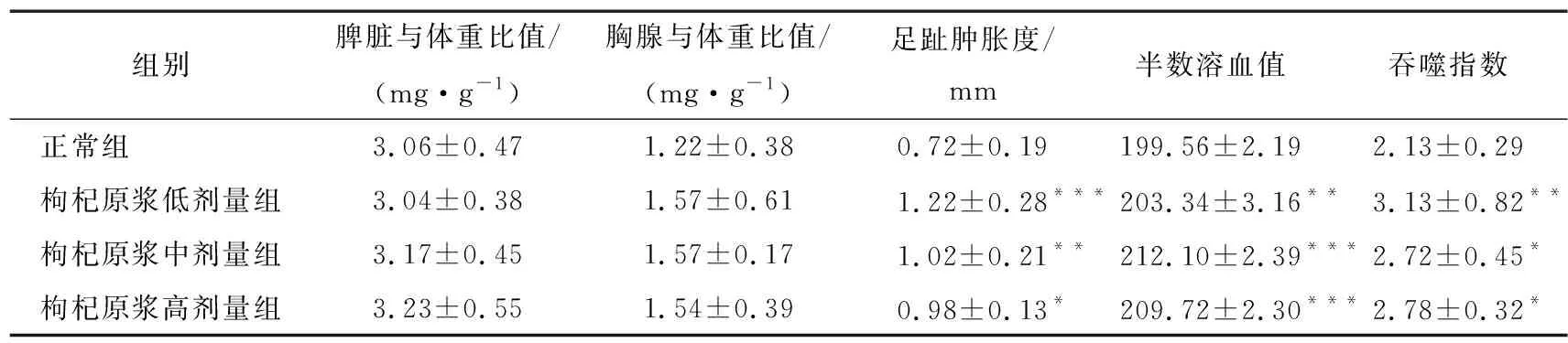
表3 枸杞原浆对小鼠免疫力的影响†
3 结论
采用小鼠体内试验对枸杞原浆进行抗氧化及免疫力活性探究。结果表明,枸杞原浆可降低急性肝损伤模型小鼠体内脂质及蛋白质氧化产物水平,减弱机体因脂质过氧化反应或活性氧引起的细胞损伤及机体氧化损伤,提高体内抗氧化物酶等抗氧化物物质含量,强化体内自由基反应系统的活力;枸杞原浆不影响正常小鼠的生长发育,可增强小鼠体内巨噬细胞吞噬活力,血清溶血素水平及迟发变态反应,促进机体单核—巨噬细胞功能、体液及细胞免疫活性,表现出良好的免疫作用。但有关枸杞原浆中发挥抗氧化及增强免疫力活性的化学成分确定及作用机制还有待进一步探究。

