大孔树脂纯化万寿菊花中叶黄素的工艺优化
吴红艳 石 岩 李秀鑫 安 琪
(齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161000)
万寿菊具有较高的营养保健价值,其花、叶可入药,有清热化痰、补血通经的功效[1]。由万寿菊提取分离制成的叶黄素产品可作为食品及饲料着色剂使用,同时在预防视网膜黄斑病变和艾滋病、提高人和动物免疫力、预防心脑血管疾病、作为新型饮料等方面具有卓越的生理功能[2]。万寿菊叶黄素提取后常用的纯化方法有柱色谱法、结晶法、高效逆流色谱法等,相比较而言,柱色谱法具有成本低廉、操作简单等特点,其中,大孔树脂被广泛应用于多酚、生物碱、黄酮等植物活性成分的分离纯化[3-5]。李育楠[6]采用HZ816树脂纯化玉米黄粉中的叶黄素,以V无水乙醇∶V乙酸乙酯为9∶1作洗脱剂进行洗脱,较皂化后叶黄素的纯度(92.17%)提高了4.32%。目前,从万寿菊中制备高纯度叶黄素的研究较少,且一些有关叶黄素纯化方法的研究存在纯度低、工艺复杂以及溶剂有毒性等问题,影响了万寿菊花资源的开发利用[7-8]。试验拟确定大孔树脂纯化万寿菊中叶黄素的工艺条件,进一步提高叶黄素的纯度,以期为后续工业化研究和开发万寿菊中叶黄素类产品提供依据。
1 材料与方法
1.1 材料与试剂
多力葵花油:佳格投资(中国)有限公司;
Tween80、Span80、氢氧化钾:河北市光复精细化工有限公司;
叶黄素标准品(纯度≥90%):上海源叶生物科技有限公司;
无水乙醇:河北市天力化工研究所;
万寿菊颗粒:广州立达尔生物科技股份有限公司;
X-5、S-8、D-352、D-101、HP-20大孔树脂:南昌市广富药品有限公司。
1.2 仪器与设备
水浴恒温振荡器:SHA-C型,河北阅近仪器有限公司;
可见分光光度计:722N型,济南易农仪器有限公司;
电子天平:BSA124S-CW型,德国赛多利斯科学仪器(北京)有限公司;
磁力搅拌器:IKAC-MAG HS-4型,艾卡(广州)仪器设备有限公司;
pH计:Sartorius谱及型,上海仪电科学仪器股份有限公司;
层析柱:1.5 cm×56 cm,河北庆傅仪器有限公司;
旋转蒸发器:RE-52AA型,湖南雅阳仪器有限公司。
1.3 试验方法
1.3.1 叶黄素粗制品的制备 万寿菊颗粒粉碎过80目筛,按m万寿菊粉∶V葵花籽油微乳液为1∶50 (g/mL)将万寿菊粉和葵花籽油微乳液混合均匀,添加1%纤维素酶。45 ℃恒温水浴中振荡2.0 h,用0.45 μm滤膜抽滤,收集滤液,经旋转蒸发得叶黄素粗提物。
1.3.2 叶黄素粗制品的皂化 按m叶黄素粗提物∶VKOH-C2H5OH溶液为5∶6 (g/mL)将叶黄素粗提物与0.15 g/mL 的KOH-C2H5OH溶液混合均匀,50 ℃下超声皂化58 min,将滤液旋转蒸发,得到浓缩液备用。
1.3.3 大孔树脂纯化叶黄素
(1) 最佳大孔树脂的选择:分别选取X-5、D-352、D-101、HP-20、S-8 5种大孔树脂,将纯品叶黄素分别与不同体积分数的乙醇混合均匀,制备成不同的叶黄素—乙醇稀释液,用叶黄素—乙醇稀释液吸附大孔树脂,真空抽滤,测定447 nm处吸光度值,并计算其吸附率。
(2) 静态吸附剂的选择:将纯品叶黄素分别与不同体积分数的乙醇混合均匀,制备成不同的叶黄素—乙醇稀释液,在不同温度、吸附时间、pH下进行吸附,真空抽滤,测定447 nm处吸光度值,并计算其吸附率。
(3) 上样浓度对静态吸附的影响:将纯品叶黄素分别与不同体积分数的乙醇混合均匀,制备成不同的叶黄素—乙醇稀释液,将稀释液配制成不同浓度的上样液,采用大孔树脂进行吸附,真空抽滤,测定447 nm处吸光度值,并计算其吸附率。
(4) 静态解析剂的选择:用超纯水对已吸附叶黄素的HP-20大孔树脂进行清洗,清洗液置于100 mL锥形瓶中,分别加入不同体积分数的乙醇,制备成不同的叶黄素—乙醇稀释液,不同温度、解析时间、pH下进行解析,真空抽滤,测定447 nm处吸光度值,并计算其解析率。
(5) HP-20型大孔树脂动态条件优化:分别考察上样质量浓度(流速0.4 mL/min,pH 6.0)和上样流速(pH 6.0,质量浓度0.01 mg/mL)对动态吸附吸附率的影响。
1.3.4 吸附率、解析率的计算 分别按式(1)、式(2)计算吸附率和解析率。

(1)
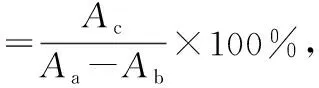
(2)
式中:
Q吸——吸附率,%;
Q解——解析率,%;
Aa——叶黄素稀释液的吸光度值;
Ab——大孔树脂吸附叶黄素后滤液的吸光度值;
Ac——大孔树脂解析叶黄素后滤液的吸光度值。
1.3.5 高效液相色谱检测纯化后叶黄素纯度 准确称量1 mg叶黄素,将其完全溶解至10 mL甲醇中,稀释制成0.1 mg/mL的标准溶液。C18反相色谱柱(4.6 mm×250 mm,5 μm),流动相为乙酸乙酯,柱温30 ℃,进样量1 μL,流速0.5 mL/min,检测波长447 nm。
1.3.6 数据处理 所有试验重复3次,采用Origin和Excel软件进行图表绘制,通过SPSS软件对数据进行显著性分析,字母不同表示差异显著(P<0.05)。
2 结果与讨论
2.1 最佳大孔树脂的选择
由图1可知,大孔树脂种类对色素的纯化效果存在差异,吸附率从高到低依次为大孔树脂HP-20>D-101>X-5>S-8>D-352。HP-20、D-101、S-8 3种大孔树脂均属于非极性,根据相似相溶的原理,如果树脂的极性接近吸附颗粒的极性,则其吸附能力会更好。S-8和D-352是极性树脂,叶黄素是脂溶性色素,几乎不溶于水所以其吸附率较低。大孔树脂HP-20的解析率最高,是因为该树脂具有表面积大和孔径大的特点,更有助于色素的吸附和解析。故选取大孔树脂HP-20对万寿菊中的叶黄素进行纯化。
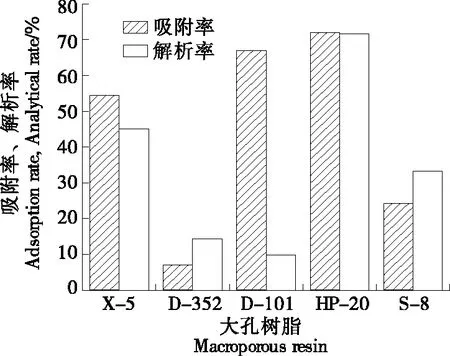
图1 大孔树脂对叶黄素吸附率和解析率的影响
2.2 静态吸附剂的选择
由图2可知,当乙醇体积分数<80%时,吸附率与乙醇体积分数呈正比,是因为乙醇使大孔树脂发挥作用,使其得到了充分的溶胀,因此其吸附能力增强即吸附率高;当乙醇体积分数>80%时,吸附率呈下降趋势,可能是由于大孔树脂的吸附达到了饱和,故选择体积分数为80%的乙醇溶液作为吸附剂。
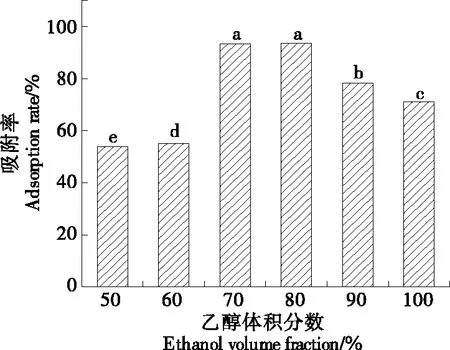
图2 乙醇体积分数对叶黄素吸附率的影响
2.3 上样质量浓度对静态吸附的影响
由图3可知,随着上部样品质量浓度的增加,吸附量先增大后减小。当上样质量浓度>0.01 mg/mL时,吸附速率趋于下降。上样质量浓度太高,杂质含量增加,叶黄素与大孔树脂之间的接触面积减少,可能会影响大孔树脂对叶黄素的吸附[9]。因此,选择0.01 mg/mL的样品质量浓度作为最佳吸附条件。
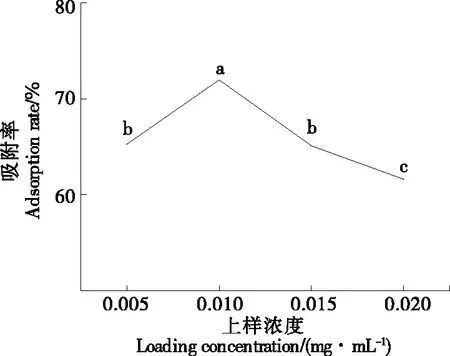
图3 上样质量浓度对叶黄素静态吸附率的影响
2.4 静态吸附单因素试验
2.4.1 温度对静态吸附率的影响 由图4可知,当温度为30 ℃时,HP-20型大孔树脂静态吸附率最高,当温度>30 ℃时,吸附率呈下降趋势。温度越高,叶黄素的稳定性越差,其稀释液更容易挥发,故吸附率降低[10]。因此,选取静态吸附温度为30 ℃。
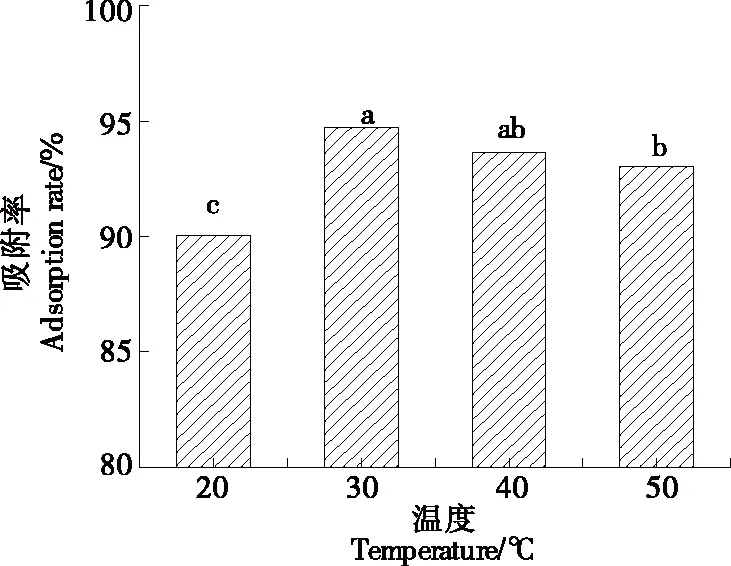
80%乙醇,pH 5.0,吸附时间2 h
2.4.2 吸附时间对静态吸附率的影响 由图5可知,随着吸附时间的增加,静态吸附速率先增大后趋于稳定。当吸附时间>3 h时,吸附速率无明显变化,HP-20大孔树脂已处于吸附饱和状态。因此,选择静态吸附时间为3 h。
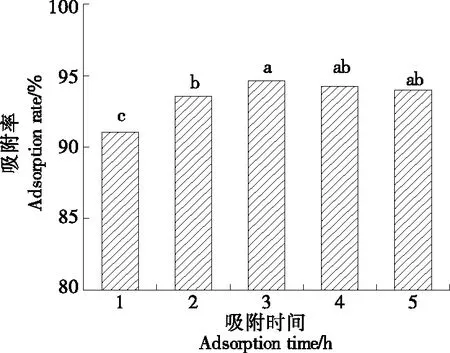
80%乙醇,pH 5.0,温度30 ℃
2.4.3 pH对静态吸附率的影响 由图6可知,当稀释液的pH为3.0~6.0时,叶黄素的吸附率呈上升的趋势,当稀释液的pH>6.0时,吸附率下降。这可能是由于弱酸条件下,叶黄素易与大孔树脂发生氢键作用,使其更容易吸附在大孔树脂上[13],因此选取pH为6。

80%乙醇,温度30 ℃,吸附时间2 h
2.5 静态吸附正交试验
在单因素试验的基础上,选择温度、吸附时间和pH为试验因素,以大孔树脂吸附率为考察指标,进行三因素三水平正交试验优化静态吸附工艺条件,试验因素水平见表1,试验设计及结果见表2。
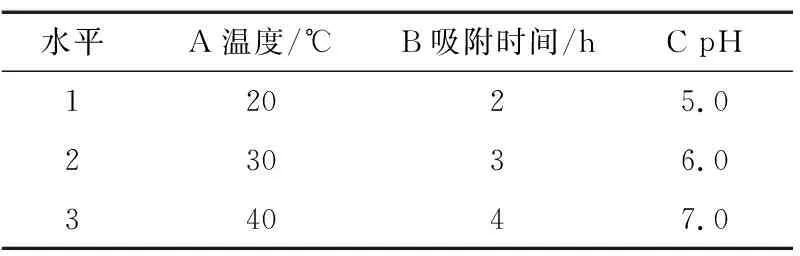
表1 静态吸附正交试验因素水平表
由表2可知,各因素对大孔树脂吸附率的影响顺序为温度>吸附时间>pH,最佳试验组合为A2B1C3,即温度30 ℃,吸附时间2.0 h,pH 7.0,测得平均吸附率为(96.35±0.032)%(n=3)。

表2 静态吸附正交试验设计及结果
2.6 静态解析剂的选择
由图7可知,随着乙醇体积分数的增加,HP-20型大孔树脂对叶黄素的解析率增加,是由于乙醇溶液可以使大孔树脂得到充分溶胀,同时叶黄素在乙醇中溶解度较高,使叶黄素和大孔树脂之间的作用力减小,将其叶黄素从大孔树脂中洗脱出来溶解于乙醇溶液中。由于无水乙醇的解析率最高,因此选取其作为大孔树脂的解析溶剂。
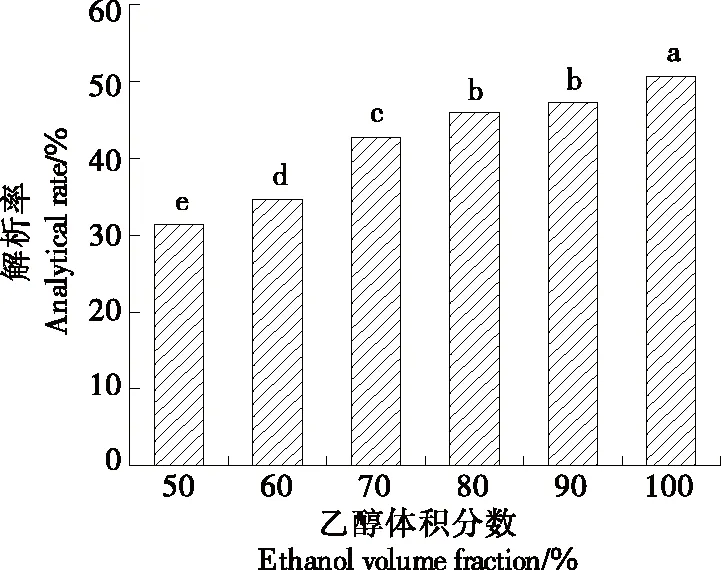
图7 乙醇体积分数对静态解析率的影响
2.7 静态解析单因素试验
2.7.1 温度对静态解析率的影响 由图8可知,随着温度的升高,解析率先增加后降低。当温度为40 ℃时,叶黄素的解析率最高。当温度>40 ℃时,解析率呈下降趋势。因此选取40 ℃作为最佳解析温度。
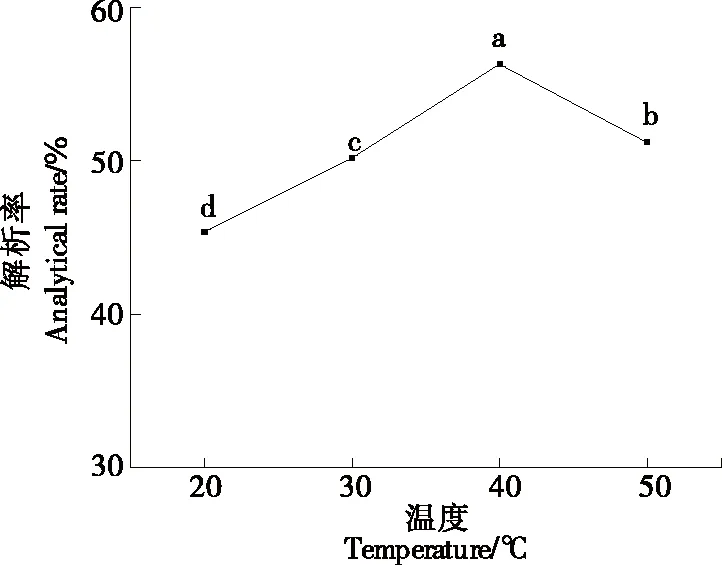
pH 5.0,解析时间2 h
2.7.2 pH对静态解析率的影响 由图9可知,当pH为3.0~5.0时,解析率随之增加,当pH>5.0时,解析率趋于平稳,对叶黄素的解析率无显著性影响。为了节约实际用量,选取pH 5.0作为最佳解析条件。
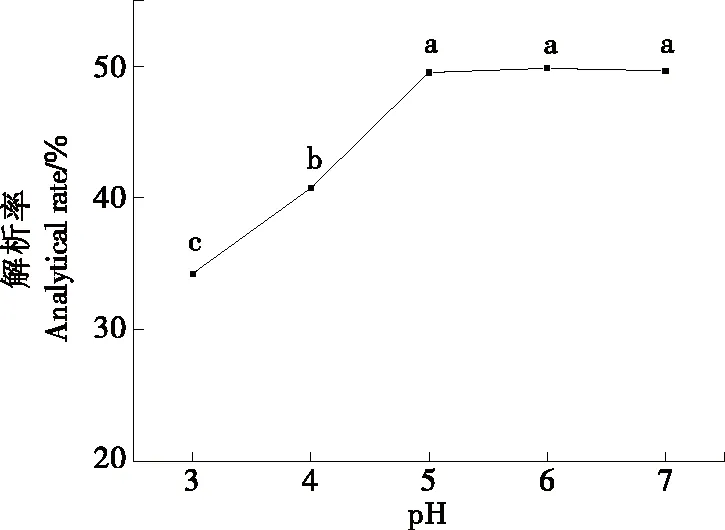
温度30 ℃,解析时间2 h
2.7.3 解析时间对静态解析率的影响 由图10可知,随着解析时间的增加,解析率呈先增加后降低的趋势。当解析时间为1~3 h时,解析率基本不变,其中2 h时的解析率最高,当解析时间>3 h后解析率出现了急剧下降,是因为解析时间过长,叶黄素的稳定性变差,且无水乙醇挥发,影响解析结果。因此选取2 h为最佳解析时间。
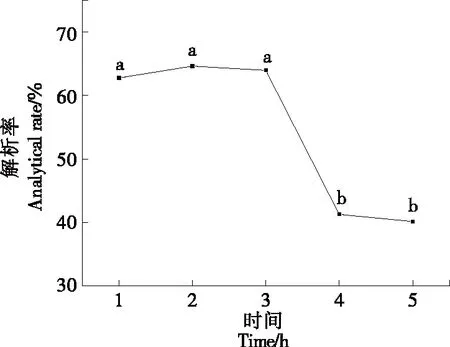
pH 5.0,温度30 ℃
2.8 静态解析正交试验
在单因素试验的基础上,选择温度、解析时间和pH为试验因素,以大孔树脂解析率为考察指标,进行三因素三水平正交试验优化静态解析工艺条件,试验因素水平见表3,试验设计及结果见表4。

表3 静态解析正交试验因素水平表
由表4可知,各因素对大孔树脂吸附叶黄素解析率的影响依次为温度>解析时间>pH,最佳工艺组合为A2B1C3,即温度40 ℃,解析时间1.0 h,pH 7.0,测得平均解析率为(72.23±0.064)%(n=3)。
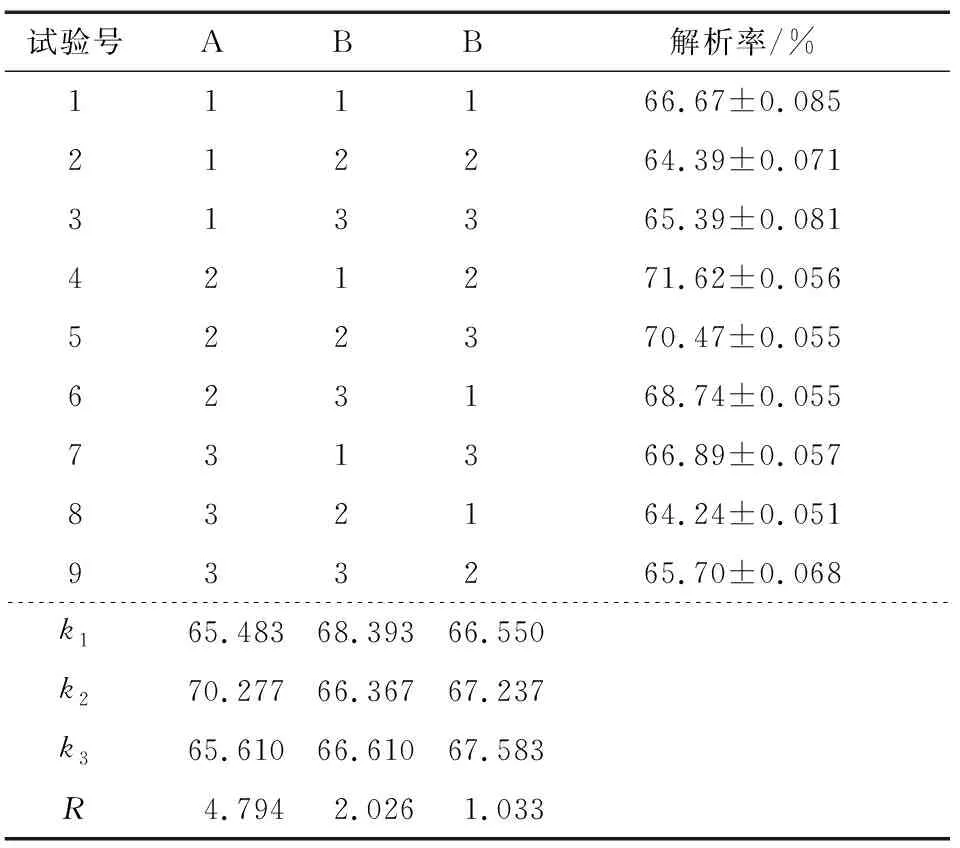
表4 静态解析正交试验设计及结果
2.9 HP-20型大孔树脂动态吸附条件优化
2.9.1 上样质量浓度对动态吸附的影响 由图11可知,叶黄素的吸附量随样品溶液质量浓度的增加而先增加后减少。当上部样品质量浓度>0.01 mg/mL时,会发生部分溶质泄漏,导致叶黄素的损失和浪费[11]。因此,当样品质量浓度为0.01 mg/mL时,叶黄素的动态吸附效果最好。
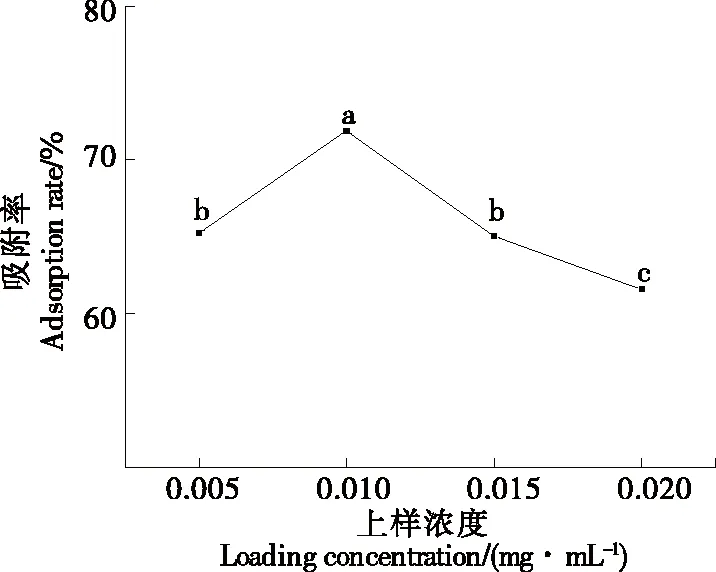
图11 上样质量浓度对叶黄素动态吸附率的影响
2.9.2 上样流速对动态吸附的影响 由图12可知,叶黄素的吸光度值随样品溶液上样流速的增加而增加。当上样流速>0.4 mL/min时,吸光度值突然升高,说明叶黄素并未被大孔树脂完全吸附便已流出[12]。因此,当上样流速为0.4 mL/min时,叶黄素的动态吸附效果最好。

图12 上样流速对叶黄素动态吸附的影响
2.10 纯化样品与叶黄素标准品的对比
由图13可知,试验所纯化的叶黄素与纯品叶黄素的出峰时间基本一致,差距较小,出现偏差是因为样品浓缩液中不能完全去除杂质,但是经过大孔树脂吸附等一系列的提纯操作可以得到纯度为61.72%的万寿菊叶黄素纯度,基本达到提纯目的。
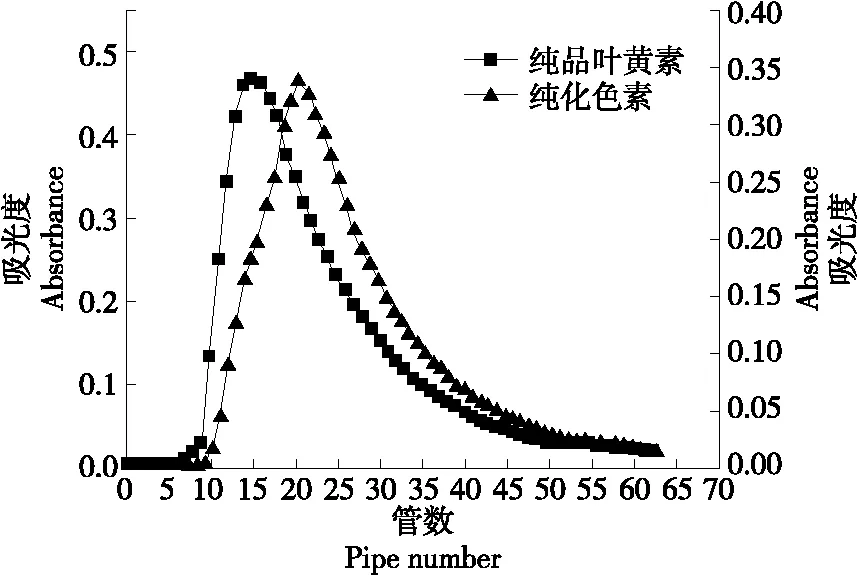
图13 上样质量浓度对叶黄素动态吸附率的影响
3 结论
采用大孔树脂将叶黄素粗品进行纯化,通过吸附率以及解析率对其静态和动态条件进行优化。结果表明:静态试验中,HP-20型大孔树脂对叶黄素的吸附与解析效果最好,选取体积分数为80%的乙醇作为吸附剂,最佳静态吸附质量浓度为0.01 mg/mL,选取无水乙醇作为解析剂。大孔树脂对叶黄素的最佳吸附工艺条件为温度30 ℃,吸附时间2.0 h,pH 7.0;最佳解析工艺条件为温度40 ℃,解析时间1.0 h,pH 7.0。动态试验中,样品溶液的最佳吸附质量浓度为0.01 mg/mL,最佳样品流速为0.4 mL/min。通过高效液相色谱法测定其纯度可达61.72%。后续需进一步分离纯化以提高叶黄素纯度。

