小鼠急性肾损伤致远端肺凋亡和程序性坏死的时程变化
杨子恒,秦志刚,黎洁钰,刘祥凤,李翼容,李 鹏,顾健腾
400038重庆,陆军军医大学(第三军医大学):第一附属医院麻醉科1,药学与检验医学系生药学与中药学教研室2
急性肾损伤(acute kidney injury,AKI)是临床常见危急重症,其发生率住院患者为10%~15%,ICU患者常超过50%。AKI常导致肾外多器官病理性损伤和功能障碍,其所引起的远端急性肺损伤(acute lung injury,ALI)更是危重病患者常见的死因。尽管近年来连续肾脏替代治疗、体外膜肺氧合等手段相继应用于临床,但与AKI相关的发病率和病死率却无较大改善。研究表明,ICU患者单纯AKI时病死率为44%~53%,合并ALI时病死率将跃升至75%。然而,目前AKI致ALI的分子机制尚不十分清楚,现有研究表明肾源性的TNF-α、IL-6和某些损伤相关分子模式蛋白(damage associated molecular patterns, DAMPs)是诱发肺组织程序性细胞死亡(programmed cell death,PCD)的重要原因。
PCD是受基因编码调控决定的细胞死亡方式。既往认为凋亡属于PCD,而坏死不属于PCD。近年随着对细胞死亡机制研究的深入,发现有的坏死也可由基因编码形成PCD。PCD根据细胞死亡启动和执行蛋白、路径的不同,分为凋亡、程序性坏死、焦亡、铁死亡等。不同细胞类型以及刺激信号的差异,决定了细胞的死亡方式。凋亡是Caspase依赖性死亡,分为死亡受体介导的外源性和依赖线粒体膜通透性改变的内源性两种;凋亡细胞皱缩、核仁裂解、胞膜内陷形成多个由质膜包裹的凋亡小体,无内含物外泄,不会引发周围组织炎症反应。程序性坏死是Caspase非依赖性死亡,由包括肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)等在内的各死亡受体介导发生;程序性坏死细胞器肿胀、胞膜穿孔、胞体崩解进而释放炎症介质,引发周围组织细胞免疫应答和炎性反应。课题组前期研究证实,AKI可导致肺脏细胞出现凋亡和程序性坏死两种死亡形式。然而,AKI致ALI过程中,凋亡与程序性坏死随时间变化规律并不清楚。因此,本研究拟在AKI致ALI模型中探索凋亡和程序性坏死的时程变化规律,以期能基于细胞PCD时程变化特点进行干预,为临床防治AKI所致ALI提供新的视角。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级8周龄雄性C57BL/6J小鼠,体质量20~25 g,购自陆军军医大学实验动物中心。动物实验获得陆军军医大学实验动物管理委员会许可,并严格遵从国家实验动物管理及使用指南的相关规定。
1.1.2 主要试剂与仪器 研究使用了TUNEL检测试剂盒(北京普洛麦格生物技术有限公司),cleaved Caspase-3抗体(上海赛信通生物试剂有限公司),p-MLKL(ser345)抗体(上海赛信通生物试剂有限公司),p-RIP1抗体(上海圣克鲁斯生物科技有限公司),BCA蛋白浓度测定试剂盒(上海碧云天生物科技有限公司),BeyoGelPlus PAGE预制胶(上海碧云天生物科技有限公司),脱脂奶粉(上海碧云天生物科技有限公司),肌酐、尿素氮测定试剂盒(南京建成生物工程研究所)。
1.2 方法
1.2.1 AKI致ALI小鼠模型建立 课题组先前研究已建立C57BL/6J小鼠AKI致ALI模型:2%异氟醚麻醉诱导小鼠后,1.5%异氟醚吸入麻醉维持。碘伏消毒后沿下腹正中线皮下罗哌卡因浸润麻醉,作一约1.5 cm切口,探查分离出双侧肾蒂并应用微血管夹子夹闭50 min后开放(肾脏IRI)。夹闭肾蒂后腹腔注射温生理盐水0.5 mL维持补液,温纱布覆盖开腹口。肾蒂开放后,逐层缝合腹壁切口,术毕腹部皮下注射0.5 mL温生理盐水补充水分。
1.2.2 动物分组与处理 动物术前禁食12 h,自由饮水。30只8周龄C57BL/6J小鼠,体质量20~22 g按照随机数字表法平均分为6组(n
=5), Sham组:行开腹关腹手术;肾缺血再灌注(RI/r)6、12、24、36、48 h组:双肾夹闭缺血50 min后,分别再灌注6、12、24、36、48 h。取材时统一取小鼠左肺进行石蜡包埋和切片,右肺冻存于-80 ℃冰箱用于后续Western Blot实验。1.2.3 血清肌酐(creatinine,Cr),尿素氮(blood urea nitrogen,BUN)含量测定 使用3%异氟烷将动物麻醉后于无菌操作下抽取腹主动脉血(0.5 mL),4 ℃过夜后4 ℃离心(3 000 r/min)15 min,取上清,使用Cr、BUN测定试剂盒(南京建成生物工程研究所)进行检测。
1.2.4 肺脏HE染色及病理评估 按照分组处理后,统一取左肺进行HE染色评估,参照我们前期研究报道分级:0级,正常形态;1级,轻度肺间质充血和中性粒细胞浸润;2级,血管周围水肿形成,肺组织结构部分损坏,中度中性粒细胞浸润;3级,肺组织结构损坏严重,高密度中性粒细胞浸润。
1.2.5 TUNEL试剂盒染色检测各组肺组织凋亡水平 取小鼠肺石蜡切片,脱蜡至水后严格按照说明书操作进行凋亡细胞染色(绿色荧光),用DAPI进行细胞核染色(蓝色荧光)。高倍镜下观察荧光,随机选取5个视野计数凋亡细胞核数,计算细胞凋亡率。
1.2.6 免疫荧光染色检测肺组织程序性坏死水平 取小鼠肺石蜡切片,脱蜡至水后使用柠檬酸钠溶液高压抗原修复,随后p-MLKL(ser345)抗体1∶100孵育染色,DAPI染核,抗荧光淬灭封片剂封片后显微镜下观察并采集图像。随机选取5个视野计数,计算细胞程序性坏死率。
1.2.7 Western Blot检测肺组织凋亡和程序性坏死水平 Western Blot检测磷酸化受体相互作用蛋白激酶1(phosphorylation receptor-interacting protein 1,p-RIP1)、磷酸化混合系列蛋白激酶样结构域蛋白(phosphorylation mixed lineage kinase domain like protein,p-MLKL)和cleaved Caspase-3 各组肺组织加入蛋白裂解液(改进RIPA裂解液)进行冰上裂解,12 000×g
离心10 min,取上清并测定其浓度,SDS-PAGE电泳分离后转移至PVDF膜,随后常规封闭、p-RIP1抗体(1∶1 000),p-MLKL抗体(1∶1 000),cleaved Caspase-3抗体(1∶1 000)孵育后曝光显影并分析。1.3 统计学分析
采用GraphPad 8.0.1软件分析实验数据,所有结果以表示,组间比较采用t
检验,以P
<0.05为差异具有统计学意义。2 结果
2.1 肺脏HE染色及病理评估
HE染色显示,肾缺血再灌注后,随着时间的推移,肺病理性损伤逐渐加重。与Sham组相比,RI/r24、48 h组肺组织结构损坏严重,中性粒细胞浸润明显(图1A),肺损伤评分显著升高(P
<0.05,图1B)。与RI/r24 h组相比,RI/r48 h组肺组织损伤程度无显著差异。
a:P<0.05,与Sham组比较; b:P<0.05,与RI/r6 h组比较; c:P<0.05,与RI/r12 h组比较
2.2 小鼠血清Cr与BUN水平变化
肾缺血再灌注后,Cr和BUN水平逐渐升高,24 h时分别达到(185.70±11.66) μmol/L和(19.93±1.28)mmol/L,显著高于Sham组的(24.07±3.33)μmol/L和(5.18±0.71)mmol/L(图2,P
<0.05)。与缺血再灌注24 h相比,缺血再灌注48 h的Cr和BUN无显著差异。
a:P<0.05,与Sham组比较; b:P<0.05,与RI/r6 h组比较; c:P<0.05,与 RI/r12 h组比较
2.3 肺组织TUNEL检测凋亡的时程变化
使用TUNEL法进行细胞凋亡检测。染色结果显示,肾缺血再灌注早期,TUNEL阳性细胞数量处于较低水平,12 h后显著增加持续至48 h(图3A)。与Sham组比较,RI/r 6 h组肺组织细胞凋亡水平升高并不显著(P
>0.05),12 h后显著升高(图3B,P
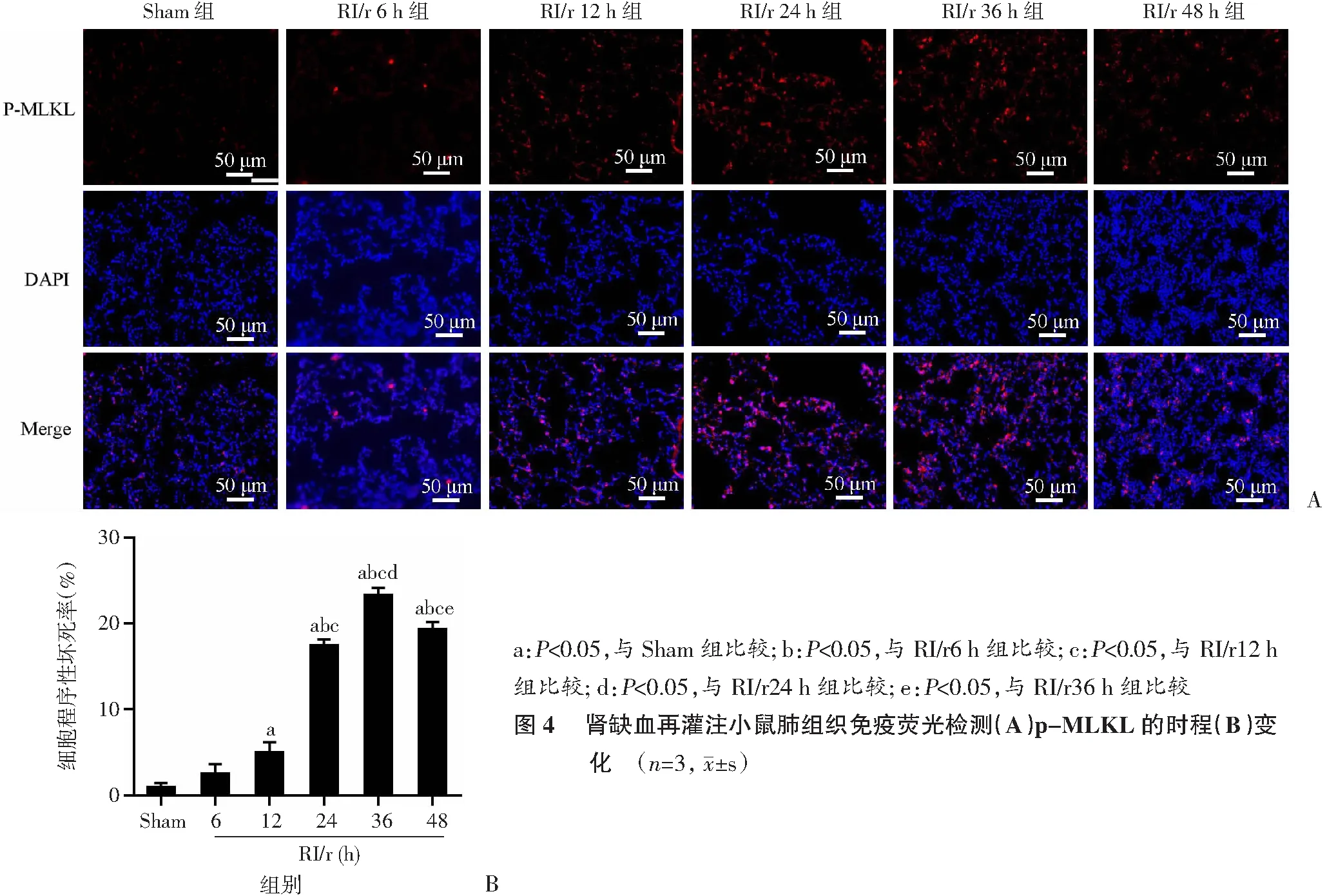
<0.05)。2.4 肺组织免疫荧光检测p-MLKL的时程变化
使用免疫荧光检测程序性坏死终末效应蛋白p-MLKL可观察到,肾缺血再灌注早期p-MLKL无明显表达,与Sham组比,RI/r 24 h组p-MLKL表达显著增多(P
<0.05)且与RI/r 24 h组比,RI/r 36 h组p-MLKL表达达到峰值(P
<0.05),随后表达有下降趋势(图4)。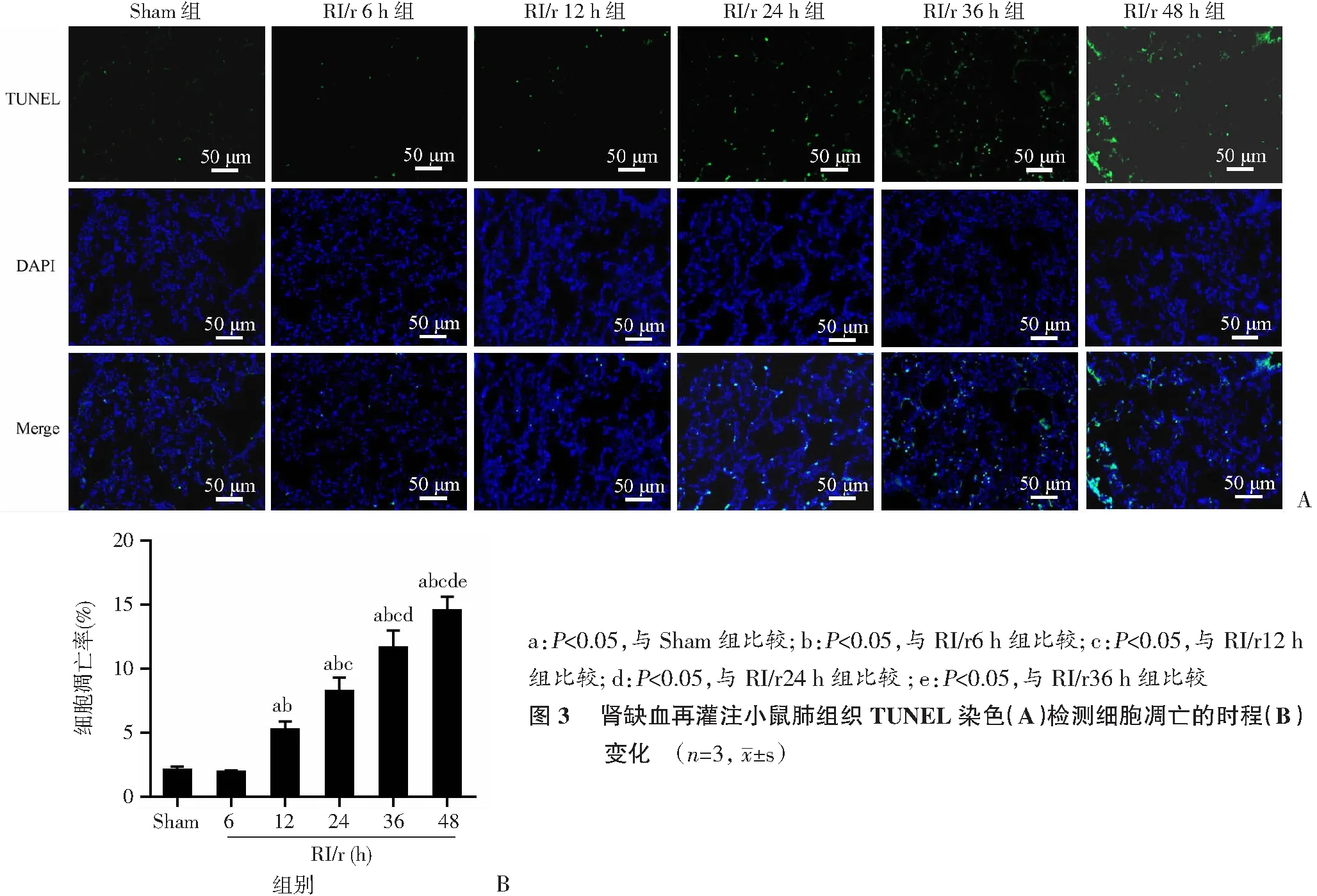
2.5 p-RIP1、p-MLKL和cleaved Caspase-3的时程变化
肾缺血再灌注初期,程序性坏死标志蛋白p-RIP1及p-MLKL随再灌注时间延长无显著升高(P
>0.05);与RI/r24、48 h组比较,RI/r 36 h组p-MLKL达到高峰(P
<0.05),与RI/r24 h组比较,RI/r48 h组p-MLKL下降至24 h点水平(P
>0.05),而p-RIP1表达仍呈延续上升趋势。与Sham组相比,RI/r6 h组和RI/r12 h组凋亡标志蛋白cleaved Caspase-3并未出现显著变化(P
>0.05),与RI/r24 h组比较,RI/r36 h组和RI/r48 h组cleaved Caspase-3出现显著上调(P
<0.05),见图5。
a:P<0.05,与Sham组比较; b:P<0.05,与RI/r6 h组比较; c:P<0.05,与RI/r12 h组比较; d:P<0.05,与RI/r24 h组比较;e:P<0.05,与RI/r36 h组比较
3 讨论
AKI可导致远端肺组织病理性损伤和功能障碍,此为其病死率居高不下的重要原因之一。多种损伤因素引起的肺细胞PCD是AKI诱发远端ALI的重要潜在因素。近年研究显示,肺损伤后细胞丢失与潜在的凋亡-程序性坏死轴密切相关,该理论与本课题组前期研究数据结果相一致。相较于凋亡,程序性坏死会释放更多的致损炎性介质,加剧组织的损伤。AKI释放的TNF-α等细胞因子激活TNFR是促发远端肺组织外源性凋亡和程序性坏死的共同通路,而这两种关系密切的死亡方式在AKI致ALI早期的分布与变化规律目前尚不明确。目前主流理论认为,TNF-α与TNFR1结合后所促发的系列胞内信号传到至Caspase-8,若Caspase-8被激活,则将切割RIP1、RIP3使其失活,最终由Caspase-3执行细胞的凋亡;如果Caspase-8被抑制,RIP1和RIP3磷酸化并形成坏死复合体,活化的RIP3招募其下游底物混合系激酶样结构域蛋白(MLKL),使其磷酸化并从单体形成寡聚体,从细胞质转移到细胞膜,其N末端插入胞膜结构内,与膜上心磷脂和磷脂酰肌醇结合,破坏胞膜完整性并形成孔道,导致胞内物质释放以及钙内流,最终诱发程序性坏死。
因此,探究AKI后远端肺组织凋亡和程序性坏死的分布变化规律,有助于阐述不同死亡方式间的内在调控规律,同时为AKI后不同时间点采取针对性的治疗方案提供思考。
本研究发现,小鼠AKI后24 h内,随着时间的推延,肾功能和肺组织损伤程度逐渐增加,肺细胞凋亡和程序性坏死也进行性加重。24 h后,肺组织损伤评分维持在最高级别,而肾功能不再有显著差异,可能与原发器官开始进行损伤修复有关。组织染色数据提示,肺组织程序性坏死在肾缺血再灌注后呈现出显著上升趋势且于36 h时间点先达到高峰,随之下降,有可能与机体自身的抗炎机制逐渐启动,从而下调炎症水平有关;在48 h时间窗内,凋亡早期维持并不显著,24 h后呈现出稳步上升态势,48 h时间点显著增强。上述现象提示36 h可能是两种死亡方式进程的转折点,在随后48 h时间点可观察到程序性坏死水平下调,而凋亡水平出现较大幅提高。
有趣的是,36 h/48 h时间点可观察到程序性坏死上游信号p-RIP1进一步增强,而其下游最终效应蛋白p-MLKL却呈现下降趋势,我们初步对组织Caspase-8的活性检测分析并未发现有显著变化,提示可能与Caspase-8非经典磷酸化活化通路激活有关,在参与程序性坏死抑制过程的同时进一步推动细胞凋亡水平上升。
本研究存在一定的不足之处:①整个实验并未观测到细胞凋亡的达峰时间,观察窗口时间设置有待进一步延长;②由于小鼠动脉血较少且取样存在一定难度,未使用血气分析检测肺功能;③对于细胞凋亡及程序性坏死相关变化的具体信号机制有待深入探索。
综上所述,本研究探索并描述了AKI致肺损伤背景下肺细胞凋亡和程序性坏死两种PCD的时程变化规律,为进一步探索AKI致肺细胞死亡机制及针对该疾病在不同时间节点制订治疗策略提供理论基础。

